
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Знание формул для статистики Максвелла, среднеквадратичная скорость
1. Распределение Максвелла имеет вид 1) 2) 3)
2. Распределение Максвелла имеет вид 1) 2) 3) 3. Распределение Максвелла имеет вид 1) 2) 3) 4. Средняя скорость молекул определяется формулой 1) 5. Наиболее вероятная скорость молекул определяется формулой 1) 6. Среднеквадратичная скорость молекул определяется формулой 1) 7. Средняя скорость молекул определяется формулой 1) 8. Наиболее вероятная скорость молекул определяется формулой 1) 9. Среднеквадратичная скорость молекул определяется формулой 1) 10. Среднеквадратичная скорость молекул зависит от температуры как 1) 11. Среднеквадратичная скорость молекул некоторого газа при температуре 500 К была 500 м/с. Чему стала равна среднеквадратичная скорость молекул этого газа при температуре 900 К? 1) 670 м/с 2) 740 м/с; 3) 800 м/с. 12. Средняя скорость молекул некоторого газа при температуре 300 К была 1000 м/с. Чему стала равна средняя скорость молекул этого газа при температуре 800 К? 1) 1,6 км/с 2) 2 км/с; 3) 2,4 км/с. 13. Наиболее вероятная скорость молекул некоторого газа при температуре 400 К была 400 м/с. Чему стала равна наиболее вероятная скорость молекул этого газа при температуре 1200 К? 1) 571 м/с 2) 692 м/с; 3) 813 м/с. 14. Среднеквадратичная скорость молекул кислорода (молярная масса 1) 267 м/с 2) 320 м/с; 3) 483 м/с. 15. Среднеквадратичная скорость молекул кислорода (молярная масса 1) 644 м/с 2) 776 м/с; 3) 915 м/с. 16. Средняя скорость молекул водорода при температуре 23 0С равна 1) 1,21 км/с 2) 1,782 км/с; 3) 2,156 км/с. 17. Средняя скорость молекул водорода при температуре 500 0С равна 1) 2,86 км/с 2) 3,07 км/с; 3) 5,72 км/с. 18. При какой температуре среднеквадратичная скорость молекул водорода равна 500 м/с 1) 80 К 2) 140 К 3) 210 К. 19. Чему равна среднеквадратичная скорость молекул водорода при температуре 100 К? 1) 513 м/с 2) 883 м/с; 3) 1116 м/с. 20. Между величинами средней скорости 1);
Распределение Больцмана (не везде знание формулы)
1. Распределение Больцмана – это распределение частиц по 1) потенциальной энергии; 2) высоте; 3) оба утверждения верны. 2. Распределение Больцмана справедливо
1) для молекул идеального газа; 2) для микроскопических частиц в поле тяжести; 3) оба утверждения верны. 3. Распределение Больцмана – это распределение частиц по 1) потенциальной энергии; 2) кинетической энергии; 3) энергии хаотического движения. 4. Распределение Больцмана имеет вид 1) 5. Распределение Больцмана имеет вид 1) 6. Барометрическая формула имеет вид 1) 7. Барометрическая формула имеет вид 1) 8. Барометрическая формула имеет вид 1) 9. Барометрическая формула получена с учётом 1) роста температуры с высотой; 2) падения температуры с высотой; 3) независимости температуры от высоты. 10. Давление газа с высотой 1) уменьшается линейно; 2) уменьшается обратно пропорционально высоте; 3) уменьшается экспоненциально. 11. Давление газа с высотой 1) уменьшается гиперболически; 2) уменьшается обратно пропорционально высоте; 3) уменьшается экспоненциально. 12. На каком графике правильно нарисованы зависимости P (h)для двух различных температур?
13. Давление газа с высотой h уменьшается, как показано на рисунке
14. График функции распределения Больцмана показан на рисунке
15. На какой высоте концентрация молекул водорода при температуре 1) 11 км; 2) 89 км; 3) 206 км. 16. Во сколько раз уменьшится концентрация молекул кислорода при подъёме на высоту 5 км? Справка: молярная масса кислорода 1) в 1,55 раз; 2) в 1,62 раза; 3) в 1,88 раз. 17. На какой высоте давление воздуха уменьшится в 2.7 раза (молярная масса воздуха
1) 5,5 км 2) 7,9 км; 3) 8,7 км. 18. На какой высоте давление воздуха уменьшится в 2 раза (молярная масса воздуха 1) 4 км 2) 5 км; 3) 6 км. 19. Распределение Больцмана для кислорода (m1) и водорода (m2) правильно показано на рисунке
20. С увеличением высоты, давление кислорода падает 1) быстрее, чем давление водорода; 2) медленнее, чем давление водорода; 3) так же, как и давление водорода.
Длина свободного пробега
1. Эффективный диаметр молекул – это 1) расстояние, пройденное молекулой между двумя столкновениями; 2) расстояние, на которое сближаются центры молекул при столкновении; 3) кубический корень из объёма, приходящегося на одну молекулу газа в сосуде. 2. Длина свободного пробега молекулы – это 1) среднее расстояние между молекулами; 2) среднее расстояние, которое проходит молекула между двумя столкновениями; 3) среднее расстояние взаимодействия молекул. 3. Длина свободного пробега зависит от давления согласно рисунку
4. Длина свободного пробега молекулы зависит от давления как показано на рисунке
5. При данной температуре длина свободного пробега молекул 1) пропорциональна давлению; 2) обратно пропорциональна давлению; 3) обратно пропорциональна корню из давления. 6. При данной температуре длина свободного пробега молекул 1) пропорциональна концентрации молекул; 2) обратно пропорциональна концентрации молекул; 3) обратно пропорциональна корню из концентрации молекул. 9. Термодинамика. Определения. 1-е начало. Простые вопросы. 1. Количество теплоты – это 1) средняя кинетическая энергия молекул; 2) мера превращения энергии хаотического или направленного движения в энергию хаотического движения; 3) мера внутренней энергии тела. 2. Внутренняя энергия – это 1) средняя кинетическая энергия теплового движения молекул; 2) тепловая энергия, получаемая системой при теплопередаче; 3) сумма кинетической и потенциальной энергии всех молекул системы. 3. Работа в термодинамике – это 1) мера превращения энергии хаотического или направленного движения в энергию хаотического движения; 2) мера превращения энергии хаотического или направленного движения в энергию направленного движения; 3) мера изменения внутренней энергии тела. 4. Число степеней свободы молекулы равно 1) числу независимых координат, полностью описывающих положение молекулы; 2) числу атомов в молекуле, умноженному на 3; 3) числу координатных осей, которые можно провести через каждые два атома в молекуле. 5. На каждую степень свободы молекулы приходится энергия 1) 6. Внутренняя энергия идеального газа определяется по формуле 1) 7. Элементарная работа, совершаемая газом, определяется по формуле 1) 8. Работа, совершаемая газом, определяется по формуле 1) 9. Изменение внутренней энергии 1) зависит от вида процесса, совершаемого газом; 2) не зависит от вида процесса, совершаемого газом; 3) зависит от изменения объёма газа. 10. Определение внутренней энергии как суммы кинетических энергий всех молекул справедливо для 1) идеального газа; 2) всех газов; 3) всех тел. 11. Работа, совершаемая газом 1) зависит от вида процесса, совершаемого газом; 2) не зависит от вида процесса, совершаемого газом; 3) равна 12. Внутренняя энергия идеального газа зависит от температуры согласно графику
13. Первое начало термодинамики можно записать так 1) 14. Первое начало термодинамики можно сформулировать так 1) работа, совершенная системой равна сумме количества теплоты, переданного системе и изменения внутренней энергии системы; 2) количество теплоты, переданное системе, идёт на повышение её внутренней энергии и совершение над системой работы;
3) количество теплоты, переданное системе, идёт на совершение системой работы и изменение её внутренней энергии. 15. Работа при изобарном процессе (площадь под кривой) правильно изображена на графике
16. Для изотермического процесса первое начало термодинамики выглядит так 1) 17. Для изотермического процесса справедливо 1) 18. Для изохорного процесса первое начало термодинамики выглядит так 1) 19. Для изохорного процесса справедливо 1) 20. Работа при изобарном процессе равна 1) 21. Для изохорного процесса 1) работа, совершенная системой всегда больше изменения внутренней энергии; 2) работа, совершенная системой всегда меньше изменения внутренней энергии; 3) работа, совершенная системой всегда равна изменению внутренней энергии. 22. Для изохорного процесса 1) количество теплоты, переданное системе, всегда больше изменения внутренней энергии системы; 2) количество теплоты, переданное системе, всегда меньше изменения внутренней энергии системы; 3) количество теплоты, переданное системе, всегда равно изменению внутренней энергии системы. 23. Для изотермического процесса 1) количество теплоты, переданное системе, всегда больше работы, совершенной системой; 2) количество теплоты, переданное системе, всегда меньше работы, совершенной системой; 3) количество теплоты, переданное системе, всегда равно работе, совершенной системой.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 236; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.173.112 (0.057 с.) |
 ;
; ;
; .
. ;
;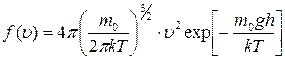 ;
;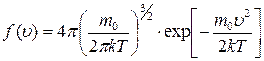 ;
;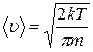 ; 2)
; 2)  ; 3)
; 3)  .
. ; 2)
; 2)  ; 3)
; 3)  .
.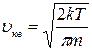 ; 2)
; 2)  ; 3)
; 3)  .
. ; 2)
; 2) 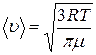 ; 3)
; 3)  .
. ; 2)
; 2)  ; 3)
; 3)  .
. ; 2)
; 2) 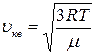 ; 3)
; 3)  .
.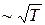 ; 2)
; 2)  ; 3)
; 3)  .
.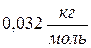 ) при температуре 23 0С равна
) при температуре 23 0С равна , среднеквадратичной скорости
, среднеквадратичной скорости  и наиболее вероятной скорости
и наиболее вероятной скорости  справедливо соотношение
справедливо соотношение 2);
2); 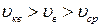 3)
3) 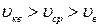 .
. ; 2)
; 2)  ; 3)
; 3) 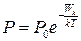 .
. ; 3)
; 3)  .
. ; 2)
; 2) 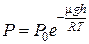 ; 3)
; 3)  .
. ; 2)
; 2) 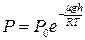 ; 3)обе формулы верны.
; 3)обе формулы верны. .
.

 уменьшится в 2 раза? Справка: молярная масса водорода
уменьшится в 2 раза? Справка: молярная масса водорода  , универсальная газовая постоянная
, универсальная газовая постоянная  .
. , температура
, температура  , температура
, температура 



 ; 2)
; 2)  ; 3)
; 3)  .
. ; 2)
; 2)  ; 3)
; 3)  .
. ; 2)
; 2)  ; 3)
; 3)  .
. ; 2)
; 2)  ; 3)
; 3) 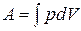 .
. .
.
 ; 2)
; 2)  ; 3)
; 3)  .
.
 ; 2)
; 2)  ; 3)
; 3)  .
. ; 2)
; 2)  ; 3)
; 3)  .
. ; 3)
; 3)  .
. ; 2)
; 2)  ; 3)
; 3)  .
.


