
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Инициирование, рост и обрыв цепи в катионной полимеризации
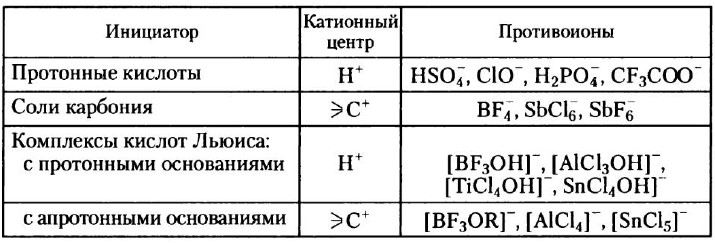
Инициатор катионной полимеризации является источником положительно заряженных частиц, возникающих либо самопроизвольно, либо в результате реакции с мономером или специально вводимым соединением. Обычно инициаторами служат вещества кислотного характера: протонные и апротонные кислоты, комплексы кислот Льюиса с соединениями – донорами электронов, соли карбония типа Ph3C+ · SbCl6 Кислоты Льюиса – AlCl3, BF3, SnCl4, ZnCl2, TiCl4 и др. – используют для низкотемпературной катионной полимеризации алкенов, приводящей к образованию высокомолекулярных полимеров. Указанные кислоты обычно применяют в комбинации с протонодонорными или другими добавками. Таблица 1. Некоторые катионные инициаторы полимеризации алкенов
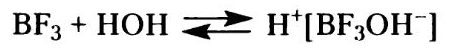
Протонные кислоты для инициирования катионной полимеризации используют только в том случае, если образуемый ими анион не отличается сильной нуклеофильностью; в противном случае он образует с протонированным мономером ковалентную связь: Из-за высокой нуклефоильности галогенов галогенводородные кислоты не применяют в качестве инициаторов катионной полимеризации. Для полимеризации некоторых мономеров (например, высших ненасыщенных углеводородов, кумарона, индена) используют фосфорную, серную и хлорную кислоты, хотя при этом и получают, как правило олигомеры. Так, изобутилен не чувствителен к сухому BF3, но мгновенно полимеризуется при добавлении следовых количеств воды; активатор (вода) реагирует с инициатором с образованием комплекса, который протонирует мономер и формирует инициирующие дальнейший рост цепи катионные частицы:
На стадии инициирования протон присоединяется к молекуле мономера и образуется ионная пара
Эта ионная пара затем реагирует со следующей молекулой мономера:
Таким образом, на конце растущей цепи всегда находится карбкатион с противоанионом. Благодаря поляризации молекулы мономера обеспечивается регулярное присоединение звеньев по типу «голова к хвосту», так как другой тип присоединения здесь просто невозможен. Поэтому цепь полимера имеет химически регулярную структуру. Невысокая диэлектрическая проницаемость среды (хлорированные углеводороды) способствует сохранению ионной пары в процессе роста цепи.
В общем случае, процесс инициирования катионной полимеризации в присутствии кислот Льюиса и активирующих добавок можно представить схемами: Что касается таких активаторов, как алкилгалогениды, например в системе: то образование инициирующих катионных частиц здесь возможно только с участием мономера: Принципиально возможен катализ только одной кислотой Льюиса, если она способна к образованию ионной пары:
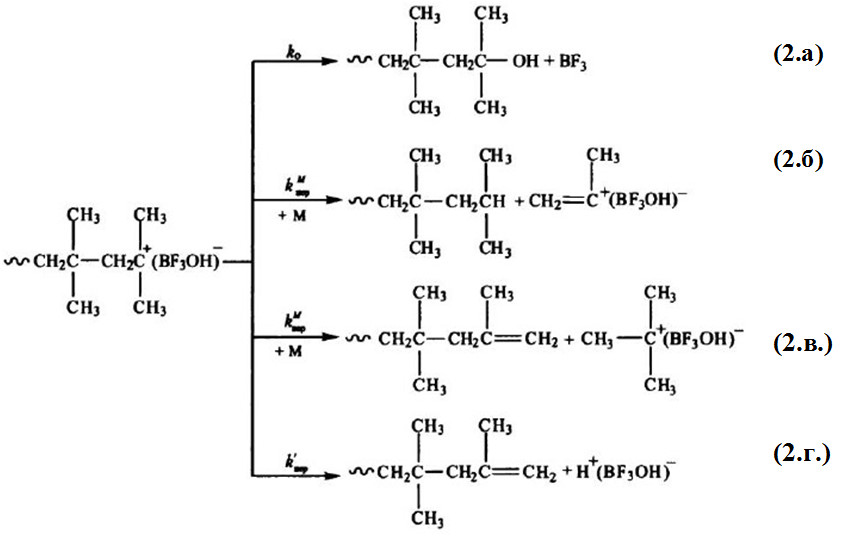
Кроме указанных выше в качестве инициаторов катионной полимеризации, возможно использование I2, Сu2+, а также излучений с высокой энергией. Каталитическое действие йода основано на следующих превращениях: Таким образом, НI выполняет функцию активатора по отношению к I2. Ион Сu2+ инициирует полимеризацию либо путем окисления π-связи (переход электрона от мономера к Сu2+), либо присоединением по π-связи. Для солей карбония возможен механизм инициирования, состоящий в переносе электрона от мономера на катион, с образованием свободного радикала и катион-радикала мономера: Образующиеся по этой схеме свободные радикалы отличаются высокой стабильностью и как инициирующие агенты приниматься во внимание не должны. Обрыв цепи в катионной полимеризации имеет гораздо большее значение, чем в анионном процессе. При анионной полимеризации возможно создание условий для безобрывного роста цепей и длительное сохранение постоянной концентрации «живых» макромолекул; это позволяет многократно «оживлять» процесс введением дополнительных количеств мономера и наращивать тем самым длину цепей. В катионной полимеризации продолжительность жизни активных центров, как правило, невелика. В случае катионной полимеризации, например, стирола и изопрена, это является основной причиной образования продуктов со степенью полимеризации не выше 50. Общим свойством активных центров типа –МnM+ является тенденция к стабилизации путем отщепления протона, захвата какого-либо аниона или изомеризации в более устойчивое состояние. Поэтому возможность образования высокомолекулярного полимера при катионном инициировании определяется соотношением процессов роста и стабилизации активных центров. Рассмотрим схемы реакций обрыва и передачи цепи в катионной полимеризации:
Так, при полимеризации изобутилена в присутствии Н+[BF3OH]- указанные реакции обрыва и передачи цепи (кроме (1.б)) протекают следующим образом:
Реакции (2.б) и (2.в) кинетически неразличимы, но первая приводит к образованию насыщенного концевого фрагмента цепи, а вторая – ненасыщенного, также как и реакция (2.г). Отмеченные три реакции схожи тем, что в результате их протекания кинетическая цепь не обрывается, а каждая частица комплекса «инициатор – активатор» («инициатор – мономер – активатор») способна начать рост новой цепи. Примером образования ковалентной связи при взаимодействии с противоионом (реакция (1.б)) является обрыв цепи при полимеризации стирола трифторуксусной кислотой: Реакция передачи цепи на мономер не влияет на скорость полимеризации, но способствует регулированию длины полимерной макромолекулы, т.е. получению полимера с узким молекулярно-массовым распределением. Кроме передачи цепи на мономер возможны и реакции передачи на растворитель, примеси или специально вводимые вещества: Передатчиками ХА могут быть вода, спирты, кислоты, ангидриды, простые и сложные эфиры, амины и другие соединения. Многие из передатчиков цепи (вода, спирты) часто используют в качестве активаторов, поэтому применение их в количествах, превышающих эквивалентное количество по отношению к инициатору, может привести к возрастанию доли процессов передачи цепи и к понижению молекулярной массы. Скорости отдельных стадий можно записать в виде:
Образование иона карбония Ионизационный потенциал (энергия ионизации) I определяют как энергию, необходимую для удаления электрона из молекулы или атома в газовой фазе:
Потенциалы ионизации алкильных радикалов приведены в таблице 2. Таблица 2. Ионизационные потенциалы алкильных радикалов
Сравнение ионизации метильного и этильного радикалов показано на рис. 2.
Рисунок 2. Сравнение потенциалов ионизации для метильного и этильного радикалов. Энергия стабилизации иона карбония ΔС+ и радикала ΔС. Стабилизация карбониевого иона метильной группой составляет 147 кДж/моль (35 ккал/моль), в то время, как стабилизация радикала метильной группой составляет 33,6 кДж/моль (8 ккал/моль). Сродство к протону Важно оценить основность различных олефинов в смысле сродства к протону и иону карбония в соответствии с уравнениями:
Сродство олефинов к протону определяется следующими четырьмя стадиями:
Здесь i – сродство протона к электрону – определяется как величина, обратная потенциалу ионизации атома водорода; β – энергия раскрытия двойной связи; D – энергия связи С – Н; I – потенциал ионизации радикала, образующегося при присоединении атома водорода к олефину. Для любого несимметричного олефина сродство к протону будет зависеть от того, к какому атому углерода он присоединяется. Данные для этилена, пропилена и изобутилена приведены в таблице 3. Таблица 3. Сродство протона и атома (ккал/моль) к олефинам
Сродство к иону карбония (С1 и С2 соответственно, как и Р1 и Р2) изменяется также как и сродство к протону Р1 (и соответственно С1) и значительно возрастает от этилена к изобутилену. Этим объясняется то обстоятельство, что реакционноспособность возрастает от этилена, который не активен к катионным катализаторам, к изобутилену, который обладает высокой активностью. Как видно из таблицы 3. уменьшение потенциала ионизации радикала вызывает увеличение сродства к протону.
На рис 3. показано, что потенциалы ионизации радикала и мономера связаны линейной зависимостью.
2.2.4. Изменение свободной энергии при образовании иона карбония Стабильность иона должна быть связана с изменением свободной энергии при его образовании. Таблица 4. Энтальпии ионизации в газовой фазе R – Br → R+ + Br – (энергии гетеролитической диссоциации связей)
Однако, для образования карбониевых ионов из алкилгалогенидов в газовой фазе известны только значения энтальпии, которая определяется по данным измерения электронного удара и, следовательно, является производной энергии гетеролитической диссоциации. Поскольку соответствующие изменения энтропии невелики, в принципе возможно оценить изменение свободной энергии через изменение энтальпии (таблица 4.) Энергию, необходимую для диссоциации алкилгалогенида RX на ионы R+ и X-, можно представить как сумму изменения энергии в трех гипотетических стадиях:
Величина ΔН1 представляет собой энергию гомолитической диссоциации связи; ΔН2-ионизационный потенциал алкильного радикала; ΔН3-сродство к электрону атома Х (не зависящее от природы алкила). Ионизационные потенциалы алкильных радикалов и ΔН при образовании карбониевых ионов алкилгалогенидов даны в таблице 4. Эти данные относятся к полностью разделенным ионам в газовой фазе. Как видно из таблицы 4, энергия диссоциации алкильных соединений и ионизационные потенциалы неожиданно зависят от природы R. Образование газообразных карбониевых ионов путем гетеролиза нейтральных молекул требует больших затрат энергии и поэтому редко наблюдается экспериментально. Органические реакции, включающие образование иона карбония в растворе, гораздо более распространены. Энергия сольватации Реакции карбониевого иона в растворе обязательно включают сольватацию ионов. Взаимодействие с растворителем стабилизирует карбониевый ион и его противоион. Так как стабилизация, прежде всего, связана с присутствием электрических зарядов, то ионизированные формы будут лучше сольватироваться, чем неионизированные. Все растворители способствуют некоторой сольватации (по сравнению с газовой фазой).
Схема ионизации органической молекулы RX в газовой фазе и в растворе представлена на рис 4., на котором
Вполне очевидно, что ΔG0 – стандартное изменение свободной энергии образования ионов в растворе из газообразного алкилгалогенида – должно выражаться суммой ΔG0р + ΔG0г. Из рисунка 4. следует:
Свободную энергию сольватации иона обычно рассчитывают по эмпирическому уравнению, часто называемому уравнением Борна. Изменение свободной энергии при перемещении иона с радиусом r и зарядом e из газовой фазы в растворитель (D) равно:
Согласно уравнению (11), энергия сольватации иона будет больше в растворителях с высокой диэлектрической проницаемостью. Важное значение имеет также специфическая сольватация и поляризуемость. По-видимому, ионы маленького радиуса должны лучше сольватироваться, и это действительно справедливо для неорганических катионов. Отсюда следует, что наиболее сильное взаимодействие между ионом и растворителем будет иметь место при малом радиусе иона и большом значении диэлектрической проницаемости среды.
|
||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 1531; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.32.230 (0.029 с.) |
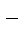 , соли оксония вида Et3O+· SbCl6
, соли оксония вида Et3O+· SbCl6 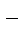

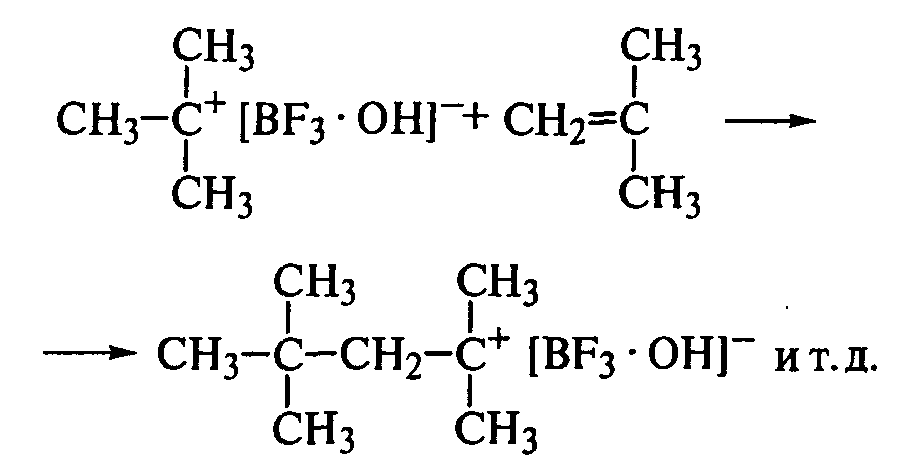
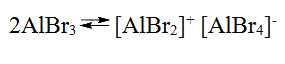

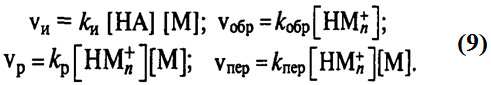










 - переходное состояние ионизации R+ и X- - разделенные ионы.
- переходное состояние ионизации R+ и X- - разделенные ионы.





