Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Любая АО описывается набором 3-х квантовых чисел. ⇐ ПредыдущаяСтр 2 из 2
Электрон в атоме имеет собственный вращательный момент механического движения, который также квантуется. В зависимости от знака вращения соответствующее квантовое число (ms) – спиновое - имеет два значения +1/2 и -1/2. Следовательно, электрон в атоме описывается набором 4-х квантовых чисел, три из которых относятся к атомной орбитали, которую он занимает и собственное спиновое квантовое число. Принципы заселения ЭПУ электронами. 1. Принцип минимума энергии. Наибольшая устойчивость электронной системы атома соответствует минимуму полной энергии для незаселенных состояний. 2. Принцип Паули. В атоме не может быть 2-х электронов с одинаковым набором всех четырех квантовых чисел. Другими словами, на АО максимально может разместиться не более 2-х электронов с противоположным значением спиновых чисел. 3. Правило Гунда. При заселении ЭПУ суммарное спиновое число для электронов должно быть максимально положительным.
Существует два основных вида составления электронных состояний нейтральных атомов или простых ионов. Электронная формула (электронная конфигурация). Для нейтрального атома число электронов равно заряду ядра этого атома. Эти электроны, в соответствии с принципами заселения, размещаются на вакантных ЭПУ и записываются слева направо в порядке увеличения энергии ЭПУ. Так, для атома кремния порядковый номер 14. Тогда электронная формула нейтрального атома будет иметь вид: Si 1s22s22p63s23p2. Часто используется сокращенная запись, в которой невалентные электроны обозначаются через устойчивую конфигурацию предшествующего благородного газа. Для кремния это неон. В таком случае можно записать: Si [Ne] 3s23p2. Второй формой записи электронных состояний является энергетическая диаграмма, которая отражает различие в энергии энергетических подуровней и степень их заполнения электронами. Е 3p 3s
2s 2p 1s
Электронные конфигурации простых катионов и анионов получаются путем удаления или добавления определенного числа электронов на валентные АО. Так, для хлора электронная формула нейтрального атома1s22s22p63s23p5. Для аниона Cl- добавляется один электрон 1s22s22p63s23p6. Для степени окисления хлора +5 необходимо удалить 5 электронов с р -подуровня: 1s22s22p63s23p0. При составлении электронных формул d-элементов нужно учитывать тот факт, что при наличии хотя бы одного электрона на (n-1)d -ЭПУ, энергия этого подуровня становится меньше, чем энергия ns валентного подуровня. Соответственно, при образовании катионов первыми будут «уходить» электроны именно с ns -подуровня. Так, сокращенная электронная формула нейтрального атома титана: Ti[Ar]3d24s2, для Ti (+2) формула иона будет следующей: [Ar]3d24s0.
Для некоторых элементов оказывается энергетически выгодным переход электронов с ns ЭПУ на (n-1)d энергетический подуровень. В частности, такая ситуация реализуется для атомов хрома, молибдена, меди, серебра и т.д. Например, хром имеет следующую конфигурацию валентных ЭПУ: [Ar]3d54s1. Изоэлектронные состояния реализуются для близко расположенных атомов в Периодической таблице в различных степенях окисления, при которых в них содержится равное число электронов. Так, атом водорода в степени окисления (-1) имеет электронную формулу 1s2. Такую же конфигурацию будут иметь и атом гелия, и катионы лития(+1), бериллия(+2), бора (+3). Геометрические и энергетические характеристики атомов. При движении по периоду слева направо возрастает как заряд ядра атомов, так и суммарный заряд электронов. Следовательно, сила притяжения между ядром и электронами, в соответствии с законом Кулона, возрастает, тогда валентные ЭПУ будут «сжиматься» и размеры атомов будут уменьшаться. В таком случае затраты энергии для отрыва валентных электронов будут увеличиваться. В настоящее время используется понятие – энергия ионизации (Ei) - энергия, затрачиваемая для образования 1 моль однозарядных катионов из нейтральных атомов и измеряемая в кДж/моль. Энергия ионизации всегда затрачивается, т.е. является эндотермическим процессом. Естественно, обе этих величины будут увеличиваться по периоду, хотя и не вполне монотонно. С этих же позиций кажется вполне очевидным, что при движении сверху вниз по группе размеры атомов увеличиваются, а энергия ионизации уменьшается. С другой стороны, атомы некоторых элементов могут принимать электроны с образованием анионов. Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону Еe (в кДж/моль). Этот эффект может быть как эндотермическим, так и экзотермическим.
Для неизолированных атомов используется эмпирическая величина электроотрицательность ЭО,которая характеризует способность атома данного элемента оттягивать на себя электронную плотность по сравнению с атомами других элементов в соединении. Вообще говоря, она является математической функцией от полусуммы энергий ионизации и сродства к электрону. Определяется как мера способности атома смещать к себе электронную плотность от других атомов, выраженная в условных единицах. Чаще всего используется относительная шкала, предложенная Л.Полингом. Минимальные значения (0,7-0,8) соответствуют щелочным металлам, максимальные – активным неметаллам (у фтора 4,1 у кислорода 3,5). Cлева направо по периоду значения относительная электроотрицательностьувеличиваются, а сверху вниз по группе уменьшаются.
УПРАЖНЕНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
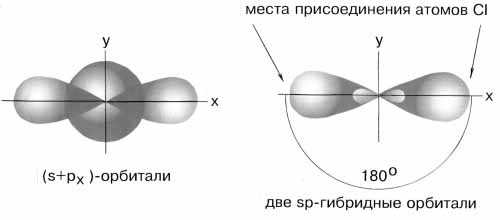
1. Напишите электронные формулы для атомов натрия, алюминия, кремния, фосфора, серы и хлора. 2. Напишите электронные формулы для атомов хрома, железа, меди, цинка. 3. Напишите электронные формулы для ионов K+, Al3+,S2-, Cl-, Cr3+,Fe2+. 4. Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода? 5. На каком основании Cr и S,C1 и Мп расположены в одной группе периодической системы Д.И.Менделеева? Почему их помещают в разных подгруппах? ХИМИЧЕСКАЯ СВЯЗЬ. Пример 1. Каким типом гибридизации АО бериллия описывается образование молекулы хлорида бериллия? Какова конфигурация этой молекулы? Решение: Возбужденный атом бериллия имеет конфигурацию 2s12p1. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. В молекуле BeCl2 должны быть неравноценные по прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны – это объясняет метод гибридизации. В данном случае имеет место sp- гибридизация При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о.
sp-гибридные орбитали Экспериментальные данные показывают, что все галогениды Be, а также Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую длину. Пример 2. Определите тип гибридизации орбиталей центрального атома в молекуле BF3. Какова конфигурация этой молекулы? Решение: Возбуждённый атом бора имеет конфигурацию 2s12p2. В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу.
sp2-гибридизация Пример 3. Каким типом гибридизации АО азота описывается образование молекулы аммиака? Решение:
В результате гибридизации 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о , соответствующие тетраэдру.
sp3- гибридизация в молекуле аммиака При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр. Пример 4. Объяснить с позиций метода МО возможность существования молекулярного иона Не2+ Решение: В молекулярном ионе Не2 + имеется три электрона.На связывающей орбитали размещены два электрона,а на разрыхляющей –один. Следовательно кратность связи равна 0, и он должен быть энергетически устойчивым. УПРАЖНЕНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Определите тип гибридизации орбиталей центрального атома в следующих молекулах и укажите геометрическую форму этих молекул: BeF2, H2O, SiCl4, NH3, CH4, BCl3 Полярны ли эти молекулы? 2.Определите тип гибридизации орбиталей центрального атома в следующих частицах и укажите геометрическую форму этих частиц: NH4+, BF4-, SiF62-, AlF63-, SO42-, PO43-. 3.Составьте энергетическую диаграмму МО для следующих частиц и определите порядок связи в них: H2,H2+,H2-,He2, HeH, He2+, Li2, Be2, N2, N2+, O2, O2-, O2+. 4. Пользуясь таблицей относительных электроотрицательностей, определите, какая из связей является наиболее полярной: Са-Н, I-C1.C-S. 5. В каком из приведенных соединений:LiF, BeF,BF,CF связь Э-F будет больше всего приближаться к ковалентной? 7. Как изменяется прочность связи в ряду: НF-НСl-НВг-Н1? 8. Сероводород при обычной температуре - газ, а вода- жидкость. Чем можно объяснить это различие в свойствах?
|
|||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 282; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.233.43 (0.012 с.) |