Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обеспечение диагностики нарушении гемостаза в
Общие подходы Исследование нарушений гемостаза проводится в несколько этапов. Перед проведением лабораторного исследования собирается анамнез. Во-первых, необходимо выяснить наличие клинических признаков геморрагического или тромботического заболевания у пациента. Во-вторых, требуется определить наличие таких признаков у членов семьи. Расспрос о семейных заболеваниях - очень важный этап, так как многие нарушения гемостаза наследуются. При сборе анамнеза необходимо обращать внимание на то, имеются ли признаки врожденного нарушения гемостаза или это приобретенное состояние. При наличии признаков приобретенного нарушения гемостаза необходимо учитывать сопутствующие заболевания и симптомы, а также применяемые пациентом медикаментозные препараты, которые могли повлиять на гемостаз. Однако данные анамнеза являются субъективной информацией и не всегда помогают в установке правильного диагноза. Клиническое обследование пациента выявляет ряд признаков нарушения гемостаза - петехии, синячки на коже, кровоизлияния в слизистые оболочки, признаки венозного застоя или артериальной недостаточности и др. Необходимость сбора анамнеза и осмотра перед началом лабораторного обследования важна еще и потому, что проведение всех возможных тестов оценки состояния системы гемостаза - чрезвычайно дорогостоящее занятие. Кроме того, в настоящее время нет лабораторных тестов, позволяющих досконально охарактеризовать все звенья системы гемостаза. Поэтому на предварительном этапе необходимо выбрать рациональную палитру тестов, наиболее соответствующую клинической картине нарушений у данного пациента. На следующем этапе рекомендуется провести некоторое количество скрининговых тестов, которые позволят определить направленность нарушения. И лишь на следующем этапе рационально выполнить соответствующие данным клинической картины и скрининговых тестов анализы, способные выявить конкретные нарушения гемостаза у пациента. Важно понимать, что применяемые тесты должны быть информативными, то есть обладать высокой чувствительностью по выявлению патологии и достаточной специфичностью. В любом случае лучше использовать несколько тестов, чем искать один даже самый специфичный тест, так как сама комбинация дает дополнительную и зачастую решающую информацию. Это объясняется тем, что практически все элементы системы гемостаза в той или иной степени связаны, изменение в одном элементе затрагивает и другие его звенья. Поэтому во всех случаях при назначении и проведении расширенной коагу-лограммы необходим тесный контакт с лечащим врачом и, может быть, совместное с ним назначение перечня дорогих и редких, но обоснованных исследований.
Так как лабораторное исследование гемостаза может быть достаточно дорогим, следует доказывать администрации, что лечение больных с тромбозами и патологическими кровотечениями значительно дороже, чем любые лабораторные исследования. А затраты на приобретение качественных реактивов и оборудования окупаются исключением повторных исследований и проведением адекватной, эффективной и контролируемой терапии. Помимо коагулологических тестов, при исследовании нарушений гемостаза большую помощь оказывают лабораторные тесты общего Обеспечение диагностики нарушений гемостаза в КДЛ назначения. Они могут указать на заболевания печени или почек, которые имеют значение для синтеза и катаболизма факторов гемостаза. Опухоль с метастазами способна стать причиной тромбоза. Лекарственные препараты могут вызывать кровотечения, а в некоторых случаях передозировка прямых и непрямых антикоагулянтов, наоборот, приводит к тромбофилии. Важную информацию о причинах развивающихся тромбозов и кровотечений могут дать такие лабораторные исследования, как общий анализ крови, определение гомоцистеина, витаминов, гормонов, наличие аутоантител. Для пациентов, леченных препаратами крови, необходимо проводить тесты на вирусоносительство. Преаналитический этап
Взятие крови Существенное значение имеет, на какой крови выполняется тот или иной тест: на цельной, стабилизированной капиллярной или на плазме венозной крови. Капиллярная кровь Капиллярная кровь как диагностический материал имеет ограниченное значение. Тем не менее у больных, принимающих непрямые антикоагулянты, использование капиллярной крови из пальца позволяет избежать повторного травмирования и тромбирования вен, затрат времени на центрифугирование крови и отделение плазмы. При этом использование капиллярной крови увеличивает вероятность преаналитической ошибки; становится сложнее стандартизовать исследование, требуются специальные реактивы и оборудование. Стоимость реактивов для исследования про-тромбинового времени в капиллярной крови выше, их стабильность ниже, чем обычного тром-бопластина, используемого для анализа плазмы венозной крови. Для избежания неверных результатов капиллярная кровь может использоваться только для некоторых специально адаптированных методов: подсчет тромбоцитов, определение времени кровотечения, определение протромбино-вого (ПВ) и активированного частичного тром-бопластинового времени (АЧТВ). Определение АЧТВ в капиллярной крови используется исключительно для мониторинга гепаринотерапии.
Определение ПВ в капиллярной крови используется в основном для контроля за приемом непрямых антикоагулянтов в амбулаторных и домашних условиях, а также для экспресс-диагностики у детей первых месяцев жизни. Фирма «Roche Diagnostics» выпускает комбинированный тромбопластиновый реагент «Hepato Quick», который специально предназначен для работы с капиллярной кровью. В состав реактива входят тромбопластин, фактор V и фибриноген, для определения используется 20 мкл цельной крови. Реактив прокалиброван. Для проведения работ по контролю качества используются специально подготовленные лиофилизированные плазмы. При использовании реактива предусмотрена возможность коррекции влияния гематокрита на результат теста. Все эти условия позволяют проводить контроль за антикоагулянтами непрямого действия по протромбиновому тесту, выполняемому на полученной из пальца капиллярной крови. Этот метод оценивает международное нормализованное отношение (MHO) в микрообъемах цельной или стабилизированной цитратом капиллярной крови. Существенным ограничением метода является то, что используемый в нем реагент сложен, дорог и малодоступен многим практическим лабораториям. Одновременно фирма «Roche» предлагает портативный прибор «CoaguCheck Plus» для определения ПВ и АЧТВ, в котором в качестве биологического материала используется капля капиллярной крови. Прибор может применяться в амбулаторных условиях или самостоятельно пациентами для контроля терапии непрямыми антикоагулянтами (рис. 65). Основные проблемы и рекомендации при работе с капиллярной кровью: • При прохождении крови через поврежденную • Немецкий стандарт DIN 58910-D: кровь, вы Обеспечение диагностики нарушений гемостаза в КДЛ
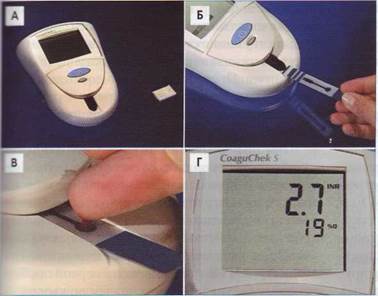
Рис. 65. Портативный прибор «CoaguCheck Plus» (фирма «Roche») для определения ПВ и АЧТВ: А - общий вид и картридж для программирования прибора, Б - тест-полоска вводится в прибор, В -капля капиллярной крови наносится непосредственно на тест-полоску, помещенную в прибор, Г - результат готов через несколько минут, причем данные по протромбиновому времени (ПВ) представляются сразу в единицах международного нормализованного отношения (MHO)
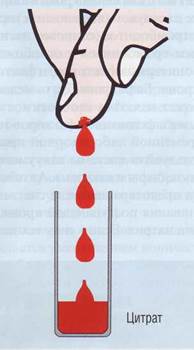
в стерильный капилляр и перенесена в нитратный буфер в течение 10 с. Чистое и сухое место кончика пальца или ушной мочки пунктируется стерильным скарификатором. Прокол должен быть достаточно глубоким, чтобы кровь текла самотеком. Не допускается давление или сжатие. Для исследования используются первые капли крови, берется 10-50 мкл в стерильный капилляр, который держится горизонтально, один конец касается места прокола. В капилляре кровь с цитратом не перемешивается, предварительный забор антикоагулянта только усложняет процедуру. Капиллярная кровь при взятии в пробирку с цитратом должна быть перемешана во время или сразу после взятия. Не допускается, чтобы кровь стекала на дно по стенке пробирки, она должна прямо скапывать в цитрат, перемешиваясь с ним (рис. 66). Венозная кровь До настоящего времени венозная кровь - основной источник материала для анализа состояния гемостаза. Взятие венозной крови - критическая процедура для тестов на коагулограмму. Взятие крови должно быть приурочено ко времени исследования, чтобы свести до минимума время хранения проб. В то же время, учитывая суточные биоритмы, рекомендуется брать кровь на исследование утром от 7 до 9 часов. Необязательно брать кровь строго натощак, можно рекомендовать пациенту легкий завтрак, но без жировой
Рис. 66. При взятии крови в антикоагулянт не допускается стекание крови по коже пальца, по стенке пробирки и любой другой поверхности, так как мгновенно происходит контактная активация процесса свертывания. Кровь самотеком из прокола должна попадать прямо в антикоагулянт, перемешиваясь с ним
Обеспечение диагностики нарушений гемостаза в КДЛ
пищи. Исследование рекомендуется проводить у пациентов, отдохнувших не менее 15 мин после незначительной физической нагрузки. Важным моментом является длительность наложения манжеты. Во время венопункции длительность венозного стаза рекомендуется не более 1 мин, а сила сжатия - ниже на 10 мм Hg диа-столического давления крови. Стаз крови при длительном наложении манжеты вызывает активацию фибринолиза, повышение концентрации факторов гемостаза из-за освобождения белков из сосудистой стенки (в том числе t-PA и vWF) и активацию тромбоцитов. Так, после 3 мин стаза крови происходит укорочение ПВ, АЧТВ и тром-бинового времени, примерно на 10% повышается количество антитромбина, фибриногена и других факторов свертывания, ф.VIII в отдельных случаях повышается более чем на 20%.
Кровь берут из локтевой вены утром натощак силиконированной иглой с широким просветом (внутренний диаметр 1,0 - 0,8 - 0,6 мм) без шприца (самотеком). Использование шприца нежелательно. Если кровь брать слишком быстро, то из-за турбулентного движения крови в шприце и смешивании ее с воздухом (вспенивание) происходит активация тромбоцитов (сопровождается изменением формы тромбоцитов и освобождением из них тромбоцитарных факторов) и факторов свертывания крови. Если кровь брать медленно, то в шприце может начаться необратимое свертывание, опять же с активацией факторов гемостаза. В современной лабораторной практике все чаще используются системы вакуумного забора крови (вакутейнеры и вакуэты). Активация гемостаза в них предотвращается за счет моментального смешивания поступающей крови с раствором цитрата натрия. Если в силу технических об- стоятельств забор крови проводится пластиковым (не стеклянным) шприцем, необходимо выполнять эту манипуляцию как можно аккуратнее, избегая вспенивания и резкого поступления крови в шприц. После этого кровь необходимо также аккуратно в минимальные сроки перенести в пластиковую или стеклянную силиконированную пробирку с раствором цитрата натрия. При прокалывании иглой сосуда тканевый тромбопластин попадает с током крови в пробирку, поэтому первые капли крови не годятся для проведения коагулологических тестов. Кровь на гемостаз желательно брать во вторую пробирку. Кровь из первой пробирки рекомендуется использовать для подсчета форменных элементов. Так, например, АЧТВ, определяемое в первой пробирке, может быть на 20% короче, чем во второй. Кровь рекомендуется брать: • «бабочкообразной» иглой в градуированную • в градуированный пластиковый шприц, со • в моноветт - коммерческая аспирационная • в вакутейнер - коммерческая система (про • в специальные пробирки для транспортиров
Рис. 67. Вакутейнер - система для взятия венозной крови, состоит из аспирационной иглы, переходника и пробирки с отрицательным давлением для набора крови, После введения иглы в вену пробирки могут меняться, при этом в каждую берется дозированная порция крови Рис. 68. Пробирка СТАД специально создана для транспортировки крови на исследование гемостаза, содержит цитрат натрия (0,105 М), теофиллин, аденозин и дипиридамол
Обеспечение диагностики нарушений гемостаза в КДЛ существуют и в виде вакутейнеров. Скринин-говые тесты и исследования отдельных факторов свертывания могут выполняться из СТАД так же, как из цитратной плазмы. В некоторых клинических ситуациях (например, при шоке) извлечение крови из локтевой вены затруднительно из-за низкого давления. Попытки набирать кровь с помощью шприца часто заканчиваются неудачей: кровь сворачивается. В неотложных ситуациях, когда невозможно взятие крови из периферической вены, можно использовать кровь, полученную из центрального (подключичного) катетера. При этом желательно удалить до 10 мл крови (использовать ее на проведение гематологических или биохимических исследований), а затем забрать кровь на коагулологические исследования. Такой способ взятия крови применим только в тех случаях, когда в катетер не вводился гепарин. Если же через этот катетер гепарин вводился, то удаляют до 20 мл крови, а затем берут кровь на исследование гемостаза. Тем не менее даже в этом случае приоритет должны получать гепарин-независимые тесты (ПВ, рептилаз-ное время, фибриноген, фибрин-мономеры, антитромбин), так как сохраняется высокая вероятность влияния следов гепарина на такие тесты, как АЧТВ, тромбиновое время. Положение тела Положение тела влияет на состав крови, число клеток, состав белков и белково-связываю-щих макромолекул, особенно выраженные изменения наблюдаются у пациентов с отеками. Уровень этих показателей всегда выше в положении стоя, так как при этом часть жидкости из сосудистого ложа переходит в окружающие ткани. При переходе из стоячего положения в сидячее, а особенно в положение лежа, жидкость быстро возвращается в сосуды («разведение крови»), этот эффект в большей степени выражен у пациентов с отеками. У здоровых людей через 8 ч лежания в постели концентрация фибриногена и активность антитромбина в крови примерно на 20% ниже, чем после 1 ч в положении стоя. У больных с отеками эта разница будет еще больше. Поэтому при мониторинге за состоянием пациента кровь всегда нужно брать из одного и того же положения пациента. Влияние физической нагрузки и эмоционального стресса Физическая нагрузка и эмоциональные переживания сопровождаются изменениями плазменного гемостаза, фибринолиза и функции тромбоцитов. После серии приседаний содержание в плазме фактора Виллебранда (vWF:Ag) увеличивается до 50%о, у спортсменов после бега на 10 км содержание ф.VIII повышается на 60%, vWF -примерно в 3 раза, что приводит к укорочению АЧТВ. Активация фибринолиза после физической нагрузки связана с повышением в плазме тканевого активатора плазминогена (t-PA). Аналогичные изменения наблюдаются у пациентов, перенесших эмоциональный стресс. Влияние факторов преаналитического этапа на показатели плазменного гемостаза представлено в табл. 10. Влияние пищи на показатели гемостаза Практика показывает, что исследование гемостаза необязательно проводить натощак. Легкий завтрак без жира даже показан перед взятием крови на исследование гемостаза. Характер пищи после длительного периода голодания оказывает влияние на показатели плазменного гемостаза и фибринолиза. Жирное мясо уменьшает фибринолитическую активность, в то же время бесхолестериновая диета способствует повышению фибринолитичес-кой активности крови. Фрукты и зеленые овощи в большом количестве способствуют активации фибринолиза в основном за счет уменьшения ингибитора активатора плазминогена (PAI-1). Рыбная диета в течение нескольких недель сопровождается уменьшением количества и агрегации тромбоцитов, а также снижением фибринолиза. Уменьшение агрегации тромбоцитов объясняется увеличением в их мембране полиненасыщенных жирных кислот, которыми богата рыба и морепродукты. Витамин С, витамин Е, лук и чеснок могут вызвать нарушения агрегации тромбоцитов. Витамин К в организме человека частично синтезируется микрофлорой кишечника, частично поступает с пищевыми продуктами. Несмотря на то что при применении per os антибиотиков
Обеспечение диагностики нарушений гемостаза в КДЛ Влияние различных факторов преаналитического этапа на результаты коагулологических исследований Таблица 10
широкого спектра могут возникнуть кровотечения из-за недостатка витамин-К-зависимых факторов, тем не менее для организма важен и пищевой витамин К. Витамин К в больших концентрациях содержится в овощах (шпинате, кабачках), злаках и печени. ПТ может стать патологически удлиненным, если полностью заменить в пище хлеб на помидоры, которые не содержат витамина К. У больных, принимающих непрямые антикоагулянты, исключительно овощная диета в больших количествах требует дополнительной корректировки антикоагулянтного потенциала крови по ПТ. Если такую коррекцию проводить, то овощная диета не будет доставлять особых проблем пациентам, принимающим непрямые антикоагулянты. Алкоголь влияет на показатели системы гемостаза в зависимости от дозы. После приема алкоголя наблюдается уменьшение антитромбина и фибриногена, повышение ингибитора активатора плазминогена и уменьшение времени кровотечения. Хронический алкоголизм сопровождается уменьшением количества тромбоцитов и нарушением их агрегации, которые однако достаточно быстро восстанавливаются после выхода из запоя. Кофе даже после 5 чашек не влияет на показатели свертывания крови. Большие дозы кофеина повышают количество t-PA и уменьшают активность PAI-1. Курение приводит к увеличению агрегации тромбоцитов и их адгезии, повышению β-тром-боглобулина, t-PA, активности PAI-1 и фибриногена, снижению ф.VII. Кокаин в большой дозе может вызвать настолько сильную активацию и агрегацию тромбоцитов, что это перерастает в тяжелую тромбо-цитопению и ДВС-синдром. Интерферирующие лекарственные препараты Оральные контрацептивы повышают активность большинства факторов плазменного гемостаза, увеличивают агрегацию тромбоцитов и снижают уровень протеина С и протеина S. Как правило, сами оральные контрацептивы не вызывают клинических проявлений патологии гемостаза, но они резко увеличивают вероятность тромбозов при наличии наследственных или приобретенных риск-факторов тромбофилий. Валъпроиковая кислота (используется в препаратах для лечения эпилепсии) может вызвать тромбоцитопению, уменьшение уровня фибриногена, состояние, имитирующее болезнь Виллеб-ранда II типа. Аспарагиназа (препарат для лечения лимфо-бластных лейкозов) может приводить к снижению фибриногена, уменьшению антитромбина, протеинов С и S, витамин-К-зависимых факторов, снижению плазминогена. Обеспечение диагностики нарушений гемостаза в КДЛ
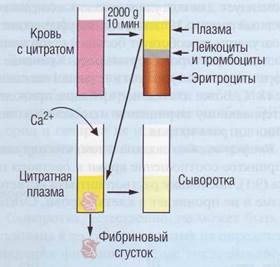
Антибиотики широкого спектра действия могут привести к различным отклонениям в показателях гемостаза. Принимаемые внутрь антибиотики вызывают дефицит витамина К в организме за счет подавления активности бактериальной микрофлоры. После назначения высокой дозы пенициллина наблюдалась тромбоцитопе-ния, нарушения функций тромбоцитов, удлинение тромбинового времени. Анальгетики (нестероидные противовоспалительные, антиревматоидные, жаропонижающие препараты), содержащие ацетилсалициловую кислоту, влияют на функцию тромбоцитов. Необратимое ингибирование циклооксигеназы вызывает подавление, вплоть до полного отсутствия, адгезии тромбоцитов. Другие анальгетики (индо-метацин, фенилбутазон, диклофенак) подавляют агрегацию тромбоцитов в меньшей степени, чем аспирин. Подбор антикоагулянтов Материалом для коагулологических исследований является плазма (рис. 69). Для получения плазмы или крови для лабораторных исследований используют противосвер-тывающие вещества (табл. 11). Согласно стандарту для производителей DIN ISO Standard 6710 коммерческие пробирки с антикоагулянтом метятся цветом крышки: пробирки с ЭДТА закрыты крышкой светло-лилового (лаванды) цвета, пробирки с гепарином - зеленой, пробирки с цитратом - синей крышкой. Трехзамещенный цитрат натрия обладает специфической способностью стабилизировать
Рис. 69. Получение фракций крови для проведения коагулологических исследований лабильные факторы свертывания (V и VIII). Цитратная плазма, обогащенная тромбоцитами, используется для изучения их агрегации. В связи с этим цитрат натрия является антикоагулянтом выбора для коагулологических исследований. В соответствии с рекомендацией ВОЗ концентрация цитрата должна быть 109 ммоль. Кровь смешивают с 3,8% раствором цитрата натрия в соотношении 9:1. На этом этапе могут быть допущены три ошибки. Первая ошибка - неточность приготовления раствора стабилизатора. Важно учесть, что трехзамещенный 5,5-водный цитрат натрия готовится в концентрации 3,8% (0,11 моль), а 2-водный - в концентрации 3,2%) (0,11 моль). Американский Комитет Стандартизации Клинических Лабораторий
Применение и механизм действия антикоагулянтов Таблица 11
Обеспечение диагностики нарушений гемостаза в КДЛ рекомендует для коагулологических исследовании буферный раствор 3,2% цитрата. Забуферивание антикоагулянта способствует большей стабилизации лабильных факторов свертывания. Хранение раствора цитрата допускается в течение 1 недели при +2...+8 °С. Более длительное хранение приводит к бактериальному загрязнению и снижению концентрации цитрата натрия. Вторая ошибка связана с тем, что нарушается принятое соотношение крови и раствора цитрата (9:1), поскольку раствор цитрата остается в плазме и не проникает в клетки крови. Считает- ся, что в пределах разведения крови цитратом 9:1 и 12:1 практически нет различий в результатах коагулологических тестов. Большее количество антикоагулянта по отношению к плазме может вызвать удлинение ПВ и АЧТВ (рис. 70). Такая ситуация может возникнуть, когда в приготовленную заранее пробирку с цитратом набрано слишком мало крови (рис. 71). Аналогичная ситуация возникает при разном гематокрите (рис. 72): гематокрит в пределах между 0,25-0,55 (25-55%) несущественно влияет на результаты, при гематокрите свыше 60%
Рис. 70. Влияние разведения крови антикоагулянтом на протромбиновый тест (ПТ) и активированное частичное тромбопластино-вое время (АЧТВ), Разведение крови антикоагулянтом сопровождается удлинением ПВ (снижение ПТ) и АЧТВ, при разведении меньшем, чем 8:1, это приводит к регистрации ложноположи-тельного результата
Рис. 71. Взято недостаточное количество крови в антикоагулянт - типичная преаналитическая ошибка. Большее количество антикоагулянта по отношению к плазме может вызвать значительное изменение показателей ко-агулограммы Рис. 72. Соотношение объема плазмы и раствора цитрата при разном гематокрите. При высоком гематокрите создаются условия избыточного количества антикоагулянта и слишком сильного разведения плазмы с получением результатов, соответствующих состоянию гипокоагуляции. Наоборот, при низком гематокрите есть высокая вероятность регистрации «ложной» гиперкоагуляции Обеспечение диагностики нарушений гемостаза в КДЛ создается избыточная концентрация цитрата в плазме, приводящая к «ложной» гипокоагуля-ции. Напротив, при снижении гематокрита (ниже 25%) обнаруживается «ложная» гиперкоагуляция, кровь при смешивании с цитратом в отношении 9:1 может свернуться в пробирке еще до исследования. Высокий гематокрит - физиологическая характеристика крови новорожденных, у взрослых высокий гематокрит возникает при полицитемиях (эритремиях), сердечной недостаточности. Перерасчет объема стабилизатора в соответствии с гематокритным показателем позволяет избежать этой ошибки (табл. 12). Если же у больного нет значительного сгущения крови или, наоборот, анемизации, приемлемо стандартное соотношение крови и цитрата (9:1). Таблица 12 Соотношение объема антикоагулянта и венозной крови для постановки коагулограммы
Третья ошибка. Наиболее частой погрешностью при взятии крови является плохое или недостаточное перемешивание ее со стабилизатором. Для предотвращения этого требуется немедленно после заполнения пробирки кровью до требуемого объема закрыть ее крышкой (не резиновой) или чистой полиэтиленовой пленкой и 2-3 раза медленно перевернуть (не встряхивая). Для рекальцификации к цитратной плазме добавляют определенное количество хлорида кальция. Причиной изменения времени свертывания может стать несоответствие добавляемого кальция содержанию цитрата: коагулологи-ческие исследования являются более чувствительными к избытку кальция в плазме (высокий гематокрит, слишком мало крови), чем к его недостатку (низкий гематокрит, слишком много крови). Для некоторых тестов рекомендуются специальные антикоагулянты. При исследовании функции тромбоцитов практически любой антикоагулянт может быть источником ошибок. ЭДТА, флуорид и гепарин не используются при проведении традиционных тестов коагулограммы. Сыворотка Сыворотка, естественно, не может быть использована в тестах, основанных на определении выпадения фибрина. Кроме того, сыворотка практически не содержит факторов II, V, VIII и XIII, которые удаляются со сгустком, в сыворотке частично сохраняются ф.VII, -IX, -X и -XII. Сыворотку можно использовать для исследования некоторых компонентов, на определение которых оказывают интерферирующий эффект компоненты плазмы, в частности, в сыворотке можно определять содержание продуктов деградации фибрина/фибриногена (ПДФ). Хранение и центрифугирование Кровь в пробирке необходимо тщательно перемешать, перевертывая пробирку, при этом не допускается образования пены. Нельзя трясти пробу, так как это может вызвать денатурацию белков и активацию тромбоцитов. Сразу же после взятия крови происходит изменение активности компонентов системы свертывания и фибринолиза. В пробе, не закрытой пробкой, возрастает рН из-за потери СО2. Следствием этого является увеличение времени свертывания. На стабильность рН пробы влияет буферная система эритроцитов, а также использование буферных растворов цитрата. В пробе крови, хранящейся при комнатной температуре и закрытой пробкой, не происходит заметных изменений в результатах ПВ и АЧТВ. Эффект физиологического забуферивания за счет эритроцитов исчезает в открытой пробирке при попадании в нее атмосферного воздуха. Согласно международным рекомендациям срок доставки проб в лабораторию (ARUP Laboratories, 2002) для исследования показате-
Обеспечение диагностики нарушений гемостаза в КДЛ лей гемостаза не должен превышать 45 минут после взятия крови у пациента. Стабилизированную кровь до центрифугирования (в том числе и в процессе транспортировки) хранят при комнатной температуре (+18... +25 °С). Транспортировка крови на большие расстояния и ее частое встряхивание искажают результаты исследования. Кровь нельзя хранить во льду (что делается в некоторых клиниках), так как это может привести к холодовой активации фактора XII (процесс запускается через контактную фазу и развивается достаточно часто) и вызвать значительные изменения функции тромбоцитов. Центрифугирование для получения плазмы должно проводиться при ускорении 1500-2000 g в течение 10 минут, при этом получается плазма, «бедная» тромбоцитами. Если пробы необходимо заморозить перед проведением теста, то после размораживания рекомендуется повторно от-центрифугировать пробу и работать с суперна-тантом. Это делается для удаления остатков разрушенных тромбоцитов, фосфолипидов и белков их мембран, которые могут влиять на некоторые коагуляционные тесты. Проверка исследуемых образцов перед выполнением тестов Проверка образцов крови или плазмы перед проведением коагуляционных тестов позволяет избежать многих ошибок, связанных с преанали-тическими погрешностями. Неправильное соотношение кровь/цитрат можно определить, если объем крови в пробирке меньше или больше, чем требуемый. При малом объеме крови будет зарегистрировано ложное удлинение коагуляционных тестов. Пробы с видимыми сгустками фибрина. В зависимости от степени свертывания коагуляционные тесты могут быть укорочены, нормальны или удлинены. Гемолиз может произойти при хранении не-отцентрифугированной крови или после центрифугирования. В таких тестах результаты варьируют в зависимости от степени гемолиза. Если гемолиз присущ in vivo, что подтверждается взятием нового образца, то тесты могут выполняться для оценки гемостатической ситуации. Если гемолиз произошел после взятия крови, то такие образцы следует отбросить, чтобы не получить ложных результатов. Тесты для оценки сосудистого и тромбоцитарного компонентов гемостаза
Традиционные тесты на исследование сосудистого и тромбоцитарного компонентов гемостаза, в том числе пробы на резистентность (ломкость) капилляров, пробы на длительность и величину капиллярного кровотечения, подсчет тромбоцитов в камере, изучение размеров тромбоцитов в мазке, визуальные методы на . спонтанную и индуцированную агриегацю, хорошо известны и представлены во многих пособиях. В настоящем изложении остановимся только на относительно новых методах, отработанных на новой лабораторной технике, поступающей в клинико-диагностические лаборатории. Время кровотечения Время кровотечения - это время от момента нанесения стандартной раны кожи до момента прекращения вытекания крови. Оно характеризует функциональную активность тромбоцитов и взаимодействие тромбоцитов с сосудистой стенкой. Время кровотечения не выявляет всех тром-боцитарных нарушений (такого метода вообще не существует), этот скрининговый тест позволяет заподозрить тромбоцитопатии различного ге- неза, болезнь Виллебранда и нарушения проаг-регантных свойств сосудистой стенки. После выявления патологии нет необходимости повторять это исследование, нужно использовать более чувствительные и специфичные методы. У этого метода есть серьезные недостатки: Метод плохо стандартизуется. Результаты теста позволяют лишь предположить наличие тех или иных нарушений. Обеспечение диагностики нарушений гемостаза в КДЛ Низкая чувствительность. Отсутствие удлинения времени кровотечения не всегда позволяет исключить нарушения тромбоцитарно-го или сосудистого звеньев гемостаза. Низкая специфичность не позволяет однозначно интерпретировать результаты метода. Однако это наиболее доступный метод для выявления нарушений взаимодействия тромбоцитов с сосудистой стенкой. Кроме того, это дешевый метод, позволяющий заподозрить нарушения соответствующего звена гемостаза и решить вопрос о необходимости дальнейших углубленных исследований.
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 295; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.171.20 (0.097 с.) |