
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Что такое идеальный газ. При каких условиях реальный газ близок к идеальному.
Ид.газ-газ молекулы которого рассматриваются как материальные точки взаимодействующие по законам соударения упругих шаров. Между частицами вещества действуют силы взаимного притяжения и отталкивания. В зависимости от интенсивности хаотического движения и сил взаимодействия между молекулами, которые зависят от внешних условий (температуры, давления), различают три агрегатных состояния вещества: твердое, жидкое, газообразное. С изменением внешних условий наблюдается переход вещества из одного состояния в другое – фазовый переход первого рода. В газообразном состоянии тепловое движение наиболее интенсивно, а силы взаимодействия малы. Пренебрегая взаимодействием молекул и размерами, получаем модель идеального газа как совокупности материальных точек, не взаимодействующих друг с другом и находящихся в непрерывном хаотическом движении. Ясно, что такая модель газа выбрана для простоты расчета. Реальный газ, конечно, не удовлетворяет таким представлениям, однако, если газ находится под небольшим давлением, то по своим свойствам он приближается к идеальному.. Несмотря на существенные упрощения, представления об идеальном газе позволяют находить зависимость макроскопических параметров состояния от микросвойств частиц. Запишите основное урав кин. теории газов, объясните его смысл. Следствием хаотичес. движения молекул является давление газа на стенки сосуда. имеем т.к. Средняя кинетическая энергия хаотического движения молекул идеального газа прямо пропорциональна его абсолютной температуре и является мерой интенсивности теплового движения молекул при заданной температуре. Формула выявляет молекулярно-кинетический смысл понятия температуры: температура тела есть количественная мера энергии теплового движения молекул, из которых состоит это тело. Подставляя, мы можем преобразовать основное уравнение кинетической теории газов к виду: p = n k T.
Каков физ смысл температуры? Каков физ смысл постоянной Больцмана? Температура - характеристика внутреннего состояния макроскопической системы – состояния теплового равновесия. Температура – термодинамический параметр, одинаковый во всех частях термодинамической системы, находящейся в тепловом равновесии. Температуры тел, находящихся в тепловом контакте, выравниваются. Физический смысл температуры. Опыт: давление газа зависит от температуры - Опыт показывает, что для любых веществ Абсолютная температура. Постоянная Больцмана - физическая постоянная (k), равная отношению универсальной газовой постоянной к постоянной Авогадро. Величины R, NA являются универсальными постоянными. Их отношение R= 8,31 Дж/(моль×К), NА = 6,02×1023 моль-1, то k = 1,38×10-23 Дж/К.
|
||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 1033; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.154.103 (0.006 с.) |

 , где р - давление газа на стенки сосуда, n - число молекул в единице объема, m0 - масса молекулы,
, где р - давление газа на стенки сосуда, n - число молекул в единице объема, m0 - масса молекулы,  - среднее значение квадрата скорости теплового движения молекул,
- среднее значение квадрата скорости теплового движения молекул,  - средняя кинетическая энергия поступательного движения молекулы. Число молекул в единице объема равно отношению полного числа молекул газа N, находящихся в сосуде, к его объему V:
- средняя кинетическая энергия поступательного движения молекулы. Число молекул в единице объема равно отношению полного числа молекул газа N, находящихся в сосуде, к его объему V:  , тогда
, тогда  Общее число молекул равно:
Общее число молекул равно:  ,где
,где  – число молей газа, NA - число Авогадро, тогда
– число молей газа, NA - число Авогадро, тогда  Сопоставим это уравнение с эмпирическим уравнением состояния Менделеева - Клапейрона
Сопоставим это уравнение с эмпирическим уравнением состояния Менделеева - Клапейрона 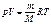
 .
.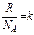 ,то
,то 
 и
и  . Из основного уравнения МКТ идеального газа:
. Из основного уравнения МКТ идеального газа:  . Следовательно
. Следовательно  .
. . Заменяя знак пропорциональности на знак равенства, получим:
. Заменяя знак пропорциональности на знак равенства, получим:  , где k – коэффициент пропорциональности, называемый постоянная Больцмана, а Т – абсолютная термодинамическая температура.
, где k – коэффициент пропорциональности, называемый постоянная Больцмана, а Т – абсолютная термодинамическая температура. - абсолютная температура неотрицательна! Т.к. объем газа равен нулю быть не может, то температура равна нулю, если давление равно нулю, а значит, равна нулю скорость поступательного теплового движения (сохраняются т.н. нулевые колебания). Единица температуры – Кельвин (К). Кельвин равен 1/273,16 части термодинамической температуры тройной точки воды. Шкала строится так, что
- абсолютная температура неотрицательна! Т.к. объем газа равен нулю быть не может, то температура равна нулю, если давление равно нулю, а значит, равна нулю скорость поступательного теплового движения (сохраняются т.н. нулевые колебания). Единица температуры – Кельвин (К). Кельвин равен 1/273,16 части термодинамической температуры тройной точки воды. Шкала строится так, что 
 также является универсальной постоянной и называется постоянной Больцмана. Если
также является универсальной постоянной и называется постоянной Больцмана. Если


