Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Limulusamebocytelysate(ЛАЛ)-тест
В настоящее время существует ряд иммунологических и биохимических методов, позволяющих определять содержание ЛПС в биологических жидкостях. Для определения содержания эндотоксина в лекарственных препаратах и изделиях медицинского назначения на протяжении более 30 лет успешно используется ЛАЛ-тест (LAL – Limulusamebocytelysate) в различных модификациях. Для сертификации фармацевтической и медицинской продукции на пирогенность ЛАЛ-тест включён в арсенал лабораторных методов многих стран. Этот тест основан на способности ЛПС вызывать коагуляцию белков, содержащихся в лизате амебоцитов мечехвоста. Реакция лизата амебоцитов с эндотоксином была открыта в США в 1964 г., где и был налажен выпуск первых коммерческих препаратов. Впервые этот тест был включён в Фармакопею США 20-го издания в 1980 г. и получил название «Определение бактериальных токсинов». ЛАЛ-тест обладает высокой чувствительностью: 1 пг/мл [8]. Некоторые компоненты анализируемой крови способны ингибировать или активировать реакцию ЛПС с лизатом амебоцита, а его молекулы связываются с различными компонентами крови, что оказывает влияние на результат теста. Молекулы ЛПС разных бактерий способны в разной степени активировать ЛАЛ-реакцию [19], поэтому активация иммунной системы различными видами ЛПС не всегда коррелирует с чувствительностью ЛАЛ-теста. Этот тест неспецифичен к виду ЛПС, поэтому не позволяет идентифицировать вид патогена для диагностики грамотрицательных инфекций в медицине[59,60]. В ходе изучения мечехвостов учеными Массачусетского университета, было обнаружено специфические свойства амебоцитов этих животных. Мечехвосты - это древнейшие морские животные. Современные мечехвосты мало отличаются от тех животных, чьи отпечатки обнаруживают в отложениях Юрского и Триасского периодов. Фактически без изменений эти животные существуют уже 350-400 млн. лет. Мало можно найти примеров такого долгожительства, точнее такого примера консервативной наследственности в современной фауне. Limuluspolyphemus это видовое название мечехвоста, кровь которого является сырьем для производства реактива. В книгах океанологии и зоологии беспозвоночных можно найти схожие описания этих уникальных животных: мечехвосты принадлежат к типу Членистоногие, который представлен огромным количеством видов, среди них наиболее крупные классы – Насекомые, Ракообразные и Паукообразные. Мечехвосты относятся к подтипу Хелицеровые. Хелицеры, давшие название подтипу, - это первая пара конечностей, служащих для схватывания добычи. К этому подтипу относятся еще и Паукообразные, а у насекомых и ракообразных гомологами хелицер являются верхние челюсти, или жвалы[15-17].
В результате реакции эндотоксина и лизата происходит помутнение прозрачной реакционной смеси или образование твердого геля, что и служит индикатором присутствия эндотоксина. Реакция проста, и для ее реализации не требуется много времени ответ может быть получен через 30 - 60 мин. Тест высокоспецифичен по отношению к эндотоксинам грамотрицательных бактерий. Чувствительность его во много раз превышает чувствительность фармакопейного теста на кроликах. По современным представлениям в лизате амебоцитов находятся, как минимум, три фермента и белок-субстрат. Ферменты находятся в форме предшественников, первый из них, Фактор С, способен специфически связываться с эндотоксинами. Он переходит в активную форму: активный Фактор С. Активный Фактор С переводит в активную форму следующий фермент: Фактор В. Последний в ряду ферментов, профермент, и его активная форма: свертывающий фермент. Свертывающий фермент перерабатывает субстрат: коагулоген. Молекула коагулогена разрезается на несколько полипептидных цепей, между которыми затем образуются связи, в результате чего получается пространственная структура геля. Ферменты, составляющие систему свертывания мечехвостов, являются сериновыми протеазами, очень похожими на факторы свертывания крови у млекопитающих. То же самое можно сказать и о субстрате, не случайно название коагулоген сходно с названием белка субстрата в системе коагуляции млекопитающих: фибриногеном. Для активации ферментной системы, точнее первого фермента в каскаде, Фактора С, нужны минимальные концентрации бактериальных эндотоксинов[13]. В основе всех методов оценки концентрации эндотоксинов лежит измерение степени активации ферментной системы, хотя способы измерения её активности могут быть различными. Концентрация эндотоксина может быть определена путем оценки количества переработанного субстрата (естественного или искусственного) за определенный промежуток времени: анализы по конечной точке. Она также может быть определена путем оценки времени, необходимого для переработки определенного количества субстрата (точнее по определению скорости этой переработки): кинетические анализы[14].
В естественной ситуации свертывающий фермент разрезает коагулоген на несколько фрагментов, которые затем полимеризуются (Рисунок 3). В результате реакции с прозрачной реакционной смесью происходят изменения, которые выражаются в помутнении содержимого, образовании вязких гелевых масс и, в конце концов, в образовании твердого геля. Гель, образующийся в результате реакции, удерживается в виде плотного опалесцентного сгустка на дне пробирки при ее переворачивании на 180°. Такой наиболее простой способ оценки активности ферментной системы называется гель-тромб тест. ЛАЛ-тест (LimulusAmebocyteLysate). Впервые ЛАЛ-тест был включен в Фармакопею США в 1980 г., а позже был признан в европейских странах. В Фармакопее США многие ФС регламентируют проведение испытаний препаратов с помощью ЛАЛ-теста. В некоторых случаях испытания на пирогенность рекомендуется проводить с использованием теста на кроликах[24]. Аналогичная реакция наблюдалась при внутрисосудистоминъецировании мечехвосту не живых бактерий, а только их эндотоксинов, которые содержатся в клеточной стенке граммотрицательных микроорганизмов. Это открытие вызвало особый интерес, т.к. эндотоксины - именно те вещества, которые в подавляющем большинстве случаев являются причиной пирогенности лекарственных препаратов. ЛАЛ-тест - фармакопейный метод контроля лекарственных средств. Открытие Ф.Б. Банга положило начало разработке метода количественного определения бактериальных эндотоксинов в самых различных средах.Наиболее важной и приоритетной областью применения этого метода стала фармацевтическая промышленность. Сам метод определения бактериальных эндотоксинов, получивший название – ЛАЛ-тест, в настоящее время является фармакопейным, и, за редким исключением, заменил альтернативный ему метод - определение пирогенов на кроликах путем регистрации повышения температуры в ответ на внутривенное введение испытуемых препаратов.
Рисунок 3. Система коагуляции мечехвоста. Внедрение ЛАЛ-теста позволило контролировать на пирогены препараты снотворного действия, анальгетики, вещества для наркоза, наркотические вещества, миорелаксанты, короткоживущие радиофармацевтические препараты, а также лекарственные вещества на различных стадиях технологического процесса. Замена теста на пирогены альтернативным ему – определением в препарате эндотоксинов – тем более оправдана, так как доказана более низкая чувствительность кроликов по сравнению с человеком к пирогенам [25]. Так, у человека повышение температуры тела наблюдается при внутривенном введении 4-8 ЭЕ/кг (ЭЕ - эндотоксиновые единицы), у кролика 10-15 ЭЕ/кг [26]. По наблюдениям за рубежом фармацевтическая промышленность широко использует ЛАЛ-тест не только для контроля готовой продукции, но также для контроля технологического процесса. ЛАЛ-тест - на сегодняшний день единственный способ максимально быстро провести постадийный контроль производства инъекционных препаратов. Наиболее рационально в этом случае проводить «ЛАЛ-контроль» таких этапов производства:
- контроль сырья; - контроль воды для инъекций; - проверка элементов фильтра на вымывание из них пирогенов; - контроль растворов перед стерилизующим фильтрованием; - контроль чистоты ампул и флаконов. ЛАЛ-тест может с успехом использоваться для определения оптимальных режимов мойки ампул и флаконов в моечных машинах, дает возможность проконтролировать и определить наилучший режим термической депирогенизации. Методики проведения ЛАЛ-теста, а также пределы содержания эндотоксинов в случае контроля технологического процесса не регламентируются Фармакопеями, а определяются самими заводами-производителями, поэтому внедрение ЛАЛ-методик на производстве не требует длительного времени и позволяет повысить качество лекарственных средств. Иные подходы к контролю с помощью ЛАЛ-теста готовых лекарственных средств. Введение ЛАЛ-теста позволило, во-первых, достаточно быстро (в течение 1.5 ч) получать результат испытания, во-вторых, в случае повышения «пирогенной загрязненности» препарата, иметь об этом информацию задолго до того, как препарат по этому показателю необходимо будет браковать, позволяет вовремя провести внутризаводские мероприятия, способствующие повышению качества продукции. Вопрос необходимости замены теста «Пирогенность» на ЛАЛ-тест, в первую очередь, касается парентеральных лекарственных средств, введение которых кролику невозможно или нецелесообразно: - инфузионные препараты, вводимые человеку в дозе более 700 мл/ч (Максимальный объем при внутривенном введении кролику – 10 мл, что не позволяет оценить реакцию человека на введение данного препарата в предписанном объеме.) Проведение теста на «пирогены» в этом случае не корректно. - препараты-антипиретики, обладающие гипотермическими свойствами и, в связи с этим, «маскирующие» действие пирогенов (например, галоперидол, диклофенак натрия). - препараты, фармакологические свойства которых делают невозможным их введение кролику в необходимом объеме: миорелаксанты, средства для наркоза (например, кетамин) и др. В США и других странах после включения раздела «Бактериальные эндотоксины» в национальные Фармакопеи разработка ЛАЛ теста для конкретных препаратов велась в одинаковой очередности: в первую очередь, для воды и радиофармацевтических препаратов, затем для препаратов, которые нельзя испытывать на кроликах (наркотики, миорелаксанты, седативные средства, средства, обладающие гипотермической активностью и др.) и т.д. Для фармацевтического предприятий экономически выгодно заменить также тест на кроликах определением бактериальных эндотоксинов для таких препаратов, введение которых кролику резко ограничивает возможность его дальнейшего использования (препараты антигенной природы, препараты крови). Например, причиной гибели кроликов при введении им большинства антибиотиков является действие большой дозы антибиотика на ферменты микрофлоры и, как следствие этого, дисбактериоз или, как при введении линкомицина гидрохлорида, кандидомикоз. Цель предварительных экспериментальных исследований – показать возможность применения ЛАЛ-теста для данного препарата. На фармацевтических предприятиях серийному контролю препарата на содержание бактериальных эндотоксинов должны предшествовать, говоря языком Европейской Фармакопеи – «preliminarytest» [26] - предварительные экспериментальные исследования, цель которых показать возможность применения ЛАЛ-теста для данного препарата. Когда мы пишем «для данного препарата», имеется виду не только состав препарата, но и конкретная технология его производства на конкретном предприятии. Компетентно выполненные предварительные экспериментальные исследования позволяют дать исчерпывающие ответы на целый ряд вопросов, которые обязательно возникнут у аналитика при проведении серийного контроля. Вот только некоторые из них (пути решения этих вопросов будут рассмотрены в следующих публикациях):
- каким из фармакопейных методов предпочтительнее определять эндотоксины в препарате; - обладает ли препарат свойством ингибировать или, наоборот, усиливать реакцию ЛАЛ-реактива с эндотоксинами; - как, если необходимо, устранить в препарате мешающие факторы, способные искажать реакцию между эндотоксинами и лизатом; - какой чувствительности ЛАЛ-реактив использовать при проведении теста; - какое «рабочее» разведение препарата выбрать; - какова предельная концентрация эндотоксинов (ПКЭ) для данного препарата. ПКЭ является величиной расчетной, и чтобы рассчитать величину ПКЭ для конкретного препарата, необходимо знать максимальную дозу эндотоксина, которую пациент может получить при введении препарата надлежащим путем без какого-либо неблагоприятного эффекта, и максимальную дозу этого препарата для человека в час [26-28]. Пределы содержания эндотоксинов для многих лекарственных средств (готовых лекарственных средств, субстанций) указаны в зарубежных Фармакопеях [26,27]. Однако простая задача – вычислить ПКЭ по формуле и уточнить полученную величину в различных Фармакопеях - простая только на первый взгляд. Специалисты по ЛАЛ-тесту за рубежом рекомендуют проверить также справочники и клинические публикации, уточнив, имеются ли режимы дозировок, превышающие максимальную дозу, указанную в инструкции на данный препарат. Если обнаружены различия как в дозировании препарата, так и в величине ПКЭ в различных Фармакопеях, по мнению зарубежных специалистов, следует утвердить самый минимальный предел содержания эндотоксинов для препарата как наиболее безопасный для человека[61-65].
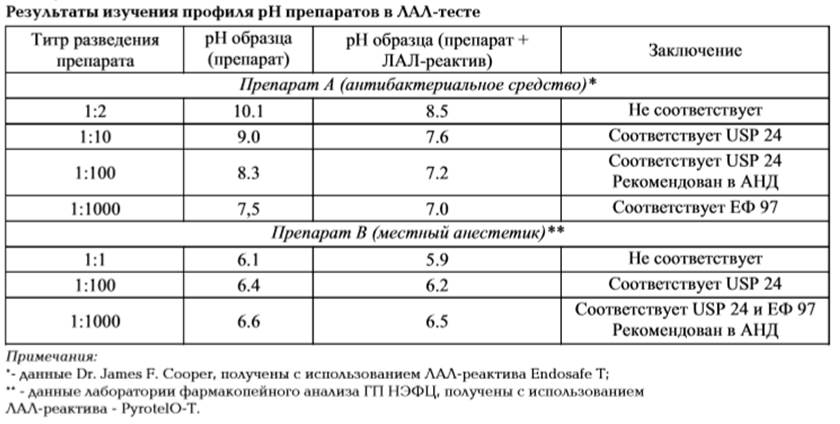
- следует ли перед тем, как испытывать препарат в ЛАЛ-тесте, проводить коррекцию его рН, и как это сделать; Изучение условий коррекции рН испытуемого образца – существенная часть процесса валидации ЛАЛ-методики для препаратов, содержащих буфер, или имеющих значения рН, отличные от нейтрального. В качестве примера посмотрим результаты изучения рН двух препаратов - антибактериального средства и средства для местной анестезии (Табл. 1). Как видно из данных, представленных в Табл. 1, разведение препаратов А и В позволило скорректировать рН исследуемых образцов, не используя буфер, щелочь или кислоту. Однако далеко не всегда разведение препарата позволяет решить проблему подготовки рабочего образца к методике-ЛАЛ. Например, для лекарственных средств, содержащих ЭДТА и цитрат, фирмы - поставщики ЛАЛ-реактива разработали специальный буфер. Многие препараты требуют не только наличия буфера, но и введение до нейтрализации специальных добавок [28,29]. Практика опытных ученых показывает, что при отсутствии таких исследований возможно получение ложноположительных и ложноотрицательных результатов. В случае контроля препарата ложноположительный результат подразумевает выбраковку препарата хорошего качества, ложноотрицательный – введение пациенту пирогенного препарата. Очень часто приходится сталкиваться с тем, что причина «ложных» результатов кроется в природе самого лекарственного средства. В препарате могут содержаться вещества, вызывающие, подобно эндотоксину, образование геля. К таким веществам, вызывающим неспецифическоегелирование, можно отнести некоторые противоопухолевые препараты - полисахариды (например, карбоксиметилированныйглюкан), полинуклеотиды (сополимер полирибоинозиновой кислоты с полирибоцитидиловой) и др. [62, 63]. Как правило, итогом длительной и методически сложной экспериментальной работы по валидацииЛАЛ-теста для конкретного препарата является методика, выполнение которой быстро и с приобретением аналитиком определенных навыков – несложно. Однако, изменение фирмы-производителя ЛАЛ-реактива, необходимого для проведения ЛАЛ-теста, повлечет за собой необходимость повторить исследования по валидации ЛАЛ-теста [27]. От рецептуры ЛАЛ-реактива и химического состава испытуемого препарата зависит, в каких условиях будет протекать реакция с пирогенами (эндотоксинами), и, следовательно, они определяют ход валидационных исследований. ЛАЛ-реактив, произведенный различными фирмами, отличается по составу (содержание катионов, белка, буфера, поверхносто-активных веществ) и методу обработки реактива на стадии производства [28]. В том случае, если испытуемый препарат представляет собой водный раствор с низкой концентрацией действующего вещества и нейтральным рН, как правило, он не оказывает существенного влияния на активность ЛАЛ-реактива и ведет себя сходно с ЛАЛ-реактивами различных поставщиков. Однако, если препарат является многокомпонентным, имеет сложный состав вспомогательных веществ, содержит буфер, хелаторы металлов, компоненты, способные агрегировать эндотоксины, то опыт показывает, что с ЛАЛ-реактивами различного производства такой препарат будет реагировать по-разному [28]. Таким образом, требование обязательной валидацииметодики-ЛАЛ для конкретного препарата при изменении фирмы-производителя лизата амебоцитов является оправданным. Согласно с ГФ, испытания проводят на 12 кроликах, массой 2,5 — 3,0 кг с соблюдением строгого стандартного рациона питания в специально оборудованном тихом, светлом, без перепадов температуры помещении. Кроликов помещают в специально оборудованные индивидуальные боксы, позволяющие проводить постоянное измерение температуры[66,67].
Таблица 1.
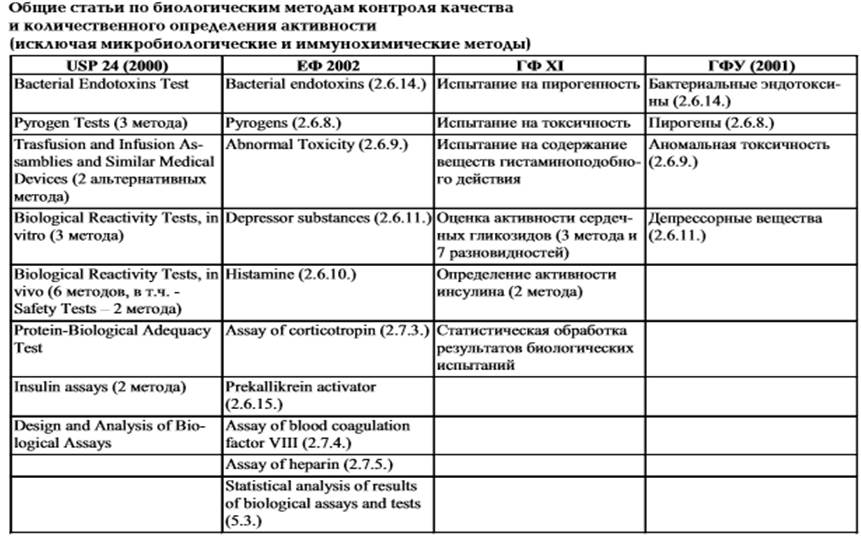
В начале опыта препарат вводится трем животным. ЛС считается апирогенным, если суммарное повышение температуры тела животных составляет не более 1,2 °С. На втором этапе испытаний препарат вводят шести животным. ЛС признают пирогенным, если ЕД/ превышает 3,0. На третьем этапе число животных равно девяти. ЛС считают пирогенным при Ед/ > 4,5. Наконец, на четвертом этапе используется 12 животных, и препарат считают пирогенным, если Ед^ > 5,4. После окончания проверки составляется протокол, который включает параметры эксперимента, заключение о соответствии проверяемого раствора требованиям на пирогенность. Испытание заключается в измерении повышения температуры тела кроликов, вызванныйвнутривеновым введением стерильного раствора испытуемого вещества. Выбор животных. Используют здоровых половозрелых кроликов любого пола массой не менее 1,5 кг, получавших полноценное сбалансированное питание, не содержащее антибиотиков, масса которых не снижалась в течение недели, предшествующий испытанию. Кролика не стоит использовать в испытании, если: А) в течение предшествующих 3-х дней он использовался в испытании на пирогенность, давшем отрицательный результат, или Б) в течение предшествующих 3 недель он использовался в испытании на пирогенность, в котором испытуемое вещество было признано не соответствующим требованиям испытания. Помещения для животных. Кроликов содержат индивидуально в тихом помещении при постоянной соответствующей температуре. Кроликов не кормят на кануне вечером перед испытанием и до его окончания. В течение испытания кроликам не дают воду. Испытание проводят в тихом помещении, где отсутствуют риск шумов, которые могут возбудить животных, и в котором температура поддерживается на уровне, не более, чем на 3°С отличающимся от температуры, поддерживаемой в месте постоянного содержания кроликов. Или в котором кролики содержались в течение не менее 18 часов до начала испытания. Материалы. Стеклянная посуда, шприцы и иглы. Тщательно моют всю стеклянную посуду, шприцы и иглы водой для инъекций и нагревают в сухожаровом шкафу при 250°С в течение 30 мин или при 200°С в течение 1ч. Станки. Станки для кроликов, температура у которых измеряется с помощью электрического прибора, устроены таким образом, чтобы животные фиксировались лишь с помощью свободно закрепленных на шее хомутов; остальная часть ела остается относительно свободной так, чтобы кролики могли сидеть в обычном положении. Кролики не удерживаются с помощью ремней или другими подобными методами, которые могут причинить вред животному. Животные помещаются в станки не менее чем за 1 час до первого измерения температуры и остаются там в ходе всего испытания. Термометры. Используют термометр или электрическое устройство, показывающее температуру с точностью до 0,1°С, вводя его в прямую кишку на глубину около 5см. Глубина введения постоянна для любого кролика для любого из испытаний. При использовании электрического устройства, оно может оставаться на месте в течение всего испытания[23]. Испытание проводят с использованием группы из трех группы кроликов. Испытуемый жидкий продукт перед введением нагревают до температуры около 38,5°С. Испытуемый продукт может быть растворен или разведен в апирогенном растворе, содержащем 9г/л натрия хлорида R, или другим указанным растворителем. Раствор медленно вводят в крайнюю вену уха каждого из кроликов в течение не более 4 мин, если иное не указано в частной фармакопейной статье. Вводимый объем должен составлять не менее 0,5 мл и не более 10 мл на 1 кг массы тела. Определение исходной и максимальной температуры. За «исходную температуру» каждого из кроликов принимают среднее двух значений температуры, зарегистрированных у данного кролика с интервалом 30 мин в течение 40 мин, предшествующих введению испытуемого продукта. «Максимальная температура» каждого из кроликов – самая высокая температура, зарегистрированная у данного кролика в течение 3 ч после введения. Температуру каждого из кроликов регистрируется с интервалами, не превышающими 30 мин, начиная не менее, чем за 90 мин до введения испытуемого продукта и в течение 3 ч после введения. За результат испытания принимают разность между максимальной и исходной температуры каждого из кроликов. При отрицательной разности результат принимают равным нулевой реакцией. Кролики, у которых при определении исходной температуры два последовательных значения температуры варьируются в пределах, превышающих 0,2°С, исключаются из испытания. В каждом испытании используют кроликов, исходная температура которых отличается друг от друга не более чем на 1°С. Кролики, исходная температура которых выше 39,8°С или ниже 38,0°С, исключаются из испытания[22]. Пирогенность (Пиро- + греч. –genēs порождающий, производящий)способность вещества вызывать повышение температуры тела[21]. Данный метод имеет ряд недостатков. В эксперименте используют животных, чувствительность которых к пирогенам в 3 — 4 раза ниже, чем у человека. Это требует соответствующего увеличения тест-дозы. Кроме того, многие лекарственные вещества в дозах, близких к терапевтическим, могут вызвать токсические реакции и даже гибель животных. Поэтому используется заниженная величина тест-доз (инфузионные растворы глюкозы, антибиотики — бензил-пенициллина натриевая соль, линкомицина гидрохлорид и др.). На проведение одной серии опыта требуется около 5 ч. Биологические методы анализа лекарственных средств, в зависимости от решаемых с их помощью задач, подразделяются на две группы: -методы, с помощью которых проводится испытание чистоты и безопасности лекарств; -методы, с помощью которых проводится количественное определение биологической или, по сути, фармакологической активности лекарств. Методы первой группы используются для контроля безопасности лекарств независимо от их фармакохимической принадлежности. Результаты этих методов оцениваются по альтернативному принципу – «да» или «нет», «соответствует» или «не соответствует». Методы второй группы применяются для количественной оценки выраженности фармакологического эффекта, на основании чего путём сравнения с активностью стандарта определяется содержание в препарате действующего вещества. В отличие от химических методов, биологические методы контролируют факторы, оказывающие биологические эффекты, независимо от природного или синтетического происхождения лекарственных субстанций, и этот контроль осуществляется только с помощью фармакологических, токсикологических, микробиологических или иммунологических методик. В Табл. 2 представлен перечень биологических методов, каждый из которых является предметом специальных общих статей Государственной Фармакопеи Украины [37], Фармакопеи США (USP 24) [38], Европейской Фармакопеи (EФ 2002) [39] и Государственной Фармакопеи СССР 11-го издания (ГФ XI) [40]. Как видно из Табл. 2, перечень этих общих статей в разных фармакопеях весьма различается. Так, Фармакопея США значительное внимание уделяет безопасности лекарств и определённых видов медицинской техники и оборудования, которые контактируют с парентеральными лекарственными средствами. Этот контроль по Фармакопее США осуществляется по 5-ти основным монографиям с несколькими разновидностями методик. В Фармакопее США есть также общая статья, которая относится к биологическим методам контроля качества и которой нет аналогов в других Фармакопеях - по оценке на крысах, содержащихся на специальной голодной диете, белковой адекватности аминокислотных препаратов или гидролизатов белков. В то же время Фармакопея США не предусматривает какого-либо испытания на депрессорные, или, как называли ранее, вещества гистаминоподобного действия, имеющего важное значение при оценке безопасности препаратов биологического происхождения (органопрепаратов). Из методов количественного определения Фармакопея США сохранила в общих статьях только методику количественного определения инсулина, хотя известно, что в большинстве случаев это исследование проводится сейчас с помощью жидкостной хроматографии. В отличие от Фармакопеи США, Европейская Фармакопея ограничивается набором из 5 общих статей, из которых 2 статьи посвящены контролю лекарств на вещества гистаминоподобного действия. Одна из них – «Депрессорные вещества», выполняемая invivo, вторая – «Гистамин», выполняемая invitro. Основной темой настоящего сообщения является информация о биологических испытаниях, ставших предметом общих статей раздела 2.6 Государственной Фармакопеи Казахстана 1-го изд. (ГФК). К ним относятся: - статья 2.6.14 Бактериальные эндотоксины. Это испытание называют также ЛАЛ-тест, осуществляемый invitro; - статья 2.6.8 Пирогены. Испытание проводят на кроликах; - статья 2.6.9 Аномальная токсичность. Испытание проводят на мышах; - статья 2.6.11 Депрессорные вещества. Испытание проводят на кошках. Терминология, как и нумерация статей в ГФК, полностью соответствуют принятым в Европейской Фармакопее. Перечисленные испытания в большой степени затрагивают интересы предприятий, производящих парентеральные препараты или субстанции для изготовления таких препаратов. Известно, что инъекционное или инфузионное введение лекарств человеку сопряжено с повышенным риском развития нежелательных и токсических эффектов, что предъявляет особые требования к качеству и безопасности этих средств [41]. Результаты соответствующих испытаний в определённой степени отражают уровень технологической культуры фармацевтического производства. Подтверждением тому является то, что один из этих методов – тест на бактериальные эндотоксины – за рубежом применяется также и для контроля чистоты технологического оборудования и некоторых видов медицинской техники. Различия между Европейским и Американскими Фармакопеями касаются таких узловых аспектов методики и интерпретации результатов испытания, которые, безусловно, связаны с его надёжностью и экономичностью. Опубликован подробный сравнительный анализ методик испытания на пирогены в разных Фармакопеях [46], который выявляет и ряд других, возможно менее принципиальных расхождений между этими Фармакопеями, в т.ч. и в действующей пока в России монографии ГФ XI[47, 48]. Таблица 2.
Коротко о некоторых вопросах, которые, как показывает опыт, нередко возникают на предприятиях при контроле лекарственных средств на пирогены. Прежде всего, о величине тест-дозы испытуемого препарата. Этот вопрос был предметом обсуждения в научной литературе более двух десятилетий. Но кроме общих рекомендаций о минимальном и максимальном объёмах введения испытуемого раствора ни ГФ XI, ни одна из современных ведущих Фармакопей мира, не содержат каких-либо дополнительных разъяснений о подходах при расчёте тест-дозы для конкретного препарата. Существовавшие долгое время рекомендации об 1/10-1/20 человеческой дозы лекарственного препарата, как якобы оптимальной для животных [42], подвергнуты её же авторами критике и обоснованно утратили значение из-за их малой практической пригодности [49, 50]. В новом проекте соответствующей российской статьи и в разъяснениях к ней эти рекомендации вообще не упоминаются [47, 48]. Опыт и анализ соответствующих научных дискуссий показывают, что при разработке тест-дозы в испытании на пирогены на кроликах следует придерживаться следующих общих принципов: - оптимальная величина тест-дозы в пересчёте на 1 кг массы тела животного должнабыть максимально близкой к суточной терапевтической дозе для человека в пересчёте на 1 кг массы его тела [51], или, для большей надёжности, может превышать человеческую в 3-5 раз в соответствии с известными коэффициентами пересчёта средне эффективных доз между животными и человеком; - следует избегать дополнительного разведения нативного раствора испытуемого препарата, если это не вызвано объективной необходимостью снижения его фармакологических или токсических эффектов, мешающих корректному проведению испытания на кроликах [49]; - если из-за фармакологических или токсических эффектов испытуемого препарата указанные рекомендации не удаётся выполнить, то его нативный раствор можно разводить, но не более чем в 8-10 раз, хотя это соответственно снижает надёжность испытания. При дальнейшем разведении испытание на кроликах утрачивает смысл и такой препарат, безусловно, необходимо контролировать на пирогены с помощью ЛАЛ-теста. Какие препараты обязательно контролировать на пирогены, а какие можно не контролировать? Ведущие Фармакопеи мира не содержат указаний на этот счёт. Однако, судя по зарубежной документации, поступавшей ряд лет в Ведущие производители лекарственных средств, очевидно, в конкуренции за рынки сбыта давно и однозначно решили этот вопрос – субстанции для инъекционных препаратов и сами такие препараты должны контролироваться на пирогены. А в проекте российской общей статьи «Испытание на пирогенность» для ГФ XII прямо указывается: «Испытанию на пирогенность должны подвергаться все инъекционные лекарственные средства независимо от дозы, объёма и пути введения, используемых в клинике» [47]. Однако далеко не все препараты можно контролировать в испытании на кроликах. Основными препятствиями этому являются токсичность или фармакологические свойства, из-за которых невозможно осуществить данный тест. В связи с этим, в США был разработан и с 1980 года официально введен в USP 20 тест на «Бактериальные эндотоксины», он же ЛАЛ-тест. ЛАЛ-тест характеризуется высокой специфической чувствительностью и позволяет выявлять эндотоксины в количестве, которое в 100 раз ниже их минимальной пирогенной дозы (МПД) на кроликах [51]. Установлена тесная корреляция (до 85%) между результатами ЛАЛ-теста и испытанием пирогенности на кроликах, которая возрастает до 100 % в случаях, когда количество эндотоксина равняется или превышает МПД на кроликах [52]. Зарубежные производители предлагают специальное оборудование и реактивы, в том числе, стандарт эндотоксина, что упрощает и, главное, стандартизует контроль на наличие бактериальных эндотоксинов в лекарственных средствах. Просчитаны определенные финансово-экономические преимущества использования ЛАЛ-теста в связи с исключением затрат на содержание кроликов, что особенно ощутимо при крупномасштабном производстве или когда производство инъекционных препаратов открывается впервые [43]. Анализ литературы [42, 43] и сделанные ранее учеными испытания позволяют выделить определенные группы инъекционных препаратов, технологического оборудования и материалов, в которых испытание на содержание бактериальных эндотоксинов необходимо или желательно. К ним относятся: -препараты, которые вызывают специфическое фармакологическое понижение температуры тела, что может маскировать наличие пирогенов в количестве, которое фактически не ниже, чем их МПД на кроликах (транквилизаторы, нейролептики, ненаркотические анальгетики-антипиретики, глюконат кальция, кортикостероиды, некоторые анестетики); - препараты, которые вызывают повышение температуры тела, обусловленное фармакологическими или антигенными свойствами, что мешает объективному анализу действительных причин гипертермии у кроликов (препараты плаценты, вакцины, новокаин); - препараты, которые непосредственно после введения так изменяют физиологическое состояние животных из-за их фармакологического действия или токсичности, что это не позволяет вести объективную термометрию согласно требованиям теста на пирогенность (средства для наркоза, наркотические анальгетики, снотворные средства, сердечные гликозиды, деполяризующие миорелаксанты, адреналин, инсулин); - инфузионные препараты, суточный объём введения которых человеку составляет 500 мл и выше; - препараты, предназначенные для наиболее ответственного пути введения интратекального и поэтому требующие особенно жёсткого контроля на пирогены даже тогда, когда их количество ниже, чем МПД на кроликах; - препараты, после первого введения которых кроликам, повторное использование тех же животных затрудняется или исключается (препараты с антигенными свойствами, антибиотики, противоопухолевые препараты); - радиофармацевтические препараты, испытание которых на кроликах требует специального дорогостоящего оборудования и больших объемов раствора (из-за быстрого распада большинства радиоизотопов), что делает это испытание практически недосягаемой задачей; - лекарственное сырье, прежде всего, вода для инъекций, а также ампулы, флаконы и все элементы технологического оборудования, которые используются в производстве промежуточных продуктов и готовых лекарственных средств для парентерального введения. В USP 22 (1990) ЛАЛ-тестом контролировалось 342 лекарственных средства, а в USP 24 (2000) их количество составляет более 660 наименований. В зарубежных спецификациях, поступавших в ГП «Научно-экспертный фармакопейный центр» в последние годы уже почти нет препаратов, которые контролировались бы иначе, как ЛАЛ-тестом. В отличие от испытания на пирогены на кроликах, испытание на бактериальные эндотоксины находится в стадии активных научных исследований. В результате соответствующие общие статьи в ведущих Фармакопеях претерпевают постоянные довольно ощутимые изменения и дополнения. При этом в общей статье ЕФ 2001 впервые появились разъяснения о гармонизации физической сущности единиц измерения бактериальных эндотоксинов в Европейской Фармакопее и Фармакопее США, за которой, естественно, следует гармонизация средств и методов измерения содержания бактериальных эндотоксинов в этих Фармакопеях. Повсеместное распространение ЛАЛ-теста за рубежом обусловлено рядом факторов финансово-экономического, экологического и маркетингового характера. Среди них важное значение имеет более высокая надёжность и универсальность этого метода, что в условиях производства по правилам GMP становится одним из рычагов повышения конкурентоспособности продукции. Это обстоятельство немаловажно и для отечественных производителей парентеральных препаратов, поскольку ситуация на фармацевтическом рынке Казахстана, хоть и с отставанием, но всё-таки следует мировым законам рыночной экономики. Очевидно, что Государственная Фармакопея Казахстана не может идти вразрез с общемировой практикой, поэтому в ГФК 1-го изд. и включена статья 2.6.14 «Бактериальные эндотоксины», полностью гармонизированная со статьей Европейской Фармакопеи и содержащая в национальной части лишь дополнительные разъяснения касательно используемых реактивов и стандарта эндотоксинов.
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 1123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.153.38 (0.048 с.) |