
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: закони Фарадея та їх застосування.
План: 1. Електроліз. 2. Перший закон Фарадея. 3. Другий закон Фарадея. Теоретичні відомості Електролізом називається окисно-відновний процес, що відбувається на електродах під час проходження електричного струму крізь розплав або розчин електроліту. Суть електролізу полягає у здійсненні за рахунок електричної енергії хімічних реакцій – відновлення на катоді й окислення на аноді. При цьому катод віддає електрони катіонам, а анод приєднує електрони від аніонів. Відновна й окисна дія електричного струму в багато разів сильніша, ніж дія хімічних відновників і окисників. Так, жоден хімічний окисник неспроможний відняти у фтори-іона його електрон. Тому протягом довгого часу Фтор не могли добути у вільному стані, хоча його сполуки значно поширені у природі. Відняти електрон у фтори-іона вдалося лише при електролізі розчину фториду Калію у фтороводневій кислоті. У цьому випадку на аноді виділяється Флуор (2F- - 2е = F2), А на катоді – Гідроген (2Н+ + 2е = Н2). Суть електролізу зручно зображати за допомогою схеми, яка показує дисоціацію електроліту, напрямок руху іонів, процеси на електродах і речовини, що виділяються. Схема електролізу розплаву хлориду Натрію має такий вигляд: NаCl Катод ← Nа+ + Cl- → Анод Nа+ + е = Nа 2Cl- -2е = Cl2 Для проведення електролізу занурюють у розплав або розчин електроліту і з’єднують їх з джерелом постійного струму. Приклад, у якому проводять електроліз, називають електролізером, або електролітичною ванною. Електроліти є провідниками другого роду. Електролізом водних розчинів отримують Цинк, Кадмій, Кобальт, Фтор, Хлор, гідроксид Калію та інші речовини. Кількість речовин,які отримуються чи використовуються залежить від кількості електрики,яка пройшла крізь розчин чи розплав. Перший закон Фарадея. Маса речовини, що утворюється під час електролізу, пропорційна кількості електрики, яка пройшла крізь розчин чи розплав: ᶆ = E ԛ, де Е – електрохімічний еквівалент; ԛ - кількість кулонів електрики (ԛ = І τ); τ – час (с); І – сила струму (А). Якщо кількість пропущеної електрики рівно одному кулону (ԛ=1Кл), то ᶆ = E. Відповідно, електрохімічний еквівалент (E) чисельно дорівнює масі речовин, які виділяються при проходженні одного кулона електрики.
Закони Фарадея – основні закони електролізу. Встановлюють взаємозв’язок між кількістю електрики, яка проходить через електропровідний розчин (електроліт), і кількістю речовини, яка виділяється на електродах.
Другий закон Фарадея: Маси речовин, що утворюються під час електролізу внаслідок проходження однакової кількості електрики, пропорційні їхнім еквівалентам ( електрохімічні еквіваленти елементів прямопропорційні їх хімічним еквівалентам). де A - атомна маса речовини, ν - заряд її йона, F - число Фарадея. Частка A/ν називається хімічним еквівалентом. Рівні кількості електрики, які виділяються в результаті електролізу еквівалентні кількості різних речовин. Відповідно, для виділення одного грам-еквіваленту будь-якої речовини необхідно затратити однакову кількість електрики. Таке число називають числом Фарадея. Число Фарадея (F) дорівнює добутку числа Авогадро на заряд електрона: F = N·е = 6,022·1023·1,6022·1019Кл = 96485 Кл, F = 96485 Кл. де N – число Авогадро, е – заряд електрону. Для одного грам- еквіваленту речовини необхідно пропустити через розчин 96485 Кл електрики. Отже, електрохімічний еквівалент дорівнює грам-еквіваленту речовини, поділеному на число Фарадея: 𝐤 = ℈ / F, де 𝐤 – коефіцієнт пропорційності, або електрохімічний еквівалент; ℈ - грам-еквіваленту речовини; F - число Фарадея.Наприклад, електрохімічний еквівалент для Аргентуму: EАg = 107,868/ 96485 = 0,0011281 г/Кл; електрохімічний еквівалент для Цинку: ЕZn = 65,38 / 2 · 96485 =0,0003281 г/Кл. Закони Фарадея мають велике значення для проведення різних розрахунків, пов’язаних з електролізом. Завдання для самоконтролю: 1.Електроліз. Суть електролізу. 2. Перший закон Фарадея. 3. Другий закон Фарадея. 4. Число Фарадея. 5. Визначити електрохімічний еквівалент для Аргентуму. Рекомендована література: 1. Г.П. Хомченко.Посібник з хімії.-К.:Видавництво АСК.,2003р.-ст. 198-205. 2. Н.М.Буринська. Основи загальної хімії, 11клас:Підручник з поглибл. Вивченням хімії.-Київ;Ірпінь:ВТФ «Перун»,1997.- ст.130-135. 3.В.В.Сухан.Хімія:Посібник для вступників до вузів.-К.Либідь,1993.-ст.105-107.
4.І.А.Гройсман.Хімія.Закони, схеми, формули, рівняння.Київ: «Логос»,1998р.- 39. 5. Матеріали з Інтернету.
Самостійне вивчення. Тема: Комплексні сполуки. План: 1.Характеристика комплексних сполук. 2.Відмінність між бінарними та комплексними сполуками. 3.Виконання завдань по даній темі. Теоретичні відомості Особливе місце серед різноманітніх сполук посідають комплексні сполуки. Вони утворюють при з`єднуванні молекул двох речовин: СuSO4 + 4 NH3 = [Cu(NH3)4]SO4, або HgI2 + KI = K2[HgI4]. Комплексні сполуки - це сполуки, до складу яких входять комплексні частинки (комплекси), що вміщують центральний атом (комплексоутворювач) оточений лігандами. Утворення комплексів можна представити як результат взаємодії за донорно-акцепторним механізмом стабільних при звичайних умовах частинок: атомів, іонів або молекул. 1. У комплексних сполуках розрізняють внутрішню і зовнішню сфери.Групу атомів внутрішньої сфери беруть у квадратні дужки. П р и к л а д 1. У комплексній сполуці [Cu(NH3)4]Cl2 внутрішньою сферою є комплексний іон [Cu(NH3)4]2+ ,а зовнішньою сферою-два аніони Cl-. 2. Комплексні сполуки,що є електролітами, у розчині дисоціюють на комплексний іон і зовнішньосферні іони: [Cu(NH3)4]=[Cu(NH3)42+ + 2Cl-. Центральний атом (іон) комплексу називається комплексоутворювачем. Так,у комплексі[Cu(NH3)4]Cl2 комплексоутворювачем є іон міді Cu2+.Іони або полярні молекули,що зв`язані з комплексоутворювачем,називають лігандами. У комплексі [Cu(NH3)4]Cl2 лігандами є полярні молекули аміаку NH3. Лігандами можуть бути полярні молекули NH3 , H2O, CO та інші,іони Cl- , OH-, CN- тощо.Кількість лігандів,що оточують комплексоутворювач, називається координаційним числом. Ліганди пов`язані з комплексоутворювачем донорно-акцепторними зв`язками. При цьому комплексоутворювач-акцептор електронних пар, а ліганд-донор. Кожний комплексоутворювач характеризується певним координаційним числом відповідно до електронної будови. Так,координаційне число 2 мають комплексоутворювачі Ag+ iAu+; координаційне число 4: Cu2+,Hg2+,Au3+,Bi3+; координаційне число 6: CO3+, Fe3+, Fe2+, Pt4+, Zn2+, Cr3+. Часто комплексоутворювачами є катіони d-елементів. 3. Заряд комплексного іона дорівнює алгебраїчній сумі зарядів комплексоутворювача і лігандів. Заряди внутрішньої і зовнішньої сфер рівні між собою,але протилежні за знаком.Через це комплексна сполука в цілому є електронейтральною. 4. Розрізняють катіонні,аніонні і нейтральні комплекси. Катіонні комплекси містять нейтральні ліганди. Це амінокомплекси й аквакомплекси. П р и к л а д 2. Комплексна сполука [Zn(NH3)4]Cl2 за своєю природою є амінокомплексом, а [Cu(NH3)4]Cl2 –аквакомплексом. Аніонні комплекси містять ліганди,що складаються з аніонів.Так K3[Co(NO3)6], K[Al(OH)4], K2[SiF6].Неметалеві комплексоутворювачі часто утворюють аніонні комплекси. Нейтральні сполуки не мають зовнішньої сфери [Ni(CO)4], [Pt(NH3)2(CO)2]. 5. Для комплексних сполук характерні реакції обміни у яких комплексний іон не руйнується. П р и к л а д 3. 2K3[Fe(CN)6] + 3FeSО4 = Fe3(Fe(CN)6]2 +3K2SO4, іонний вигляд: 6K++2[Fe(CN)6I3-+3Fe2++3SO42- = Fe3[Fe(CN)6]2+6K++3SO42- або в скороченій формі: 2[Fe(CN)6]3- + 3Fe2+ = Fe3[Fe(CN)6]2. 6. Принаписанні формул комплексних сполук на першому місці пишеться символ центрального атома,за ним записують іонні і нейтральні ліганди, а внутрішню сферу беруть у квадратні дужки.
П р и к л а д 4. Комплексний аміакат платини [Pt(NH3)4]Cl2. Утворення комплексів не пов`язане з виникненням нових електронних пар. 7. Комплексні сполуки широко застосовуються в промисловому виробництві, аналітичній практиці,медицині тощо.Комплексні сполуки виконують важливу роль у життєдіяльності живих організмів.Наприклад,такі важливі фізіологічні речовини,як хлорофіл(комплексоутворювач Mg2+)і гемоглобін(комплексоутворювач Fe2+) є комплексними сполуками. Головною відмінністю між простими бінарними і комплексними сполуками є наявність у комплексних сполуках донорно-акцепторних зв’язків. У результаті реакції комплексоутворення кількість хімічних зв’язків у молекулах комплексних сполук, порівняно із звичайними бінарними сполуками, збільшується. Наприклад, кількість хімічних зв’язків у молекулах вихідних речовин для реакції BF3 + KF = K[BF4] чотири (три в BF3 і один в KF). У молекулі ж комплексної сполуки K[BF4] їх уже п’ять: чотири ковалентні зв’язки між бором і йонами фтору (один із яких утворений за донорно-акцепторним механізмом); п’ятий зв’язок виникає між йонами [BF4] - i K+. Комплексна сполука, наприклад K[BF4], складається з внутрішньої (координаційної) сфери, яку при написанні беруть в квадратні дужки, і зовнішньої сфери – в цьому випадку йонів калію. Внутрішня і зовнішня сфери комплексної сполуки найчастіше з’єднані між собою йонним зв’язком.
ліганди сильного поля ліганди слабкого поля PtCI2 × 2HCI, PtCI2 × 2NH3 i PtCI2 × 4NH3, якщо для Платини (ІІ) к.ч. = 4. До якого типу комплексних сполук (аніонного, катіонного чи нейтрального) вони належать? Напишіть рівняння дисоціації складених Вами комплексних сполук у водних розчинах. Які із цих сполук є електролітами? Напишіть вираз константи нестійкості для останньої із трьох складених Вами сполук. Згідно з (1) в усіх трьох варіантах наведеного вище завдання комплексоутворювачами є йони платини (ІІ), а згідно з (2) лігандами будуть в першій сполуці йони хлору, в другій – молекули амоніаку і йони хлору (оскільки кількість молекул амоніаку менша від к.ч.), в третій – молекули амоніаку. Таким чином, склад сполук повинен відповідати формулам: Числове значення Кн для комплексних сполук зменшується із зростанням стійкості комплексної сполуки. Молекула будь-якої комплексної сполуки в цілому є електронейтральною, тому, знаючи заряд внутрішньої сферикомплексної солі, можна вичислити ступінь окиснення центрального атома. Для цього від заряду внутрішньої сфери необхідновідняти сумарний заряд лігандів (CN-, NO0).
Завдання 3. Напишіть рівняння реакції комплексоутворення: Згідно із залежністю (1) в заданій реакції комплексоутворювачем буде атом d-елемента – Ферума (ІІІ), а лігандами, згідно з (2), – йони CN -. Координаційне число центрального атома (Ферума ІІІ), як видно з електронної будови, дорівнює 6 (шість вільних орбіталей):
. Завдання для самоконтролю: 1. Поясніть теорію будови комплексних сполук. 2. Як визначають заряд комплексного йона і комплексного утворювача? 3. Як записують константу нестійкості комплексного йона? 4. Де комплексні сполуки застосовують у поліграфічних процесах? 1.Напишіть рівняння реакції комплексоутворення: 2.Визначте заряд комплексного йона, ступінь окиснення і координаційне число центрального атома в сполуках: Рекомендована література: 1. В.П.Басов.Хімія:Навчальний посібник:К.:Каравела,Львів,2003 р.- ст.75-77. 2. Г.П. Хомченко.Посібник з хімії.-К.:Видавництво АСК.,2003р.-ст. 169-172. 3. Н.М.Буринська. Основи загальної хімії, 11клас:Підручник з поглибл. Вивченням хімії.-Київ;Ірпінь:ВТФ «Перун»,1997.- ст.128-130. 4.В.В.Сухан.Хімія:Посібник для вступників до вузів.-К.Либідь,1993.-ст.278;-279. 5.І.А.Гройсман.Хімія.Закони, схеми, формули, рівняння.Київ: «Логос»,1998р.- 34-35. 6.Хімічна енциклопедія: В 5 т. / Під ред. И.Л. Кнунянц. – М., 1990. – Т. 2. 7.Матеріали з Інтернету. Самостійне вивчення.
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 1395; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.62.219 (0.04 с.) |
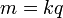 , де k – електрохімічний еквівалент речовини, m - маса речовини, q - заряд.
, де k – електрохімічний еквівалент речовини, m - маса речовини, q - заряд.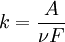


 Fe+3
Fe+3 



