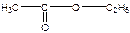Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекарственные вещества, содержащие вторичную и третичную аминогруппы ⇐ ПредыдущаяСтр 5 из 5
Вторичная и третичная аминогруппы – это ФГ, входящие в структуру вторичных и третичных аминов. Их можно рассматривать как производные аммиака, у которого два или три атома водорода замещены на углеводородные радикалы:
Аммиак вторичный амин третичный амин Вторичная и третичная аминогруппы могут быть представлены и гетероатомом азота (вторичным, третичным), входящим в состав цикла лекарственного соединения. Во всех вышеназванных случаях атом азота имеет неподелённую пару электронов и придаёт соединениям свойства оснований, сила которых зависит от природы радикалов и атомных групп, связанных с азотом. В медицинской практике лекарственные соединения, содержащие рассматриваемые ФГ применяются в виде солей и реже оснований. Примерами лекарственных соединений, содержащих вторичную аминогруппу, являются эфедрина гидрохлорид, адреналина гидротартрат, дикаин; третичную – новокаин, ксикаин, тримекаин, аминазин; вторичный гетероатом азота – дибазол, теофиллин; третичный – кодеин, морфина гидрохлорид, промедол, атропина сульфат, хинозол, папаверина гидрохлорид.
7.1. Реакции с осадительными (общеалкалоидными) реактивами В соответствии с основными свойствами соединения данной группы могут образовывать в солянокислой среде, даже в сильно разбавленных растворах труднорастворимые в воде, чаще всего окрашенные соединения с кислотами, солями тяжелых металлов, комплексными йодидами. Используемые для этих целей реактивы делят обычно на 2 группы: 1) реактивы, дающие простые соли: хлорная (циклодол); марганцевая (кокаина гидрохлорид); тиоцианистая (дикаин); пикриновая кислоты (промедол, оксилидин); танин (кофеин) и др. Например, [R3N]∙HCl + KMnO4 → ↓[R3N]∙HMnO4 + KCl
[R3N]∙HCl +
2) реактивы, дающие комплексные соли: раствор йода в йодиди калия – реактив Вагнера или Бушарда (кофеин, дибазол); раствор йодида висмута в йодиде калия – реактив Драгендорфа (для обнаружения азотсодержащих веществ основного характера при хроматографии в тонком слое сорбента); раствор йодида ртути в йодиде калия – реактив Майера (платифиллина гидротартрат, секуринина нитрат) и др. Например, R3N∙HCl + nJ2 + KJ →↓ R3N∙ nJ2∙HJ + KCl R3N∙HCl + KBiJ4 → ↓[R3N]∙HBiJ4 + KCl
Реакции с данными реактивами не являются специфичными, но специфичность их возрастает, если продукты реакции имеют кристаллическое строение и плавятся при определенной температуре. Так, пикраты аминов, чаще всего имеют желтую окраску, характерную форму кристаллов и четкий интервал температуры плавления (пикраты атропина, пахикарпина, стрихнина и др.). Характерную форму кристаллов имеют также перманганат кокаина, перйодид морфина и др. По температуре плавления определяют подлинность дикаина в виде роданида, циклодола в виде перхлората и др.
7.2. Реакция выделения оснований В связи с тем, что вторичные и третичные амины обладают слабыми основными свойствами, они могут быть выделены из водных растворов солей щелочными реагентами в виде маслянистой жидкости (новокаин) или осадка, у которого можно определить температуру плавления, например при фармакопейном анализе атропина сульфата, папаверина гидрохлорида.
R3N∙HCl + NaOH →↓ R3N + NaCl + H2O
7 .3. Реакции с солями тяжелых металлов В имидазольном кольце атом водорода при вторичном гетероатоме азота придает соединениям слабые кислотные свойства (теофиллин, дибазол). В связи с этим для их качественного анализа могут быть использованы реакции, основанные на образовании нерастворимых солей с ионами тяжелых металлов. В качестве реактива на теофиллин ГФ Х рекомендует раствор хлорида кобальта. Предварительно препарат переводят в натриевое производное. Получается белый с розоватым оттенком осадок.
Подлинность теофиллина можно также установить по образованию характерного осадка соли серебра. Получается полупрозрачный студенистый осадок, разжижающийся при нагревании и вновь застывающий при охлаждении.
8. Лекарственные вещества, содержащие сложноэфирную группу Сложно-эфирная группа включает остаток кислоты и спирта (или фенола). Её содержат производные салициловой кислоты (фенилсалицилат, кислота ацетилсалициловая), п-аминобензойной кислоты (анестезин, новокаин, дикаин), стероидных гормонов (дезоксикортикостерона ацетат, кортизона
ацетат, эстрадиола дипропионат), производные тропана (атропина сульфат, гоматропина гидробромид, тропацин, тропафен, кокаина гидрохлорид), хинуклидина (ацеклидин, оксилидин), кальция пангамат, кокарбоксилаза, токоферола ацетат, пиридоксальфосфат, нитроглицерин. На основе химических свойств этой ФГ в анализе ЛВ её содержащих используются следующие реакции: - гидролитического разложения; - образования окрашенных солей гидроксамовых кислот («гидроксамовая реакция»).
8.1. Гидролитическое разложение (гидролиз) в присутствии кислоты или щёлочи Образующиеся продукты гидролиза идентифицируют известными реакциями (или другими способами).
фенилсалицилат Кислота салициловая фенол (по запаху)
При гидролитическом разложении кокаина, который содержит две сложноэфирные группы образуются спиртокислота – экгонин, бензойная кислота и метиловый спирт. Бензойная кислота вступая в реакцию этерификации с метиловым спиртом, образует метиловый эфир, который определяют по запаху. При стоянии полученный эфир подвергается гидролизу с образованием кристаллического осадка бензойной кислоты.
кокаин экгонин кислота бензойная метиловый спирт C6H5COOH + CH3OH → Метилбензоат
При гидролизе пиридоксальфосфата образуется фосфорная кислота и соответствующий спирт.
Фосфорную кислоту идентифицируют: - с нитратом серебра по образованию жёлтого осадка фосфата серебра: - с магнезиальной смесью по образованию белого осадка двойной соли – магния-аммония фосфата. - с молибдатом аммония в азотнокислой среде по образованию жёлтого кристаллического осадка.
Гидролиз в присутствии щёлочи.
кислота ацетилсалициловая салицилат натрия ацетат натрия
Салицилат натрия идентифицируют после подкисления по образованию белого кристаллического осадка салициловой кислоты.
Ацетат натрия – по образованию уксусноэтилового эфира, имеющего фруктовый запах. CH3COOH + C2H5OH →
8.2. Гидроксамовая реакция Основана на взаимодействии сложных эфиров с гидроксиламином в щелочной среде с образованием гидроксамовых кислот и спиртов. Гидроксамовые кислоты с ионами в кислой среде образуют окрашенные комплексные соли – гидроксаматы. Реакция является фармакопейной для ацеклидина, оксилидина, кортизона ацетата.
|
||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 287; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.23.123 (0.013 с.) |



 →
→  + HCl
+ HCl + NaOH →
+ NaOH →  +H2O
+H2O + CoCl2
+ CoCl2 
 + 2NaCl
+ 2NaCl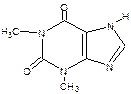 + NaOH →
+ NaOH →  + H2O
+ H2O + NaNO3
+ NaNO3 +HOH→↓
+HOH→↓  +
+ 
 + 2HOH →
+ 2HOH → 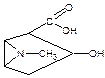 + C6H5COOH + CH3OH
+ C6H5COOH + CH3OH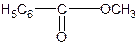
 + HOH →
+ HOH → 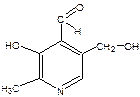 + H3PO4
+ H3PO4 + 2NaOH →
+ 2NaOH →  + CH3COONa
+ CH3COONa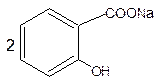 + H2SO4 → ↓
+ H2SO4 → ↓ 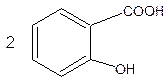 + Na2SO4
+ Na2SO4