Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика подгруппы. Физические свойства простых веществ.
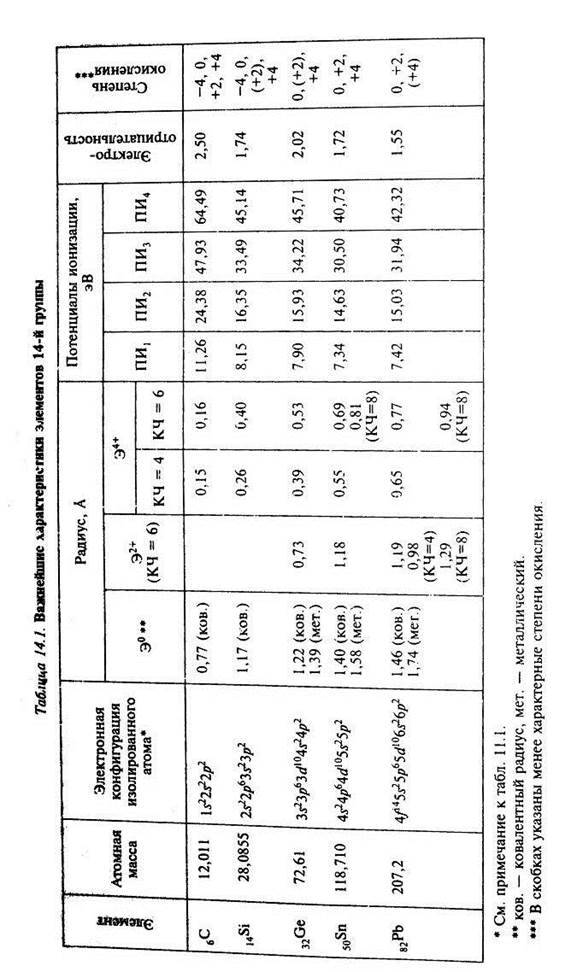
Главная подгруппа четвертой группы периодической системы включает в себя типические элементы (углерод С, кремний Si) и элементы подгруппы германия (германий Ge, олово Sn, свинец Pb). Элементы подгруппы углерода имеют четыре валентных электрона. Общая электронная формула ns2np2. Углерод и кремний имеют предвнешнюю электронную оболочку соответствующих благородных газов: 1s2 и 2s22p6. Элементы подгруппы германия на предвнешней оболочке содержат 18 электронов. Все основные характеристики атомов элементов подгруппы углерода приведены в таблице. Общая характеристика углерода. Это элемент IV группы второго периода. Электронное строение атома 1s22s22p2. На валентном уровне число электронов совпадает с числом орбиталей и это приводит к тому, что в соединениях с ковалентным характером связи атом углерода стремится быть четырехвалентным, образуя четыре ковалентных связи по обменному механизму. Это могут быть и s-, и p-связи, которые весьма прочны, как и у всех элементов II периода. У углерода нет предпочтения ни к тем, ни к другим. У углерода не высокая и не низкая ЭО, поэтому для него весьма характерно образование прочных гомоатомных связей. Эти связи прочны еще и потому, что они короткие и не дестабилизируются межэлектронным расталкиванием, как, например, у кислорода или азота. Отсюда - огромное разнообразие органических соединений. Согласно электронному строению атома углерода, степени окисления его лежат в интервале от –4 до +4, и в этом диапазоне для углерода возможны все степени окисления, причем в одном и том же соединении могут быть атомы углерода в разных степенях окисления. Соединения углерода весьма разнообразны, особенно если учесть органические соединения. У углерода, подобно азоту, невозможно выделить самую устойчивую степень окисления.
Простые вещества. По содержанию в земной коре (0,14 ат.%) углерод уступает многим элементам. Тем не менее, углерод – главная составная часть животного и растительного мира. Он входит в состав каменного угля, нефти, природных газов, а также многих минералов: мел, мрамор, известняк CaCO3, доломит CaCO3 · MgCO3, магнезит MgCO3, сидерит FeCO3, малахит (CuOH)2CO3 и др. В виде углекислого газа присутствует в воздухе. Аллотропия углерода. В свободном состоянии в природе углерод встречается в виде четырех простых веществ различного строения – графита, алмаза (структуры которых представлены на рис.1), карбина и фуллерена.
Рис.1 Кристаллические структуры алмаза (а) и графита (б)
Алмаз – бесцветное, прозрачное вещество с плотностью 3,5 г/см3. Он сильно преломляет лучи, не электропроводен, хрупок, плохо проводит тепло, является самым твердым из минералов. За счет sp3 – гибридизации каждый атом в алмазе образует четыре равноценные и прочные ковалентные σ- связи с соседними атомами углерода, что объясняет высочайшую твердость и отсутствие электропроводности в обычных условиях. Графит – мягкое слоистое кристаллическое вещество с гексагональной структурой, серовато-черного цвета, мягкий, жирный на ощупь, с плотностью 2,2 г/см3. Легко царапается ногтем и при трении оставляет черные полосы на бумаге. Хорошо проводит тепло и электрический ток, не пропускает свет, подобно металлам, отражая его своей поверхностью. Атомы углерода в графите расположены в вершинах правильных шестиугольников, расположенных в параллельных слоях. Расстояние между соседними слоями (93,4 Аº) больше, чем расстояние между атомами углерода в плоскости (1,415 Аº), вследствие чего связь между атомами в слоях гораздо прочнее, чем связь между атомами в различных слоях. sp2 – гибридное состояние «слоевых» атомов стабилизируется делокализованной π-связью, образованной оставшимися валентными электронами. Карбин – черный мелкокристаллический порошок с плотностью 1,9 – 2 г/см3, обладает полупроводниковыми свойствами (ΔЕ ≈ 1 эВ). Под действием света его полупроводниковые свойства значительно возрастают. Решетка карбина гексагональная, построена из прямолинейных цепочек Сn двух типов - различают α-карбин (−С ≡ С−С ≡ С−) и β-карбин (=С=С=С=С=). Фуллерены – эта аллотропная модификация углерода обнаружена в конце ХХ в. Шарообразные С60 или дынеобразные С70 полые молекулы, поверхность которых состоит из пяти- и шестиугольников из атомов углерода
Кремний. По распространенности на Земле кремний (20 ат.%) уступает только кислороду, но содержится в основном в виде кислородных соединений. Земная кора более чем на половину состоит из кремнезема SiO2, силикатных и алюмосиликатных пород.
В связи с тем, что наиболее характерным типом гибридизации валентных орбиталей атома кремния является sp3-гибридизация, то наиболее устойчивой будет алмазоподобная (кубическая) модификация. Она тугоплавка, отличается высокой твердостью, но уступает по этим свойствам алмазу. Из-за частичной делокализации связи эта модификация имеет темно-серый цвет и металлический вид. При комнатной температуре кремний - полупроводник (ΔЕ ≈ 1,12 эВ). Гексагональная (графитоподобная) модификация кремния неустойчива. В парах углерод и кремний содержат двухатомные молекулы, которые при охлаждении разрушаются и переходят в твердую фазу с алмазоподобной структурой.
Германий – тугоплавкое твердое вещество серебристо-белого цвета, по внешнему виду очень похож на металл, но имеет алмазоподобную решетку, поэтому очень хрупкий. Германий обладает высоким удельным сопротивлением, которое уменьшается при увеличении температуры.
Олово проявляет полиморфизм. Выше температуры 13,2ºС устойчивой является β- модификация, так называемое «белое» олово (плотность 7,3 г/см3) – серебристо-белый блестящий легкоплавкий металл тетрагональной структуры с октаэдрической координацией атомов. При охлаждении ниже 13,2ºС белое олово переходит в α-модификацию (серое олово) со структурой типа алмаза (ρ = 5,8 г/см3). Этот переход сопровождается увеличением удельного объема на 25,6 %, поэтому олово рассыпается в порошок. При нагревании белого олова выше 161ºС образуется третья модификация олова – γ-форма.
Свинец – темно-серый металл с синеватым оттенком, блести на свежем срезе, легкоплавкий, очень мягкий, ковкий и пластичный. Имеет типичную для металлов структуру гранецентрированного куба. Некоторые свойства простых веществ приведены в таблице. Таким образом, закономерное изменение в строении простых веществ, проявляется в изменении их физических свойств – в ряду Ge – Sn – Pb усиливаются металлические свойства простых веществ.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 776; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.214.32 (0.006 с.) |