
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Что Вы знаете о критических эмульсиях и микроэмульсиях?
От типичных лиофобных эмульсий следует отличать так называемые критические — лиофильные эмульсии. Критические эмульсии— это системы, образующиеся обычно из двух ограниченно смешивающихся жидкостей (например, анилина и воды, изоамилового спирта и воды) при температурах, весьма близких к критической температуре смешения, когда поверхностное натяжение на границе фаз становится весьма малым (порядка 0,01 эрг/см2) и теплового движения молекул уже достаточно для диспергирования одной жидкости в другой. В результате такого самопроизвольного диспергирования образ-ся тончайшая эмульсия, в кот коалесценция отдельных капелек уравновешивается стремлением обеих ж-тей равномерно распределиться в объеме. Всякая критическая эмульсия является термодинамически устойчивой равновесной системой, для существования которой не требуется эмульгатор. Другими отличительными свойствами критической эмульсии являются возможность существования ее лишь в очень узком интервале температур и непостоянство частиц дисперсной фазы: капельки критической эмульсии все время образуются в системе и тотчас же исчезают, напоминая в этом отношении ассоциаты, образующиеся в жидкости в результате флуктуации ее плотности. Все методы получения эмульсий, как и любой другой дисперсной системы, можно разделить на конденсационные и диспергационные. Конденсационные методы связаны с образованием капелек эмульсии из отдельных молекул. Таким образом получаются критические эмульсии при выделении капель новой фазы из раствора вблизи критической температуры смешения. МИКРОЭМУЛЬСИИ, многокомпонентные жидкие коллоидные системы (микрогетерог. жидкости), характеризующиеся термодинамич. устойчивостью. Обычно прозрачны или слабо опалесцируют. Образуются самопроизвольно при смешении двух жидкостей с ограниченной взаимной р-ри-мостью (в простейшем случае при смешении воды и углеводорода) в присут. мицеллообразующих ПАВ. Как правило, система содержит также электролит и немицеллообразую-щее ПАВ (спирт, амин, эфир или др.), наз. ко-ПАВ (или со-ПАВ). Размер частиц дисп фазы (микрокапсль) составляет 10-100 нм. При изменении числа компонентов, состава или т-ры в системе происходят макроскопич. фазовые превращ., к-рые подчин фаз правилу и анализир-ся с помощью диаграмм состояния. Обычно строят "псевдотройные" диаграммы, рассматривая в качестве одного компонента углеводород (масло), в качестве другого-воду и электролит, в качестве третьего-ПАВ и ко-ПАВ.
Для многих микроэмульсий найдены критич. точки, в к-рых исчезает граница между сосуществующими фазами. О приближении к критич. точке свидетельствует резкое повышение электрич. проводимости микроэмульсий (на 4-5 порядков), увеличение размера капель и их бесконечное агрегирование (перколяция). В рамках флуктуац. теории критических явлений радиус корреляции флуктуацииконцентрации (состава системы) связан степенной зависимостью с т-рой, кол-вом солюбилизиро-ванного в микрокапле компонента,концентрацией электролита и др. Применение микроэмульсий обусловлено их способностью поглощать большие объемы воды или углеводородной жидкости, а также солюбилизировать в микрокаплях примеси и загрязнения. Перспективно использование микроэмульсий для повышения нефтеотдачи (коэф. извлечения нефти из пластов), поскольку системы типа MI (в избытке нефть) или МII (в избытке вода) характеризуются очень низкими значениями межфазного натяжения. Это позволит снизить расход ПАВ по сравнению с чисто водными дисперсиями ПАВ, закачиваемыми в пласт; кроме того, увеличивается подвижность нефти, облегчается ее отрыв от твердой породы, ускоряется слияние макрокапель нефти (коалесценция). Микроэмульсии обладают эффективным моющим и дезинфицирующим действием, являются удобной формой для диспергирования лек. ср-в, р-рителей и др., служат средой для проведения хим. р-ций. Микроэмульсии являются комплексы вода-липид-белок, к-рые участвуют в метаболизме жиров, липопротеинов и т. п. Микроэмульсии с перфторир. углеводородами-перспективные кровезаменители. Вспомните вечерние прогулки под моросящим дождем в свете фонарей. Какой коллоидно-химический эффект Вы наблюдали в данном случае? С какими свойствами коллоидных систем он связан? Для чего его можно использовать. Дайте обоснованный ответ. ЭФФЕКТ ТИНДАЛЯ (КОНУС ТИНДАЛЯ) Тиндаля эффект - свечение оптически неоднородной среды вследствие рассеяния проходящего через нее света. Обусловлен дифракцией света на отдельных частицах или элементах структурной неоднородности среды, размер которых намного меньше длины волны рассеиваемого света. Характерен для коллоидных систем (например, гидрозолей, табачного дыма) с низкой концентрацией частиц дисперсной фазы, имеющих показатель преломления, отличный от показателя преломления дисперсионной среды. Обычно наблюдается в виде светлого конуса на темном фоне (конус Тиндаля) при пропускании сфокусированного светового пучка сбоку через стеклянную кюПрименение эффекта
Основанные на Тиндаля эффекте оптические методы обнаружения, определения размера, формы и концентрации коллоидных частиц и макромолекул (ультрамикроскопия, нефелометрия широко применяются в научных исследованиях и промышленной практике). Пример. Ультрамикроскоп. Ультрамикроскоп - оптический прибор для обнаружения мельчайших (коллоидных) частиц, размеры которых меньше предела разрешения обычных световых микроскопов. Возможность обнаружения таких частиц с помощью ультрамикроскопа обусловлена дифракцией света на них Тиндаля эффектом. При сильном боковом освещении каждая частица в ультрамикроскопе отмечается наблюдателем как яркая точка (светящееся дифракционное пятно) на темном фоне. Вследствие дифракции на мельчайших частицах очень мало света, поэтому в ультрамикроскопе применяют, как правило, сильные источники света. В зависимости от интенсивности освещения, длины световой волны, разности показателей преломления частицы и среды можно обнаружить частицы размерами от 20-50 нм и до 1-5 мкм. По дифракционным пятнам нельзя определить истинные размеры, форму и структуру частиц. Ультрамикроскоп не дает оптических изображений исследуемых объектов. Однако, используя ультрамикроскоп можно установить наличие и численную концентрацию частиц, изучить их движение, а также рассчитать средний размер частиц, если известны их весовая концентрация и плотность. Ультрамикроскопы применяют при исследовании дисперсных систем, для контроля чистоты атмосферного воздуха. Воды, степени загрязнения оптически прозрачных сред посторонними включениями. 5. Изобразите формулы двух мицелл гидрозоля С, полученного из рас - творов веществ А и В в случае избытка вещества А или В. А - K2SO4, В - Ba(CH3COO)2, С - BaSO4 K2SO4 + Ba(CH3COO)2 = BaSO4 + 2CH3COOK Избыток K2SO4: Избыток Ba(CH3COO)2: 6. Для осветления воды в нее вводят Al2(SO4)3 или Fe2(SO4)3, после чего происходит интенсивное выпадение осадка. Объясните это явление, исходя из того, что частички взвеси в природной воде имеют отрицательные электрические заряды, а вводимые соли при растворении подвергаются гидролизу. В процессе очистки воды от взвешенных веществ мицеллы гидроксида алюминия или железа(образовавшиеся вследствие гидролиза их солей), несущие на своей поверхности положительный заряд, сорбируются на поверхности различных частиц, находящихся в очищаемой воде. В результате этого частицы взвеси покрываются плотным слоем частиц гидроксида алюминия или железа. Таким образом, взвешенные вещества играют роль поверхности, стимулирующей адсорбционно-коагуляционное взаимодействие, и способствуют образованию плотных агрегированных структур. Весь процесс осветления воды, начиная с образования мицелл и заканчивая их осаждением, условно можно разделить на несколько этапов. На первом этапе, после введения в воду коагулянта, происходит его гидролиз с образованием мицелл и последующим их агрегированием в более крупные шарообразные частицы золя (около 0,01–0,1мкм). Появляется опалесценция. Этот этап называется стадией скрытой коагуляции. Затем начинается этап образования огромного количества мельчайших хлопьев, которые агрегируются в более крупные, и, достигнув определенных размеров, под действием силы тяжести оседают. Наступает стадия седиментации (осаждения) хлопьев загрязнений.
Билет 10. 1. Теория броуновского движения и ее значение для естествознания Броуновское движение открыл в 1827 г. английский ботаник Роберт Броун. Броуновское движение – это непрерывное беспорядочное движение частиц микроскопических и коллоидных размеров, не затухающее во времени. Это движение тем интенсивнее, чем выше температура и чем меньше масса частицы и вязкость дисперсионной среды В общих чертах явление броуновского движения можно представить следующим образом. Если частица мала, то число одновременно получаемых ею ударов со стороны молекул среды не слишком велико и возникает вероятность неравномерного распределения импульсов, получаемых частицей с разных сторон. Это обусловлено как разным количеством ударов, так и различной энергией молекул среды, сталкивающихся с частицей. В результате взвешенные в жидкости частицы приобретают поступательное, вращательное и колебательное движение. Броуновское движение совершенно хаотично, т. е. в нем наблюдается полная равноправность всех направлений. Следовательно, броуновское движение есть случайные блуждания частиц в процессе собственного теплового движения и под влиянием теплового движения других частиц или молекул. Для количественной характеристики броуновского движения используется средний сдвиг
|
||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 450; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.210.17 (0.008 с.) |

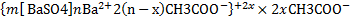
 . Сдвиг (∆) – это изменение координаты частицы за определенный промежуток времени ∆τ на произвольно выбранную в пространстве ось x, который связан с коэффициентом диффузии уравнением Эйнштейна-Смолуховского:
. Сдвиг (∆) – это изменение координаты частицы за определенный промежуток времени ∆τ на произвольно выбранную в пространстве ось x, который связан с коэффициентом диффузии уравнением Эйнштейна-Смолуховского:  , где D – коэффициент диффузии, который определяется сопротивлением, оказываемым вязкой средой движущейся в ней частице. Для сферических частиц радиуса а он равен: D = kT/6pha, где k — Больцмана постоянная, Т — абсолютное температура, h — динамическая вязкость среды. τ – время диффузии. В качестве характеристики БД используют средний квадратичный сдвиг частиц:
, где D – коэффициент диффузии, который определяется сопротивлением, оказываемым вязкой средой движущейся в ней частице. Для сферических частиц радиуса а он равен: D = kT/6pha, где k — Больцмана постоянная, Т — абсолютное температура, h — динамическая вязкость среды. τ – время диффузии. В качестве характеристики БД используют средний квадратичный сдвиг частиц: 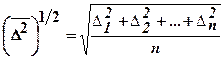 , где ∆1, ∆2, ∆n – отдельные проекции смещения частиц на ось х; n – число таких проекций, взятых для расчета.
, где ∆1, ∆2, ∆n – отдельные проекции смещения частиц на ось х; n – число таких проекций, взятых для расчета.  зависит от: температуры, вязкости среды, размера частиц. Броуновским движением пренебрегают, если размеры частиц больше 5 мкм. Теория БД подтвердила реальность существование атомов и молекул, послужила доказательством статистического характера II закона термодинамики, позволила рассчитать NA и kБ. Теория БД сыграла важную роль в обосновании статистической механики, на ней основана кинетическая теория коагуляции водных растворов. Она имеет практическое значение в метрологии, так как броуновское движение рассматривают как основной фактор, ограничивающий точность измерительных приборов. Законами броуновского движения определяется случайное движение электронов, вызывающее шумы в электрических цепях.
зависит от: температуры, вязкости среды, размера частиц. Броуновским движением пренебрегают, если размеры частиц больше 5 мкм. Теория БД подтвердила реальность существование атомов и молекул, послужила доказательством статистического характера II закона термодинамики, позволила рассчитать NA и kБ. Теория БД сыграла важную роль в обосновании статистической механики, на ней основана кинетическая теория коагуляции водных растворов. Она имеет практическое значение в метрологии, так как броуновское движение рассматривают как основной фактор, ограничивающий точность измерительных приборов. Законами броуновского движения определяется случайное движение электронов, вызывающее шумы в электрических цепях.


