
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие указания работающим в лабораторииСтр 1 из 11Следующая ⇒
Общие указания работающим в лаборатории
Прежде чем приступить к выполнению лабораторного практикума, необходимо ознакомиться с правилами работы в лаборатории и с указанными ниже мерами предосторожности при работе. 1. Осторожно обращаться с газовыми горелками. Следить за тем, чтобы краны газовых горелок были закрыты, когда горелки погашены. 2. Нагревание колб и стаканов производить на сетке, а не на голом огне. 3. Для реакций в пробирках брать минимальное количество реактивов. Избыток реактива ни в коем случае не выливать обратно в склянку. Склянки с реактивами немедленно ставить на положенное место. 4. Во избежание загрязнения реактивов склянки всегда должны быть закрыты пробками. Не допускать использования пробок от других склянок. 5. Осторожно обращаться с кислотами и щелочами. Если кислота, особенно серная или азотная, случайно попадет на руки или на платье, то следует тотчас же смыть ее водой, а затем смочить соответствующее место разбавленным аммиаком (2-3%). Щелочь также смывается водой и затем нейтрализуется 5%-ным раствором уксусной кислоты. При попадании брызг кислоты или щелочи в глаз надо немедленно промыть последний большим количеством воды. 6. При разбавлении концентрированной серной кислоты водою обязательно приливать кислоту к холодной воде тонкой струей при помешивании. Но ни в коем случае нельзя приливать воду к концентрированной серной кислоте. 7. При работе с ядовитыми или дурнопахнущими веществами (хлор, бром, сероводород, окислы азота) все опыты должны проводиться в вытяжном шкафу (под тягой).
Ведение лабораторного журнала Выполнение практикума сопровождается обязательным ведением лабораторного журнала, преследующего цель в возможно сжатой и четкой форме отразить проделанную работу. Запись в журнале рекомендуется вести по следующей схеме: 1) Номер работы и ее название. 2) Дата выполнения работы. 3) Рисунок прибора. 4) Очень краткое описание работы с приведением уравнений всех произведенных реакций и указанием наблюдавшихся при этом явлений (изменение окраски раствора, выделение газа, выпадение осадка и его цвет, условия протекания реакции и т.п.). 5) Запись (в форме таблицы) результатов производившихся наблюдений и измерений.
6) Расчет (если работа носит количественный характер) и выводы. По окончании каждой лабораторной работы (или нескольких работ) студент должен предъявить журнал преподавателю, который проверяет и подписывает работы. При сдаче зачета по лабораторному практикуму журнал представляется преподавателю, принимающему зачет.
Требования при сдаче зачета по лабораторному практикуму
Для получения зачета по лабораторному практикуму по общей химии студент должен выполнить и зафиксировать в журнале установленное число работ. Сдающий зачет должен свободно ориентироваться в материале практикума: знать способы получения и свойства изученных им в лаборатории веществ, уметь объяснить наблюдавшиеся им явления (например, гидролиз солей, амфотерность, комплексообразование и т.п.). Помимо указанного, студент должен показать приобретенные им навыки в расчетах, в составлении молекулярных и ионных уравнений и уравнений окислительно-восстановительных реакций и т.п.
Глава I ВАЖНЕЙШИЕ ОПЕРАЦИИ ПРИ ЛАБОРАТОРНЫХ РАБОТАХ НАГРЕВАНИЕ Если в лаборатории имеется проведенный светильный газ, то для нагревания обычно пользуются газовой горелкой Теклу. Горелка Теклу (рис. 1) состоит из медной трубки а, навинченной на подставку, снабженную боковой трубкой b, которая с помощью каучуковой трубки соединяется с газовым краном. В подставке имеется винт d, позволяющий регулировать приток газа в горелку и таким образом увеличивать или уменьшать пламя. Поступающий в горелку газ смешивается в трубке a с воздухом, входящим через узкую щель между конусообразно расширенным основанием трубки a и вращающимся диском c. Поворачивая диск, можно изменять ширину щели и регулировать приток воздуха в горелку. Если зажечь газ и совершенно прекратить поступление воздуха в горелку, то пламя получается светящее и слегка коптящее. При достаточном притоке воздуха пламя становится несветящим и газ горит с небольшим шумом. В большинстве случаев работают с несветящим пламенем, так как оно имеет более высокую температуру. При слишком большом притоке воздуха пламя иногда «проскакивает» внутрь горелки, т.е. газ загорается уже у отверстия подставки внутрь трубки a. В этом случае наружное пламя приобретает узкую вытянутую форму и зеленоватую окраску, и вся горелка сильно накаливается.
Если пламя проскочило, то следует тотчас же потушить горелку, закрыв газовый кран, дать горелке остыть и тогда вновь попробовать ее зажечь, уменьшив приток воздуха.
Правила пользования газовой горелкой
1. Зажигать горелку, выждав несколько секунд после открытия крана. 2. При тушении горелки закрывать кран до полной остановки. 3. Тщательно следить, чтобы кран всегда был закрыт, если горелка не горит. 4. Если пламя проскочило, тотчас закрывать кран. Нагревание веществ при химических опытах производится обыкновенно в особой «химической» посуде из тонкого стекла. Такое стекло лучше выдерживает резкие колебания температуры, чем обыкновенное толстое стекло. Рис.2 Наиболее употребительной посудой являются стеклянные пробирки, стаканы и колбы (рис. 2). Часто применяется также фарфоровая посуда в виде чашек и тиглей (рис. 3). Чтобы посуда не лопалась при нагревании, под нее подкладываются металлические сетки, покрытые асбестом, для более равномерного распределения тепла. Нагревание небольших количеств вещества производится в пробирках на голом огне, т.е. без сетки. Пробирку держат в руке слегка наклонно, двигая ее в пламени. При нагревании жидкостей не следует нагревать стенки пробирки выше уровня жидкости. Рис. 3 Для прокаливания, т.е. сильного нагревания твердых веществ, употребляют фарфоровые тигли. При нагревании их ставят на проволочные треугольники с фарфоровыми трубками и нагревают на голом огне (рис. 4). Если опыт требует продолжительного умеренного нагревания, то применяют нагревание в парах кипящей воды. Рис. 4, Рис. 5 Для этого служит так называемая водяная баня (рис. 5), представляющая собой металлическую чашку, в отверстие которой вкладывается ряд медных колец. В чашку наливают воду и кипятят ее, а нагреваемый сосуд помещают на кольца так, что дно его закрывает отверстие чашки. Иногда прибегают также к нагреванию на железной сковородке с песком, которая называется песчаной баней. Чтобы нагретое или прокаленное вещество не поглощало при охлаждении влагу из воздуха, его помещают в эксикатор. Это стеклянный сосуд (рис. 6), на дне которого находится какое-либо энергично поглощающее воду вещество, например, безводный хлористый кальций или концентрированная серная кислота. Сосуд плотно закрывается стеклянной пришлифованной крышкой, края которой смазывают вазелином.
ВЕСЫ И ВЗВЕШИВАНИЕ При выполнении работ по общей химии взвешивание производится или на аптекарских весах, или на химико-технических весах. Рис. 7. Аптекарские весы, Рис. 8. Химико-технические весы. Как те, так и другие весы состоят из коромысла, опирающегося ребром прикрепленной к нему по середине призмы на подставку или подвес. К концам коромысла подвешены (тоже на призмах) чашки. К середине коромысла прикреплена стрелка (указатель). Чтобы острые ребра призм не тупились слишком быстро, химико-технические весы снабжаются особым приспособлением – арретиром. С помощью арретира можно приподнять коромысло на то время, когда весами не пользуются, так что средняя призма не будет опираться на подставку, а чашки не будут давить своим весом на ребра крайних призм. Арретир позволяет также задерживать или совсем останавливать качания коромысла во время взвешивания.
При взвешивании пользуются следующим набором разновесок:
Из перечисленных разновесок можно составить любой вес от 0,01 до 1000 г. Самое взвешивание производится следующим образом. Взвешиваемое тело помещают на левую чашку весов, а на правую накладывают разновески, пока не будет достигнуто равновесие. О равновесии судят по одинаковому отклонению стрелки во время качаний коромысла вправо и влево от нулевого деления. Разновески необходимо класть на чашку в определенном порядке. Сперва отыскивают в наборе две рядом стоящие разновески, из которых одна легче, другая тяжелее взвешиваемого тела. Положим, что таковыми оказываются разновески в 100 и 50 г. Оставив 50 г на чашке весов, кладут рядом с ними следующую по порядку разновеску (20 г), если этого мало, то следующую и т.д., пока правая чашка не перетянет. Тогда последнюю положенную разновеску снимают, возвращают в ящик, а на ее место кладут следующую по порядку меньшего размера; если и этого много, то кладут следующую меньшую и т.д. Если нужно отвесить определенное количество вещества, например 5 г, то сперва помещают на левую чашку весов стаканчик или часовое стекло и приводят весы в равновесие, насыпая на правую чашку дроби (так называемое тарирование). Затем кладут на правую чашку 5 г, а в стаканчик вносят ложечкой отвешиваемое вещество, пока весы не придут в равновесие. При взвешивании на химико-технических весах следует каждый раз арретировать весы, перед тем как снимают разновеску или кладут новую. Положив разновеску, достаточно слегка повернуть винт арретира, чтобы уже судить по отклонению стрелки, что нужно делать дальше. Правила взвешивания 1. Не ставить на чашку весов горячих, мокрых или грязных предметов. 2. Никогда не класть взвешиваемое вещество прямо на чашку весов, а непременно на часовое стекло или в стаканчик. 3. Помещать взвешиваемый предмет на левую чашку, а разновески на правую. 4. При помещении взвешиваемого предмета на весы, а также при снимании или накладывании разновесок арретировать весы, чтобы избежать резких качаний коромысла (у аптекарских весов нужно придерживать при этом чашку руками).
5. Разновески всегда брать пинцетом, а не руками. 6. Снимая разновески с весов, не класть их на стол, а сейчас же помещать в те гнезда ящика, откуда разновески были взяты. 7. Ни в коем случае не занимать разновески из другого набора. Если взвешивающему не хватает какой-нибудь разновески, значит, он не соблюдал при накладывании их тот обязательный порядок, который был указан выше. 8. Когда достигнуто равновесие, записать найденный вес сперва по пустым гнездам в ящике, а затем проверить запись, ставя разновески на место. 9. Когда производятся два или три последовательных взвешивания в одной работе, производить их на одних и тех же весах с одним и тем же набором разновесок. 10. Не оставлять ничего на весах по окончании взвешивания.
ОЧИСТКА ТВЕРДЫХ ВЕЩЕСТВ Очистка твердых веществ от содержащихся в них примесей обыкновенно производится путем кристаллизации из растворов. Подлежащее очистке вещество растворяют в возможно малом количестве растворителя. Раствор фильтруют для удаления нерастворимых примесей и подвергают медленному испарению. По мере испарения концентрация раствора увеличивается, и после того как он сделается насыщенным, из него начинают выпадать кристаллы. Отделение образовавшихся кристаллов от маточного раствора производится фильтрованием через бумажный фильтр. Кристаллы собирают с фильтра и отжимают сухой фильтровальной бумагой.
РАБОТА №1
АТОМНО-МОЛЕКУЛЯРНАЯ ТЕОРИЯ РАСТВОРЫ Азотнокислого аммония Для работы нужны: 1)калориметр; 2)термометр с делениями до 0,1⁰; 3)маленькая фарфоровая чашечка; 4) мензурка на 100 мл; 5) стеклянная палочка с резиновым наконечником; 6) азотнокислый аммоний. Порядок выполнения работы
Концентрация растворов Учебник §76 Концентрация определяется количеством растворенного вещества, содержащегося в определенном весовом количестве или в определенном объеме раствора. В химии пользуются следующими способами выражения концентраций: 1. В весовых процентах, указывающих число граммов растворенного вещества, содержащегося в 100 граммах раствора (процентная концентрация). 2. Числом грамм-молекул (молей) растворенного вещества в 1 л раствора. Выраженная таким образом концентрация называется молярной и обозначается буквой М, перед которой ставится коэффициент, показывающий молярность раствора, т.е. число молей растворенного вещества в литре. Например: 2 М – двумолярный раствор, 0,5 М – полумолярный раствор и т.д.
3. Числом грамм-эквивалентов растворенного вещества в литре раствора. Такие растворы носят общее название нормальных растворов и обозначаются буквой «н» с соответствующим коэффициентом, указывающим нормальность раствора. Например: 1 н – нормальный раствор, 0,1 н – децинормальный раствор и т.д. 4. Титром- количеством граммов растворенного вещества в 1мл раствора. Очень часто, особенно в технике, концентрация растворов выражается через их удельный вес. Этот способ выражения концентрации основан на том, что с изменениями концентрации раствора меняется и его удельный вес. Для растворов некоторых веществ (кислот, щелочей и др.) имеются специальные таблицы, пользуясь которыми можно по удельному весу растворов находить их процентную концентрацию. Например, если удельный вес раствора серной кислоты при 18 Определение удельного веса растворов производится обычно с помощью ареометров. Ареометр представляет собою пустотелый стеклянный поплавок в виде узкой трубки с расширением на конце, наполненным дробью, благодаря чему погруженный в жидкость ареометр поддерживается в вертикальном положении (рис. 15). В верхней части трубки находится шкала с делениями, отвечающими различным значениям удельного веса. Деление, до которого ареометр погружается в жидкость, указывает удельный все этой жидкости. Имеются ареометры для жидкостей более тяжелых, чем вода, и для жидкостей, которые легче воды. У первых цифра 1, указывающая удельный вес чистой воды, ставится вверху шкалы, у вторых-внизу шкалы. Иногда в технике для определения удельного веса жидкостей пользуются ареометром Боме с условной шкалой, отмечающей так называемые градусы Боме. Чтобы перейти от градусов Боме к удельным весам, пользуются следующими формулами: d= d= где d-искомый удельный вес, а n-число градусов Боме. РАБОТА №11 Криоскопическим методом Работа производится в приборе, указанном на рис. 19. Наружный стакан заполнен охлаждающей смесью льда или снега с солью. Во внутренний стакан наливают испытуемую жидкость. Термометр погружают в жидкость настолько, чтобы шарик с ртутью полностью был закрыт жидкостью. Замораживание производится при постоянном перемешивании жидкости мешалкой. Иногда жидкость переохлаждается. Тогда в момент начала замораживания происходит скачок температуры вверх. Температурой замерзания считается та температура, которая устанавливается после такого скачка. Необходимо иметь в виду, что под температурой замерзания раствора подразумевается температура начала замерзания, так как процесс замерзания раствора, в отличие от замерзания чистых веществ, идет не при постоянной, а при постепенно понижающейся температуре. Для работы нужны: 1) прибор согласно рис. 19; 2) термометр с делениями до 0,1⁰; 3) глюкоза (или мочевина); 4) лед или снег; 5) поваренная соль технич. 1. Собрать прибор, как указано на рис. 19. 2. Налить во внутренний стаканчик 3. Повторить опыт, взяв вместо воды раствор глюкозы. Для этого налить во внутренний стаканчик точно отмеренные 40 мл дистиллированной воды и растворить в них 5 г глюкозы. 4. Определить температуру замерзания раствора. 5. Рассчитать молекулярный вес глюкозы. 6. Сравнить найденную величину молекулярного веса Моп с теоретическим значением молекулярного веса Мтеор , вычисленным по формуле глюкозы – С6Н12О6 . Определить процент ошибки: % ошибки = Глава V ИОННЫЕ УРАВНЕНИЯ. Учебник §92, 93, 97, 99 При реакциях между электролитами в растворах химическое взаимодействие происходит только между ионами растворенных веществ. Хотя большинство этих реакций принадлежит к типу так называемых реакций обмена, однако с точки зрения ионной теории сущность их заключается в соединении ионов и образовании диссоциирующих или практически нерастворимых веществ. Если из ионов, находящихся в исходных растворах, такого вещества не может образоваться, то при смешивании растворов двух электролитов вообще не произойдет никакой реакции. Таким образом, обязательным условием течения реакций обмена между электролитами является уход тех или иных ионов из раствора вследствие образования нерастворимых или слабо диссоциирующих веществ. Для записывания реакций между электролитами в растворах пользуются так называемыми ионными уравнениями, в которых труднорастворимые и малодиссоциированные вещества пишутся в виде молекул, а растворимые сильные электролиты в виде ионов, на которые они распадаются в растворе. Пример 1. При смешивании растворов хлористого кальция CaCl2 и углекислого натрия Na2CO3 происходит реакция: CaCl2 + Na2CO3 = CaCO3 + 2NaCl Так как соли CaCl2 и Na2CO3 как сильные электролиты полностью распадаются в растворе на ионы, то уравнение происходящей реакции может быть записано и в такой форме: Ca×× + 2Cl¢ + 2Na× + CO3¢¢ = ¯CaCO3 +2Na× + 2Cl¢. Из последнего уравнения видно, что химическое взаимодействие происходит только между ионами Ca×× и CO3¢¢, которые связываются друг с другом, образуя практически нерастворимый углекислый кальций СaCO3, выпадающий в виде осадка, ионы же Na× и Cl¢ как были свободными в исходных растворах, так и остались свободными после смешивания растворов, т.е. никакого участия в реакции не принимали. Исключив их из последнего уравнения, получим уравнение: Ca×× + CO¢¢3 = ¯CaCO3, совершенно точно выражающее сущность происходящей реакции. Это уравнение и называется ионным уравнением реакции. Пример 2. Реакция между едким натром и соляной кислотой (реакция нейтрализации) выражается в молекулярной форме уравнением NaOH + HCl = NaCl + H2O. Как и в предыдущем случае, растворы исходных веществ NaOH и HCl содержат только ионы этих веществ. Так как NaCl тоже сильный электролит, то при смешивании растворов связываться друг с другом будут только ионы: H× и OH¢, образуя молекулы очень слабого электролита – воды. Образование этих молекул и обусловливает течение реакции нейтрализации. Таким образом, сущность ее может быть выражена ионным уравнением: H× + OH¢ = H2O, ионы же Na× и CL¢ никакого участия в реакции не принимают, а потому и не входят в ионное уравнение. Если взятые для реакции вещества представляют собою сильные, легко растворимые электролиты, то ионное уравнение всегда имеет такой вид, как в приведенных выше примерах: в левой части указываются вступающие во взаимодействие ионы, а в правой – образующиеся из них слабо диссоциирующие или малорастворимые соединения. Несколько иной вид имеет ионное уравнение в том случае, когда одно из вступающих в реакцию веществ слабый или малорастворимый электролит. Пример 3. Реакция нейтрализации раствора слабой азотистой кислоты HNO2 раствором едкого натра. Раствор азотистой кислоты содержит молекулы HNO2, находящиеся в равновесии с очень небольшим количеством ионов H× и NO2¢, HNO2 ↔ H× + NO¢2, а в растворе едкого натра находятся ионы Na× и OH¢.
При смешивании растворов ионы OH¢ начинают связываться с ионами H× кислоты в молекулы воды, вызывая тем самым смещение указанного равновесия; диссоциация HNO2 усиливается, в раствор переходит новое количество ионов, и так процесс идет до тех пор, пока вся кислота не вступит в реакцию. В результате этого процесса, кроме образования молекул воды, освобождаются еще ионы NO2¢, бывшие до реакции связанными с ионами H× в молекулах HNO2. Хотя и здесь, как и в предыдущем случае, химическое взаимодействие происходит только между ионами, но молекулы HNO2 косвенно тоже участвуют в реакции, поставляя все новые и новые ионы H× по мере связывания последних с гидроксильными ионами. Реакция выражается ионным уравнением HNO2 + OH¢ = H2O+ NO¢2. Пример 4. Растворение осадка сульфида железа FeS в соляной кислоте. В растворе, содержащем осадок FeS и ничтожным количеством перешедших в раствор ионов Fe×× и S¢¢. FeS ↔ Fe×× + S¢¢. в осадке в растворе После прибавления к раствору соляной кислоты водородные ионы кислоты связываются с ионами S¢¢ в молекулы слабой сероводородной кислоты H2S. Уход ионов S¢¢ из раствора нарушает равновесие между ионами и осадком, вследствие чего новое количество FeS переходит в раствор, распадаясь на ионы. Осадок постепенно растворяется и в то же время освобождаются входившие в его состав ионы Fe∙∙ В ионном уравнении слева указываются молекулы FeS и ионы H∙, а справа – молекулы H2S и ионы F∙∙ Исходя из вышеизложенного, можно рекомендовать следующий прием для правильного составления ионных уравнений:
FeS + HCL → FeCl2 + H2S.
FeS + H∙ → H2S.
FeS +2H∙ = H2S + Fe∙∙.
РАБОТА №19 И солями в водных растворах Для работы нужны: 1) набор пробирок; 2)кусочки металлического цинка; 3) растворы солей: FeCl3, NaCL, CoCl2, Pb(NO3)2, BaCl2, Na2SO4, CuSO4, NiSO4, 2 н. раствор NaCH3COO; 2 н. раствор HCl. Порядок выполнения работы Опыт 1. Получение нерастворимых оснований при действии щелочей на соли.
Опыт 2. Получение нерастворимых солей.
Опыт 3. Образование слабой кислоты при взаимодействии между солью и сильной кислотой.
В первой пробирке выделение газов тотчас замедляется, свидетельствуя об уменьшении концентрации водородных ионов вследствие связывания их ионами CH3COO' в молекулы уксусной кислоты.
Опыт 4. Растворение осадков гидроокисей металлов в кислотах.
РАБОТА №20 Ионов из раствора Учебник § 95 Диссоциация электролитов, как и всякая диссоциация, является обратимым процессом. Поэтому в растворе слабого электролита, не полностью диссоциирующего на ионы, устанавливается равновесие между недиссоциированными молекулами и образовавшимися ионами. При введении в раствор слабого электролита одноименных ионов, т.е. ионов одинаковых с одним из ионов электролита, существующее в растворе равновесие нарушается и согласно принципу Ле-Шателье смещается в сторону образования недиссоциированных молекул, причем одновременно уменьшается концентрация другого иона. Если, например, к раствору слабой синильной кислоты HCN, диссоциирующей по уравнению HCN ↔ H·+ CN’, Прибавить ее соли (цианистого калия) KCN, полностью диссоциирующего на ионы, и таким образом увеличить концентрацию ионов CN, то равновесие сместится влево, концентрация недиссоциированных молекул HCN увеличится, а концентрация ионов H уменьшится. Прибавление к тому же раствору щелочи, т. е. ионов OH, связывающихся с ионами H в недиссоциированные молекулы H2O смещает равновесие вправо, вызывая диссоциацию нового количества молекул HCN и увеличение концентрации ионов CN. Для работы нужны: 1) стойка с пробирками; 2) маленькая воронка; 3) кусок фильтровальной бумаги; 4) 0,1н. растворы уксусной кислоты и аммиака; 5) метилоранж; 6) фенолфталеин; 7) 0,1 н. раствор AgNO3; 8) ацетат натрия NaCH3COO крист.; 9) хлорид аммония крист.; 10) поваренная соль. Порядок выполнения работы Опыт 1. Введение в растворы уксусной кислоты и аммиака одноименных ионов.
Оставив пробирку с водой для сравнения, всыпать во вторую пробирку щепоточку ацетата натрия NaCH3COO, полностью распадающегося в растворе на ионы Na+ и CH3COO-. Хорошенько взболтать содержимое пробирки. Вследствие увеличения концентрации ионов CH3COO- равновесие между молекулами уксусной кислоты и ее ионами смещается в сторону образования недиссоциированных молекул и концентрация ионов водорода, обусловливающих кислотные свойства раствора, настолько понижается, что метилоранж дает почти такую же окраску, как и в нейтральном растворе.
От прибавления в одну из пробирок хлорида аммония розовая окраска раствора бледнеет, так как введение в раствор ионов NH4+ смещает существующее в растворе равновесие (NH3+H2O ↔ NH4++OH-) влево, вследствие чего ионов OH- почти не остается в растворе и он утрачивает щелочные свойства.
Опыт 2. Удаление одного из ионов электролита из раствора. 1. Налить в пробирку до половины дистиллированной воды и медленно пропускать сквозь воду ток сероводорода из прибора Криппа в течении 2-3 мин. 2. К полученной сероводородной воде прибавить несколько капель метилоранжа. Вследствие ничтожной концентрации H+ ионов в сероводородной воде (степень диссоциации H2S очень мала) метилоранж дает почти такую же окраску, как и в нейтральном растворе, т.е. желтую. Разделив жидкость на 2 части, оставить одну из них для сравнения, а ко второй прибавить раствора AgNO3, предварительно убедившись с помощью того же метилоранжа, что раствор AgNO3 имеет нейтральную реакцию. Образуется черный осадок Ag2S согласно уравнению
2Ag× + H2S = ¯ Ag2S + 2H×
4. Приготовить фильтр (см. работу №1, стр. 16). Полученный фильтр вложить в воронку так, чтобы он плотно прилегал к стенкам воронки и не доходил немного до краев ее. Придерживая фильтр пальцем, смочить его водой. 5. Отфильтровать жидкость от осадка в чистую пробирку. Сравнить окраску фильтра с окраской раствора до прибавления AgNO3. Вследствие связывания ионов S² ионами Ag× и удаления их таким путем из раствора все находящиеся в растворе молекулы H2S подвергаются диссоциации; концентрация ионов H× в растворе настолько увеличивается, что последний приобретает розовую окраску, характерную для метилоранжа в кислом растворе. Опыт 3. Введение ионов Cl¢ в насыщенный раствор поваренной соли. 1. Приготовить насыщенный раствор поваренной соли, взбалтывая в пробирке с водой растертую в порошок поваренную соль до тех пор, пока она не перестанет растворяться, т. е. пока не установится равновесие между оставшейся нерастворенной солью и перешедшими в раствор ионами Na× и Cl ¢: NaCl Na × + Cl¢ твердый ® в растворе
Отфильтровав жидкость, прибавлять к прозрачному раствору по каплям концентрированную соляную кислоту. Наблюдать выделение соли из раствора вследствие увеличения концентрации ионов Cl¢ и смещения вышеуказанного равновесия влево. Закончив опыты, ответить письменно на следующие вопросы: 1. Какое равновесие существует в растворе слабого электролита? 2. Как отзывается на этом равновесии: а) введение в раствор одноименных ионов? б) удаление из раствора каких-либо ионов? 3. Что происходит при введении в насыщенный раствор электролита одноименных ионов?
РАБОТА № 21 Образование и растворение осадков Произведение растворимости. В насыщенном растворе малорастворимого электролита произведение концентрации его ионов есть величина постоянная при данной температуре. Эта величина называется произведением растворимости электролита и обозначается буквами ПР. Примечание. Концентрации ионов выражаются в грамм-ионах на литр. В тех случаях, когда при диссоциации молекулы электролита получаются два и более одинаковых ионов, концентрации этих ионов в выражении для произведения растворимости должны быть возведены в соответствующие степени. Например, произведение растворимости CaF2. ПР CaF2 = [Ca ××] × [F¢] 2 Образование осадка при смешивании растворов двух электролитов. При смешивании растворов двух электролитов, ионы которых могут образовать труднорастворимое вещество, осадок получается всякий раз как только произведение концентраций этих ионов в растворе превысит величину произведения растворимости образующегося вещества. Растворение осадков. Растворение осадка труднорастворимого электролита происходит в том случае, когда произведение концентраций его ионов в жидкости над осадком становится меньше, чем произведение растворимости электролита. Поэтому, чтобы растворить осадок, надо связывать один из посылаемых им в раствор ионов, действуя таким ионом, который образовывал бы с первым малодиссоциированное соединение. Для работы нужны: 1) стойка с пробирками; 2) колбочка на 50-100 мл; 3) маленькая воронка с фильтром; 4) 2 бюретки с точно 1 н. растворами Pb(NO3)2 и NaCl; 5) 1 н. раствор MgSO4; 6) 1н. раствор NaOH; 7) 2 н. раствор NH4Cl; 8) 0,1 н. раствор KJ; 9) мензурка на 50 мл. Опыт 1. Зависимость образования осадка PbCl2, от величины произведения концентрации ионов Pb×× и Cl¢ в растворе. 1. Смешать в пробирке приблизительно равные объемы 1 н. растворов Pb(NO3)2 и NaCl. Тотчас образуется белый осадок труднорастворимого PbCl2. Написать уравнение реакции. 2. Приготовить 20 мл 0,1 н. раствора Pb(NO3)2, отмерив из бюретки возможно точнее 2 мл 1 н. раствора Pb(NO3)2 и прибавив к нему 18 мл воды. 3. Аналогичным способом приготовить 20 мл 0,1 н. раствора NaCl и 20 мл 0,5 н. раствора NaCl. 4. Зная, что произведение растворимости PbCl2 равно 2,3▪10−4, рассчитать, получится ли осадок, если смешать: а) равные объемы 0,1 н. растворов Pb(NO3)2 и NaCl; б) равные объемы 0,1 н. раствора с и 0,5 н. раствора NaCl. Записать расчет в рабочую тетрадь. 5. Проверить результаты вычисления на опыте, отмеривая равные объемы растворов мензуркой. Опыт 2. Зависимость полноты осаждения ионов от величины произведения растворимости образующегося осадка.
Опыт 3. Растворение Mg(OH)2 при действии на него раствором NaH4Cl. 1. К 2-3 2н. раствора мл 1н. раствора Mg(OH)2 прилить равный объем 1н. раствора NaOH. Выпадает осадок Mg(OH)2.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 148; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.90.44 (0.153 с.) |
 оказался равным 1,143, то по таблице в конце книги легко установить, что этому удельному весу соответствует концентрация кислоты 20%.
оказался равным 1,143, то по таблице в конце книги легко установить, что этому удельному весу соответствует концентрация кислоты 20%. для жидкостей тяжелее воды,
для жидкостей тяжелее воды, для жидкостей легче воды,
для жидкостей легче воды,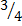 дистиллированной воды, опустить в воду термометр и укрепить его, как показано на рисунке. Перемешивать воду мешалкой до начала замерзания. Заметить показание термометра.[4]
дистиллированной воды, опустить в воду термометр и укрепить его, как показано на рисунке. Перемешивать воду мешалкой до начала замерзания. Заметить показание термометра.[4] .
.


