Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фізико-хімічні зміни м'яса під час теплового оброблення ⇐ ПредыдущаяСтр 10 из 10
Теплове оброблення м'яса і м'ясопродуктів супроводжується характерними фізико-хімічними змінами (схема 19.3).
Схема 19.3. Фізико-хімічні зміни м'яса і м'ясопродуктів під час теплового оброблення Зміна білків. Найхарактернішою та основною зміною білків усіх тканин при нагріванні є денатурація — зміна природних властивостей білків (схема 19.4), при цьому зменшується їх розчинність, гідратація. Білки, денатуровані нагріванням, легко агрегують і коагулюють, ущільнюються з виділенням води. Закономірності денатураційних перетворень білків у ізольованому вигляді істотно змінюються під час денатурації білків, що є складовими частинами структур, якими є тканини тварин. Денатуруюча дія тепла на білки м'яса залежить від багатьох чинників (температури нагрівання, тривалості теплової дії, присутності або відсутності достатньої кількості води в гріючому середовищі або самому продукті, рН середовища, взаємозв'язок між білками й іншими сполуками в структурі тканини тварин та ін.).
Схема 19.4. Денатураційні перетворення білків під час теплового оброблення. Теплова енергія витрачається на порушення структури молекули (температурний коефіцієнт денатурації 100-150 ккал/моль). При цьому енергія може витрачатися на розривання незначної кількості міцних ковалентних зв'язків і великої кількості слабких міжмолекулярних зв'язків у молекулі білка (близько 75-80% внутрішніх молекулярних зв'язків глобулярних білків становлять водневі зв'язки). Для порушення просторової конфігурації поліпептидних ланцюгів достатньо розриву 10-20% водневих зв'язків. У результаті розриву внутрішньо молекулярних зв'язків (водневих, сольових) пептидні ланцюги частково розгортаються, внаслідок чого функціональні групи (SH-групи, фенольна група тирозину, гуанідинова група аргініну, аміногрупа лізину та ін.) стають активнішими або доступнішими. Для теплової денатурації білків особливо характерне збільшення реактивності SH-груп, за величиною вмісту яких нерідко судять про глибину денатурації білка. Денатурація білків м'яса починається за низьких температур (близько 45°С). За температури 60-65°С в м'ясі денатурує близько 90% внутрішньоклітинних білків, а за 70°С денатуруються практично всі м'язові білки. Але навіть і за 100°С невелика кількість білкових речовин не втрачає розчинності (табл. 19.1).
Таблиця 19.1.Температура денатурації основних білків м'яса
Найчутливіший до нагрівання основний білок м'язів — міозин. При нагріванні до 37°С він втрачає ферментативну активність уже через 15-20 хв. У структурі м'язової тканини ця нативна властивість міозину зберігається стійкіше. Під час нагрівання протягом 3 год при 40°С ферментативна активність міозину знижується тільки на 50%, а при нагріванні понад 40°С міозин денатурує повністю. За допомогою мікрокалориметра виявлено два незалежні процеси денатурації та зміни в'язкості розчину міозину під час нагрівання. Перший має максимум при 43°С пов'язаний з перетворенням компоненту міозину ТММ, другий — максимум при 53°С — з перетворенням ЛММ. Температуру денатурації тваринних білків підвищують солі лужних металів, довголанцюгові органічні аніони (наприклад, аніони жирних кислот з числом вуглецевих атомів 7-12) та інші органічні речовини (наприклад, цукор). При варінні солоних виробів на температуру денатурації впливає кухонна сіль (збільшує її). Колаген при нагріванні до 58-65°С у вологому стані зварюється. При цьому відбувається послаблення і розривання водневих зв'язків, які утримують поліпептидні ланцюги в тривимірній структурі молекули. Як наслідок, змінюється показник рН у бік збільшення. Чим вища температура, більший ступінь подрібнення і триваліший термін нагрівання, тим більше утворюється низькомолекулярних продуктів дезагрегації колагену і глибше виражені зміни його стану (схема 19.5). Повний гідроліз колагену відбувається при нагріванні протягом 3 год за температури 120°С. Зміни колагену за теплового оброблення м'яса і м'ясопродуктів (розпад до глютину і глютоз) у певних межах відіграють позитивну роль, оскільки призводять до підвищення засвоюваності колагену і зменшення міцності сполучної тканини і жорсткості м'яса. Проте надмірний розпад колагену призводить до розволокнення тканин.
Для м'яса з невеликим вмістом сполучної тканини тривалість нагрівання не повинна бути більша за ту, яка необхідна для денатурації розчинних білків. Практично для цього досить прогріти продукт на всю глибину приблизно до 70°С. Для м'яса, що містить відносно більшу кількість сполучної тканини, стан готовності визначається ступенем розпаду колагену (20-45%).
Схема 19.5. Вплив варіння на стан і властивості колагену Білки м'яса, денатуровані в результаті теплової дії, легше піддаються ферментативному гідролізу, оскільки під час розгортання поліпептидних ланцюжків внутрішні пептидні зв'язки стають доступніші до дії ферментів, що особливо важливо для колагену. Тому денатуровані білки краще перетравлюються. У той же час тривалий період нагрівання може збільшити стійкість білків до ферментів внаслідок розвитку післяденатураційних змін. Так, тривале нагрівання за температури вище ніж 100°С (стерилізація м'яса) супроводжується деяким погіршенням переварювання білків м'яса. Під час теплового оброблення м'язової тканини дуже важливе значення мають зміни міоглобіну, від чого залежить забарвлення м'яса. Міоглобін у м'ясі денатурується поступово залежно від температури і тривалості нагрівання. За температури, близької до 70°С, починається денатурація міоглобіну. Зв'язок між гемом (простетичною групою) і глобіном (білковою частиною молекули міоглобіну) послаблюється. Глобін денатурує, а гем перетворюється на гемохром — коричневий пігмент. Денатурований глобін здатний утворювати адсорбційну сполуку з гемохромом. Гемохроми містять двовалентне залізо, яке легко може окислюватися до тривалентного з утворенням гематинів. Під час нагрівання до температури, при якій денатурує міоглобін, колір м'яса змінюється від червоного до сіро-коричневого внаслідок утворення гемохромів і гематинів. За 60°С червоне забарвлення зберігається всередині шматка м'яса, за 60-70°С м'ясо забарвлюється в рожевий колір, а за 70-80°С і вище стає значною мірою сіро-коричневим.
Зміна ліпідів. Основні зміни, що відбуваються з жиром під час нагрівання наведені на схемі 19.6.
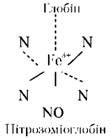
Схема 19.6. Зміна жирів під час теплового оброблення Більшість м'ясопродуктів, які піддаються тепловому обробленню, щоб уникнути змін забарвлення в процесі попереднього соління, обробляють нітритом. В процесі термічного оброблення нітрозоміоглобін перетворюється на денатурований глобін і нітрозогемохромоген, який і зумовлює рожево-червоний колір солено- варених виробів: Нагрівання м'яса супроводжується витоплюванням жиру і частковим його емульгуванням (надає каламутності бульйону). Одночасно з витоплюванням жиру вивільняються деякі леткі сполуки, пов'язані з жирами, що надає специфічного аромату м'ясу та бульйону. Тривала дія високої температури за наявності води та кисню повітря може викликати гідроліз і окислення жирів. При помірному нагріванні вони незначні, але їх легко виявити. Через приєднання гідроксильних груп за місцем подвійних зв'язків внаслідок взаємодії тригліцеридів з водою частково утворюються оксикислоти. Останні надають бульйону смаку та запаху осалювання за тривалого варіння жирного м'яса та кісток. Окислювальні зміни жирів і процеси полімеризації під час обсмажування (t > 135°С) призводять не тільки до змін кольору (жир темнішає) і погіршення запаху: при цьому можуть утворюватися шкідливі для організму речовини, погіршується засвоюваність жиру.
Нагрівання сприяє і швидшому окислювальному псуванню жирів під час зберігання, особливо свинини, що супроводжується збільшенням кількості перекисів та зростанням тіобарбітурового числа. Ліпідна фракція вареної свинини піддається швидшому окислювальному псуванню. Це пояснюється відсутністю природних антиокислювачів і тим, що до процесу окислення дуже швидко залучаються надто лабільні не фосфоліпіди а фосфоліпопротеїди. У результаті окислення фосфоліпідів утворюються леткі продукти з неприємним запахом. Зміна вітамінів. Теплове оброблення м'яса та м'ясопродуктів призводить до зменшення кількості деяких вітамінів у результаті їх хімічних змін, а також втрат у навколишнє середовище. Зміна вмісту вітамінів у м'ясі під час нагрівання залежить від їхньої стійкості до теплової дії, а також від умов оброблення м'яса, головним чином від рН і наявності кисню. Теплове оброблення м'яса і м'ясопродуктів навіть за помірних температур призводить до деякого зниження їх вітамінної цінності, а під час нагрівання вище за 100°С вітаміни значно руйнуються (40-70%). З водорозчинних вітамінів найменш стійкі вітаміни В1 і аскорбінова кислота (вітамін С), з жиророзчинних вітамінів — вітамін D. Вітамін А практично витримує температуру до 130°С, проте сухе нагрівання в контакті з повітрям, наприклад обсмажування м'ясопродуктів, супроводжується інтенсивним руйнуванням вітаміну А та інших вітамінів, особливо тих, які легко окислюються (Е, С). Зміна структурно-механічних властивостей. Стійкісні властивості тваринних тканин під дією нагрівання змінюються під впливом двох протилежно направлених чинників: коагуляції білків і розпаду колагену (схема 19.7). Чим вища температура і більше тривалість нагрівання, тим більша коагуляція і вищі стійкісні властивості продукту. З іншого боку, чим більший розпад колагену, тим менша жорсткість м'яса.
Схема 19.7. Зміна структурно-механічних властивостей під час теплового оброблення Жорсткість м'яса, яке піддавалось нагріванню, залежить не тільки від температури і тривалості цього процесу, а й від вмісту в ньому сполучної тканини, природних особливостей тварин, віку, ступеня подрібнення сполучної тканини і та ін. Для обсмажування, наприклад, придатні тільки ті ділянки туші, які містять відносно невелику кількість сполучної тканини. Колаген сполучної тканини птиці і свинини розварюється значно легше від сполучної тканини яловичини і баранини. Сполучна тканина м'яса молодих тварин розварюється швидше, ніж старих. Важливим є і співвідношення колагенових і еластинових волокон у сполучній тканині. Зварювання сполучних тканин відбувається в температурному інтервалі, верхня межа якого тим вища, чим складніша їх структура.
Швидкість і ступінь розпаду колагену різко зростають із збільшенням ступеня подрібнення. Тому нагрівання ковбасного фаршу до 70°С, достатнє для денатурації значної частини м'язових білків і переходу значної частини колагену в глютин. У зв'язку з цим варіння ковбас можна вважати закінченим, як тільки температура в центрі батона досягне 70-72°С. Стійкісні властивості тваринних тканин, які піддаються нагріванню, залежать і від ступеня зневоднення продукту. Розвиток коагуляційних змін супроводжується зменшенням водозв'язуючої здатності білкових речовин і втратою води. Звідси витікає, що і температура, і тривалість теплового оброблення м'ясопродуктів повинні бути лише мінімально необхідними відповідно до особливостей складу і властивостей продукту, який нагрівається. На втрати води продуктом істотно впливає і ступінь розвитку автолітичних процесів до моменту нагрівання. Кількість вологи, яка віділяється під час теплового оброблення, мінімальна при нагріванні парного м'яса. Вона різко збільшується для м'яса в стані повного розвитку посмертного заклякання, після чого поступово зменшується в міру дозрівання м'яса. Але навіть через 10 і більше діб вона вище, ніж при тепловому обробленні парного м'яса. Відповідно до цього м'ясо, зварене в стані посмертного заклякання, дуже жорстке, але тим ніжніше і соковитіше, чим вищий ступінь дозрівання. Вологозв'язувальну здатність м'ясопродуктів, що піддаються тепловому обробленню, можна збільшити, зрушуючи рН у той чи інший бік від ізоелектричної точки білків тваринних тканин. Цього можна досягти, додаючи до подрібненого м'яса деякі солі, наприклад фосфати, або обробляючи м'ясо органічними кислотами, наприклад оцтовою. Утворення компонентів смаку та аромату. В результаті нагрівання м'яса відбуваються складні реакції, що призводять до утворення нових продуктів, які мають смакові та ароматичні властивості. Ці речовини або вивільняються із зв'язаного стану, в якому вони перебували в м'ясі або з'являються в результаті перетворення попередників, чи утворюються внаслідок взаємодії речовин (схема 19.8). Велика роль як попередникам відводиться вуглеводам (глюкозі, рибозі, частково фруктозі), амінокислотам, нуклеотидам. В результаті взаємодії цих речовин під час нагрівання утворюються сполуки, що зумовлюють появу характерного запаху: альдегіди, кетони, леткі кислоти, сірковмісні сполуки, аміни та ін.
Вирішальну роль в утворенні смаку і аромату вареного м'яса відіграють екстрактні речовини. Ретельно відмите від розчинних у воді речовин м'ясо після варіння позбавлене смаку і має дуже слабкий запах. Екстрактивні речовини м'яса накопичуються в результаті розпаду високомолекулярних сполук, і в той же час їх кількість зменшується в результаті власного розпаду під впливом нагріву. Чутливість екстрактивних речовин до нагрівання різна. Стійкіші — карнозин, молочна кислота, холін (розпадається всього на 10-15%).
У процесі варіння частина креатину розпадається, а близько 1/3 його перетворюється на креатинін. Під час нагрівання м'ясного екстракту за 100°С протягом 6 год втрати інших сполук відбуваються з різною інтенсивністю: аргінін — 11%, аланін — 6,9, гістидин — 21,8, креатинін — 23,8, орнітин — 28,5, фенілаланін — 19,3, треонін 19,8. При цьому аспарагінова, глютамінова кислоти, карнозин, метилгістидин не руйнуються. З амінокислот необхідними для отримання м'ясного запаху є цистеїн, глютамінова кислота, пролін, гістидин. Поява глютамінової кислоти за теплової дії можлива в результаті звільнення амінокислот з білків і дезамінування глютаміну (аміду глютамінової кислоти), який міститься у м'язовій тканині в лабільному зв'язку з іншими сполуками. Можливим джерелом утворення глютамінової кислоти є і глютатіон. Під час виготовлення бульйонних кубиків для надання насиченого смаку бульйону додають глютамінову кислоту або її сіль — глютамат натрію. Зміна смаку м'яса під час нагрівання також пов'язана з утворенням гіпоксантину внаслідок розпаду інозинової кислоти. За 95°С через 1 год розпадається близько 80% інозинової кислоти. Важливе значення в утворенні аромату і частково смаку м'яса під час теплового оброблення відіграє реакція Майара — реакція взаємодії цукрів з компонентами, які містять аміногрупу, під час нагрівання. При цьому утворюються карбонільні (альдегіди, кетони, леткі кислоти), сірковмісні та інші сполуки, які зумовлюють появу характерного запаху і надання забарвлення продуктам (полімери меланоїдини). У результаті реакції Майара утворюються альдегіди — формальдегід і метилгліоксаль, а також ацетон, діацетил, фурфурол, оксиметилфурфурол, метилфурфурол та ін. Аліфатичні альдегіди утворюються з амінокислот за їх окислювального дезамінування та декарбоксилювання (реакція Штрекера) під час нагрівання. Альдегід, що утворюється при цій реакції, містить на один атом вуглецю менше, ніж початкова амінокислота. Наприклад, з лейцину утворюється ізовалеріановий альдегід, з ізолейцину — 2-метилмасляний альдегід, з метионіну — метиональ, що має м'ясний аромат, з треоніну — кетомасляна кислота, що має запах бульйону, і т. ін. З цистеїну виділяється меркаптоацетальдегід, що є дуже нестійкою сполукою. Активніше в реакції Майара беруть участь низькомолекулярні речовини, зокрема амінокислоти і моносахариди (переважно — пентоди). Тому однією з причин поліпшення аромату вареного м'яса з розвитком автолізу пов'язують з накопиченням у ньому вільних амінокислот і моносахаридів. На специфічність запаху, що утворюється під час нагрівання суміші амінокислот і цукру, впливає природа амінокислоти, а не цукру. Під час нагрівання деяких амінокислот з глюкозою за 100 і 180°С протягом години, одержано низку запахів: горілого цукру, житнього хліба, карамелевий, шоколадний, горілої кукурудзи та інших, але «м'ясний» не був одержаний. При нагріванні суміші, що складається з водних розчинів амінокислот (обов'язково з l-цистеїном), вуглеводів і ефірів ненасичених жирних кислот виникає запах, що імітує м'ясний. М'ясний аромат можна отримати при нагріванні суміші таурину і тіаміну за температури 95-220°С і додаванні цього продукту до суміші вільних амінокислот. Додавання 0,5-5% цукру підсилює м'ясний запах. Реакція меланоїдиноутворення дуже повільно відбувається в сирому м'ясі, але різко прискорюється під час нагрівання. Так, за температури 60°С вона проходить у 20 разів швидше, ніж при 37°С, але й за цієї температури швидкість її достатня. Якнайбільше її наслідки виявляються під час смаження (130-180°С). Внаслідок високої температури в зовнішньому шарі м'яса виникають процеси, в результаті яких з'являється характерне коричневе забарвлення та формується аромат і смак смаженого продукту. На відтінок аромату вареного м'яса впливають також сірководень (особливо в утворенні аромату курячого м'яса) і меркаптани. При стерилізації м'яса яловичини H2S накопичується в основному в результаті деструкції цистеїну, який входить до складу білків. Можливим джерелом утворення сульфідів є сірковмісні амінокислоти, зокрема цистин і цистеїн, а також пептид глютатіон. Додатковий аромат бульйону надають і деякі леткі сполуки, які зв'язані з жирами і вивільняються одночасно з витоплюванням жиру. Вплив на мікрофлору. Теплове оброблення м'ясних продуктів повинне забезпечувати відмирання або різке скорочення кількості вегетативної мікрофлори. Під час нагрівання до температури 70°С протягом 5-10 хв гине більша частина вегетативних форм мікроорганізмів. Проте в продукті залишаються термостійкі форми, деякі з яких здатні розвиватися за температури 80°С, нагрівання м'ясопродуктів до температури 100°С не спричинює їхнього повного знищення. До дії високих температур стійкі спорові форми мікробів. Таким чином в результаті нагрівання м'ясопродуктів до температури 6870°С відмирає 99% початкової кількості мікроорганізмів. Мікрофлора, що залишилася, на 90% представлена споровими формами. Рівень залишкової мікрофлори після закінчення термооброблення залежить головним чином від ступеня початкової мікробіологічної забрудненості сировини і матеріалів, що використовуються при виробництві м'ясопродуктів. Запитання для самоконтролю 1. Яка мета термооброблення м'ясопродуктів? Які способи термооброблення використовують під час виробництва м'ясопродуктів? 2. Які фізико-хімічні зміни відбуваються в м'ясі при термообробленні? 3. Яким змінам піддаються м'язові та сполучнотканинні білки м'яса під час термооброблення? 4. Яким змінам піддаються ліпіди й вітаміни під час термооброблення? 5. Які чинники впливають на зміну структурно-механічних властивостей м'яса під час термооброблення? 6. Які речовини беруть участь в утворенні смаку та аромату м'яса, що пройшло термооброблення? 7. Як впливає температура на мікрофлору м'яса та м'ясопродуктів?
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 285; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.31.73 (0.039 с.) |