Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стереохимия. Молекулярная структура. Атомарная (геометрическая) и электронная структура. Принцип максимального перекрывания.Стр 1 из 10Следующая ⇒
Стереохимия. Молекулярная структура. Атомарная (геометрическая) и электронная структура. Принцип максимального перекрывания.
Важным моментом в изучении строения молекул и других частиц стало изучение расположения атомов в трехмерном пространстве.
Конформации. Примеры различных конформаций. Методы изучения геометрии молекул в различных фазовых состояниях. Влияние кристаллического поля на конформации молекул. Мгновенно возникающие молекулярные структуры, образующиеся вследствие вращения вокруг простых σ-связей, называют конформациями. Их нельзя выделить ни при каких условиях. Способы графического изображения: перспективных проекций (1) ("лесопильные козлы"), боковых проекций (2) и формул Ньюмена (3).
Методы изучения геометрии молекул • В растворах наиболее часто используется метод ЯМР, ИК-спектроскопия, КР, круговой дихроизм, УФ-спектроскопия в видимой области. • В газовой фазе – микроволновая спектроскопия и дифракция электронов. • ИК-спектроскопия является одним из немногих методов, который позволяет получать одинаково детальную информацию как в растворе, так и в твердом состоянии. • Исследования химически реакци в твердых фаз придавалось до последнего времен незаслуженно мало внимание. Твердофазны реакции имею следующие достоинства. Во-первых, молекулы в кристалле обладают, как правило, одной, редко двумя определенными конформациями. Во-вторых, поскольку взаимное расположением молекул строго фиксировано (в противоположность тому, что имеет место в жидкой фазе или в растворе), то ход химической реакции в значительной степени предопределен эти расположением. Создается возможность направленноог химического синтеза. • Исследователь может, например, использовать определенное взаимное расположение молекул в кристалле, «играя» на различии структур различных полиморфных модификаци одного и того же вещества.
Геометрия молекул. Величины, определяющие геометрическую конфигурацию молекулы. Фрагменты, эквивалентные по химическому строению. Кристаллографические банки данных. О каких же параметрах идет речь, когда мы обсуждаем геометрическую структуру молекулы? • Углы между линиями, соединяющими ядра химически связанных атомов (валентные углы) • Расстояния между парами ядер химически связанных атомов (межъядерные расстояния) • Углы поворота одних групп относительно других (углы внутреннего вращения) • Многие фрагменты молекул, эквивалентные по их химическому строению, имеют приближенно одинаковую геометрическую конфигурацию независимо от молекулы, в которую они входят 5. Р. Гиллеспи и получил название теории отталкивания электронных пар валентной оболочки, так как связывает форму частицы с силами отталкивания, действующими между электронными парами, сформированными при образовании соответствующей молекулы. Чтобы определить геометрическую форму молекулы по методу Гиллеспи, необходимо знать электронные конфигурации атомов, порядок соединения этих атомов в молекуле, число s- и p-связей в образовавшейся частице. Положения: 1. На геометрическую форму молекулы основное влияние оказывает число электронных пар валентной оболочки (ЭПВО), к которым относятся электронные пары, образующие s-связи и остающиеся неподеленными. Электронные пары, образующие p-связи, не влияют на геометрию молекул.
Последовательность действий: 1) определить общее число электронных пар атома А; 2) по этому числу (n+m) − форму правильной фигуры, образуемой электронными облаками; 3) установить, сколько связывающих, несвязывающих и кратных пар; 4) определить геометрию молекулы. Приближенное описание молекулярной орбитали в методе МО ЛКАО. Минимальный базис. Расширение базиса. Достоинства и недостатки метода МО ЛКАО. Энергия корреляции электронов. Открытые и закрытые оболочки молекул. Описание молекулярной орбитали в методе МО ЛКАО Приближенное выражение для каждой МО находят как линейную комбинацию АО. Такой способ построения молекулярной волновой функции получил название метода МО ЛКАО: ψ = c1χ 1+ c2χ 2 в общем случае ψi = Σ ciχ i Минимальный набор базисных функций • ЛКАО, построенные таким образом, что в них фигурируют лишь АО основного валентного состояния, называются функциями минимального базиса.
• Для атома водорода - это 1s атомная функция, для углерода – 2s, 2px, 2py, 2pz • Для увеличения точности вычислений используются расширенные базисные наборы, при этом, однако, резко возрастает общий объем необходимых вычислений. Преимущества методов, основанных на ЛКАО Функции в форме ЛКАО отличаются наглядностью, простым физическим смыслом всех получающихся элементов и возможностью использовать различные полуэмпирические методы, базирующиеся на разумной параметризации. Эти обстоятельства делают расчетные методы, основанные на ЛКАО, весьма удобными для решения многочисленных прикладных задач, выдвигаемых химической практикой. КОРРЕЛЯЦИОННАЯ ЭНЕРГИЯ - энергия ниж. энергетич. состояния газа электронов (ферми-газа)за вычетом их ср. кинетич. энергии (ферми-энергии)и энергии обменного взаимодействия. В общем случае К. э. представляет собой разность энергии осн. состояния системы ферми-частиц и её значения, определённого в приближении Хартри - Фока Т.к. движение электронов рассматривается как взаимно независимое, даже наиболее точные расчеты, выполненные методом МО ССП, не учитывают корреляции – стремления электронов избегать друг друга. Разность истинной энергии системы и рассчитанной методом МО ССП в самом лучшем приближении называют энергией корреляции электронов (энергия корреляции частично учитывается при расчетах по методу конфигурационного взаимодействия). • Электронные оболочки молекул, в которых на каждой заселенной орбитали находятся 2 электрона с антипараллельными спинами, называют закрытыми, при наличии хотя бы одной МО, заселенной неспаренным электроном, - открытыми.
Метод ВС и метод МО – два способа нахождения молекулярной волновой функции. Сравнение методов. Три основные группы современных квантовохимических методов. УФ-излучения применяются также линии He II (40,8 эВ) и Ne I (16,8 эВ) и др. • Малая ширина атомных линий позволяет определять Ii с точностью до ± 0,01 эВ. • Измерения более высоких потенциалов ионизации, особенно связанных с отрывом электронов из внутренних оболочек, производят при помощи рентгеновского излучения (РФЭС, шведский ученый Зигбан, 1981 г. - Нобелевская премия). Энергия корреляции
• Кроме того, соблюдение соотношения Ii = - εi может осложняться тем, что фотоионизация, изменяя число электронов в молекуле, неизбежно должна менять и величину межэлектронных эффектов и, прежде всего величину корреляционной энергии (Δ Е корр), непосредственно зависимой от числа парных взаимодействий. Детальный анализ соотношений этих эффектов показал, однако, что теорема Купманса пренебрегает эффектами, сопровождающими фотоионизацию, в большинстве случаев обоснованно: эти эффекты, как правило, компенсируют друг друга Источники ошибок определения • В отличие от масс-спектрометрических методов ФЭС требует большей чистоты образца, поскольку наличие заметного количества примесей приводит к появлению дополнительных полос в спектре и затрудняет их идентификацию. • Даже свежеприготовленные образцы часто оказываются для ФЭС сильно загрязненными. Например, на воздухе металлы сразу покрываютс оксидными пленками. • Другой источник ошибок связан с трудностями расшифровки тонкой структуры полос. Для многоатомных молекул, имеющих 3N-6 колебательных степеней свободы (N – число атомов), интерпретация колебательной структуры ФЭС бывает затруднена, хотя из нее возможно все-таки получить в некоторых случаях информацию как о колебательных частотах и структуре ионизованной молекулы, так и о характере МО исходной молекулы. Вследствие этого в ряде случаев говорят лишь о пороговом значении ПИ, не конкретизируя его вид (вертикальный или адиабатический). Химический сдвиг В химических исследованиях с применением методов рентгено- и фотоэлектронной спектроскопии интерес чаще всего представляет не абсолютное значение энергии связи, а ее изменение для данного электронного уровня атома одного и того же элемента в разных соединениях: ΔЕсв = Еобр - Еэтал Разность энергии связи некоторого электронного уровня в исследуемом соединении (образце) и веществе сравнения (эталоне) называют химическим сдвигом • В качестве эталона выбирают или простое вещество данного элемента, или какое-то другое специально оговоренное вещество сравнения, содержащее атомы данного элемента (например, NaCl – для определения химических сдвигов уровней атома Cl в его соединениях) • На анализе значений химических сдвигов и основаны применения методов ФЭС и РФЭС для элементного анализа, идентификации соединений, структурно-группового анализа, количественного определения состава поверхностных слоев. • Эти методы стали с успехом применяться при изучении механизмов адсорбции, каталитического действия, в микроэлектронике. Нежесткие молекулы Значение временного фактора для определения структуры молекул, а следовательно, и для обнаружения изомерии было осознано лишь недавно в связи с рассмотрением молекул как нежестких структур. Если перестановка ядер в молекуле, приводящая к неидентичному изомеру, происходит за время, большее, чем характеристическое время данного экспериментального метода, то в принципе возможно различить отдельные изомерные формы.
Ясно, что введенное таким образом понятие нежесткости связано с используемым физическим методом – скорость процесса перестановки ядер определяется относительно характеристического времени для этого метода. Необходимо отметить, что временной фактор, введенный в определение химической изомерии, обеспечивает лишь принципиальную возможность обнаружить экспериментально соответствующий изомер, но не изолировать его. Для этой задачи необходимо уже принимать во внимание величину разделяющих изомеры энергетических барьеров.
Изомерия скелета
Изомерия положения
Структурные изомеры, отличающиеся природой функциональной группы, образуют класс изомерии функциональной группы • Стандартный пример – диметиловый эфир (CH3)2O и этиловый спирт C2H5OH • Для только что рассмотренных видов структурной изомерии взаимное превращение изомеров друг в друга при обычных условиях отсутствует. Особым случаем изомерии функциональной группы является таутомерия.
Структурная изомерия — результат различий в химическом строении. К этому типу относят: Изомерия углеродной цепи (углеродного скелета)
Валентная — особый вид структурной изомерии, при которой изомеры можно перевести друг в друга лишь за счёт перераспределения связей. Например, валентными изомерами бензола (V) являются бицикло[2.2.0]гекса-2,5-диен (VI, «бензол Дьюара»), призман (VII, «бензол Ладенбурга»),бензвален (VIII). Изомерия функциональной группы (межклассовая изомерия. Различается характером функциональной группы; например, этанол (CH3—CH2—OH) и диметиловый эфир (CH3—O—CH3). Изомерия положения. Тип структурной изомерии, характеризующийся различием положения одинаковых функциональных групп или кратных связей при одинаковом углеродном скелете. Пример: 2-хлорбутановая кислота и 4-хлорбутановая кислота. Пространственная изомерия. Включает в себя: а). поворотную (конформационную) б). геометрическую (цис-транс) в). оптическую
Термин «таутомерия» употребляется в тех случаях, когда изомеры, различающиеся функциональными группами, легко переходят друг в друга вследствие внутримолекулярных перегруппировок. Таутомерия – явление равновесной динамической изомерии, при которой происходит быстрое превращение структурных изомеров, сопровождаемое миграцией подвижной группы между двумя или несколькими центрами в молекуле. Таутомерия свойственна соединениям, в молекулах которых имеются разные реакционноспособные группировки. Если таутомерия связана с переносом атома водорода, то говорят о прототропной таутомерии, в случае переноса аниона – об анионотропной таутомерии. Анионотропная таутомерия- таутомерия, когда атомы или группы атомов мигрируют в виде анионов. наблюдается в ряду аллилгало-генидов, аллиловых спиртов и их производных Наиболее распространена прототропная таутомерия.
В отличии от кето-енольной таутомерии (миграции атома водорода между атомами С и О) перемещения протона между атомами кислорода в енол-енольных превращениях чрезвычайно быстры. За секунду атом водорода успевает 1011-13 раз переместиться от одного атома О к другому и обратно. Регистрировать столь быстрые обратимые изменения структуры стало возможным только тогда, когда были разработаны методы ФЭС и РФЭС, временное разрешение которых равно 10-15 с, поэтому в соответствующих спектрах наблюдаются разные сигналы, например от атомов О гидроксильной и карбонильной групп гидроксифеналенона. Аллогональная изомерия • Комплексные соединения могут существовать в виде различных многогранников, переходящих друг в друга в зависимости от условий. В водном растворе это соединение (комплекс с ионом [Mo(CN)8]4-) представляет собой квадратную антипризму, а в твердом состоянии – додекаэдр.
Спиновые изомеры Это координационные соединения, у которых в зависимости от температуры или иных факторов изменяется лишь число неспаренных электронов, тогда как все остальное (стехиометрический состав, лиганды, их взаимное расположение, даже геометрия координационного многогранника) одинаково.
Изомер хелата железа, содержащий один неспаренный электрон, существует при низкой температуре (< 270 К), а с 5 такими электронами – при высокой. Окраской эти изомеры также отличаются, т.к. набор разрешенных электронных переходов, ответственных за цвет в видимой области спектра, у них резко различен.
Оптические изомеры или энантиомеры – частный случай стереоизомеров. Особенности строения хиральных молекул. Признаки хиральности. Однозначный критерий хиральности. Проблема хиральности. Хиральность и экологическая безопасность. Луи Пастер, 1850 г.; при кристаллизации натрий-аммониевой соли виноградной кислоты из водного раствора. Он сумел под лупой с помощью пинцета разделить два типа кристаллов, различающихся ориентацией одной из граней. Водные растворы двух типов кристаллов отличались только тем, что по разному вращали плоскость поляризации (плоскость колебаний) световых волн (дисперсия оптического вращения). Различная оптическая активность. Нанохимия. Наночастицы. Свойства наночастиц. Классификация частиц по размерам и числу атомов. Наночастицы и понятие фазы. Размерные эффекты в нанохимии. Методы исследования наночастиц. Наноструктуры. Нанотрубки. Наночастицы на основе углерода. · Можно сказать, что XVIII век был веком атомов, XIX – веком соединений, XX век – веком реакций, а XXI век уже есть и будет в дальнейшем веком нанонаук и нанотехнологий. · «Нанотехнологии – это новое название, которое придумали для химии». Р. Хофман (Нобелевский лауреат 1081 г. Совместно с Фукуи) Свойства нанообъектов На многих объектах в химии, физике и биологии показано, что переход на наноуровень приводит к появлению качественных изменений физико-химических свойств отдельных соединений и получаемых на их основе систем. Речь идет об электропроводности, магнитных и оптических свойствах, прочности, термостойкости. Более того, согласно наблюдениям новые материалы, получаемые с использованием нанотехнологий, значительно превосходят по своим физическим, механическим, термическим и оптическим свойствам аналоги микрометрического масштаба. - Основные причины появления новых свойств или более ярко выраженных свойств – относительное увеличение поверхности частицы и явное проявление квантовых эффектов: туннелирования и интерференции электронных состояний. Именно эти свойства играют ключевую роль в процессах, происходящих в наночастицах, и в работе устройств на их основе.
Нанохимия Частицы, например, металлов размером ≤ 1 нм содержат около 10 атомов, которые формируют поверхностную частицу, не имеющую объема и обладающую высокой химической активностью. Физико-химические свойства начинают описывать количеством атомов.
Нанохимия – это область, исследующая получение, строение, свойства и реакционную способность частиц и сформированных из них ансамблей, которые по крайней мере в одном измерении имеют размер ≤ 10 нм.
• Появляется представление о размерных эффектах, свойства зависят от количества атомов или молекул в частице. Размерные эффекты – это новое поведение, зависящее от размера частиц. • Так, например, наблюдаются изменения электронной структуры, проводимости, реакционной способности, температуры плавления и механических характеристик при размерах частиц менее критических. • Зависимость поведения от размеров частиц позволяет создавать материалы с новыми свойствами из тех же исходных атомов. • Наночастицы можно рассматривать как промежуточные образования между отдельными атомами с одной стороны, и твердым телом – с другой. Важно расположение атомов внутри структуры, формируемой из наночастиц. Понятие фазы выражено менее четко. В нанохимии возникают вопросы, связанные с терминологией. 7-я Международная конференция по наноструктурным материалам (г. Висбаден, 2004) предложила следующую их классификацию: - нанопористые твердые вещества - наночастицы - нанотрубки и нановолокна - нанодисперсии - наноструктурные поверхности и пленки - нанокристаллические материалы
Нанокластеры золота • В качестве примера можно рассмотреть возникновение каталитической активности кластеров золота с размерами 3–5 нм, в то время как массивное золото не активно. Так, нанокластеры золота, нанесенные на подложку из оксида алюминия, эффективно катализируют окисление СО при низких температурах до –70 °С, а также обладают высокой избирательностью в реакциях восстановления оксидов азота при комнатной температуре. Подобные катализаторы эффективны для устранения запахов в закрытых помещениях. В США в ближайшем будущем ожидается коммерческое производство нанокластеров оксидов металлов для обеззараживания боевых отравляющих веществ, для защиты армии и населения при нападении террористов, а также высокопористых нанокомпозитов в виде таблеток или гранул для очистки и дезинфекции воздуха, например, в самолетах, казармах и т.д.
Полимерные нановолокна • Широкое распространение получает изготовление полимерных нановолокон диаметром менее 100 нм. Эти волокна используют для изготовления так называемой активной одежды, которая способствует самозаживлению ран и обеспечивает диагностику состояний с восприятием команд извне, т.е. работает также в режиме сенсора. Биоактивные фильтры На основе нановолокон создаются биоактивные фильтры. Так, американские фирмы Argonide и NanoCeram наладили выпуск волокон диаметром 2 нм и длиной 10–100 нм из минерала бемита (AlOOH). Благодаря большому количеству гидроксильных групп эти волокна, объединенные в более крупные агрегаты, активно сорбируют отрицательно заряженные бактерии, вирусы, различного рода неорганические и органические фрагменты и обеспечивают тем самым эффективную очистку воды, а также стерилизацию медицинских сывороток и биологических сред.
Метод получения макроскопических количеств фуллеренов. Свойства фуллеренов. Химическая стабильность четных и нечетных структур. Правила стабилизации. ИК-, КР-спектры фуллеренов и их электронные спектры поглощения. Окисление фуллеренов. Частично радикальный характер молекул фуллеренов. Химическая связь в объемных карбофуллеренах. Главные факторы, определяющие особенности связи в каркасных и циклических структурах. Псевдоароматичность. Соединения включения. Метод получения Интенсивно свойства фуллеренов стали изучаться только после разработки в 1990 г. Кречмером простого и эффективного метода получения граммовых (макроскопических) количеств фуллеренов. Основой метода является использование дугового электрического разряда с графитовыми электродами в атмосфере инертного газа. В результате в массе полученной «сажи» выход фуллеренов ~ 15%. Свойства фуллеренов и ИК-, КР-спектры фуллеренов и их электронные спектры поглощения. Важнейшими структурно-энергетическими характеристиками соединения являются его колебательные и электронные спектры (а-гексан,б-бензол). Наиболее интенсивны линии фуллеренов С60 и С70, что свидетельствует о наибольшей их устойчивости.
• Вследствие очень высокой симметрии С60 в его ИК-спектрах проявляются только 4 сильные линии. Спектр КР более богат и содержит 10 частот. • Наличие развитого спектра поглощения в видимой области (что делает эти растворы окрашенными) делает его похожим на спектры органических красителей. • Электронные спектры поглощения фуллеренов в УФ- и видимой области (200-800 нм) используются в аналитических целях при получении, разделении и очистке фуллеренов. • Фуллерены обладают и люминесценцией, но с очень низким квантовым выходом.
Химическая стабильность четных и нечетных структур Результаты исследований процессов с участием фуллеренов свидетельствует об их аномально высокой стабильности. Причем, стабильность кластеров с четными значениями атомов углерода n значительно превышает стабильность кластеров с нечетными значениями n. У кластеров С - n (n -нечетное) наиболее вероятно отщепление атома углерода, поэтому доля кластеров с нечетными n не превышает 1 %. Как показывают эксперименты, твердый фуллерен С-60 без разложения сублимируется при 400 ° С. Правила стабилизации полиэдрических структур Моделирование электронного строения таких структур привело к ряда правил, необходимых для их стабилизации: • Стабильные кластеры углерода имеют вид полиэдров, в которых каждый атом углерода имеет координационное число 3. • Более стабильны карбополиэдры, содержащие только пяти- и шестичленные циклы. • Более симметричные кластеры углерода – стабильнее. • Пятичленные циклы в полиэдрах должны быть изолированными. Форма карбополиэдра должна быть сферической Окисление кислородом Фуллерен реагирует с кислородом только при облучении, причем первоначально образуется триплетное состояние С60, перенос энергии от которого к О2 приводит к образованию синглетного кислорода 1О2, непосредственно реагирующему с фуллереном. Одно из направлений реакций приводит к оксидам С60О и С70О.
Химическая связь в объемных карбофуллеренах Если построить карту распределения электронной плотности, то можно увидеть, что эта плотность заметно выше внутри сферы, чем вне ее. В результате и создается направленная к центру стягивающая электронно-ядерная сила. Такая ситуация вообще должна быть характерна для каркасных молекул. Увеличение электронной плотности внутри сферы объясняется кривизной поверхности. Сферические фуллерены представляют собой класс соединений, само существование которых целиком определяется только объемными π – составляющими расположенного внутри сферы электронного облака. Понятие ароматичности, выработанное для классических сопряженных молекул вряд ли стоит распространять на молекулы типа фуллерена. Если же нужно подчеркнуть образование единой ρ-электронной делокализованной системы (аналог π-системы), лучше пользоваться термином «псевдоароматичность».
Что касается фуллеренов, то в настоящее время стало ясно, что именно модифицированные фуллерены, т.е. фуллерены с различными функциональными группами наиболее перспективны для создания новых материалов. Фуллерен С60, обладая высокой электроотрицательностью, легко образует комплексы с переносом заряда, где выступает акцептором электронов. В системах, состоящих из фуллерена в качестве акцептора, ковалентно связанного с фотоактивным донором, происходит фотоиндуцированный электронный переход. Частично радикальный характер молекул фуллеренов Химическая активность молекул фуллерена связана с частично радикальным характером этих молекул, обусловленным наличием эффективно не спаренных электронов. Псевдоароматичность. (Замещенные фуллерены) Фуллерены сочетают в себе свойства диенов и ароматических колец. Присоединение функциональных групп по двойным связям преобразует электронную структуру фуллерена. Простейшим замещенным фуллереном является С60Нn, при этом наблюдаются формы С60Н2, С60Н4, С60Н18 и С60Н36. Однако гидриды фуллеренов отличаются низкой устойчивостью. Гораздо большей устойчивостью, а потому и применимостью для создания материалов на их основе, обладают галогениды фуллеренов, устойчивость которых нарастает в ряду: С60Ix, С60Clx, С60Brx, С60Fx. Галогензамещенные производные фуллеренов: Получены фторфуллерены С60FX, С70FX, где X- только чётное число. Увеличение содержания фтора на поверхности фуллерена приводит к снижению энергии связи C-F в связи с нарастанием стерических напряжений в высокофторированных фуллеренах. К наиболее стабильным фуллеренам относится С60F18, из которого выращены молекулярные кристаллы и определена их структура Соединения включения: в 1985 г. - первый эндоэдральный фуллерен LaС60 • Было проведено лазерное испарение графита низкой плотности, вымоченного в водном растворе LaCl3. С помощью лазерной фрагментации было доказано, что атомы входят во внутреннюю полость фуллерена. • Далее были получены эндоэдральные металлофуллерены, содержащие атомы щелочных металлов K и Cs. При таком изменении структуры меняются электронные свойства фуллерена. Энергия ионизации эндоэдрального фуллерена становится заметно меньше, а сродство к электрону, несмотря на отрицательный заряд на углеродном каркасе, больше, чем у полого аналога фуллерена. Действительно, эксперименты на эндоэдральных фуллеренах свидетельствуют о том, что они легче отдают и принимают электрон, чем простые фуллерены. Что касается фуллеренов, то в настоящее время стало ясно, что именно модифицированные фуллерены, т.е. фуллерены с различными функциональными группами наиболее перспективны для создания новых материалов. Фуллерен С60, обладая высокой электроотрицательностью, легко образует комплексы с переносом заряда, где выступает акцептором электронов. В системах, состоящих из фуллерена в качестве акцептора, ковалентно связанного с фотоактивным донором, происходит фотоиндуцированный электронный переход. Фуллерены с азотсодержащими лигандами использованы для создания солнечных батарей. Для медицинских применений необходимы водорастворимые фуллерены – фуллеренолы С60Оy(OH)x. Дополнительно Сольватохромия фуллеренов Растворы фуллеренов обладают сольватохромией, что свидетельствует о проявлении межмолекулярных взаимодействий (ММВ) не только специфического характера (что свойственно замещенным фуллеренам), но и универсальной природы. Это касается, прежде всего, фуллеренов эллипсоидного типа (С70, С84) и их производных. Фуллерен в атмосфере аргона • Молекула С60 стабильна в инертной атмосфере аргона вплоть до температур порядка 1700 К, но в присутствии кислорода при 500 К наблюдается её значительное окисление с образованием СО и СО2 • Молекулы фуллеренов являются трёхмерными аналогами ароматических структур. Супрамолекулярная химия. Супрамолекулярные системы и их свойства. Структурные единицы супрамолекулы. Типы взаимодействий между компонентами супрамолекул. Основной признак супрамолекулы. Типы молекулярных устройств. Точно также как взаимодействие атомов химических элементов приводит к образованию различных молекул, так и взаимодействие молекулярных компонентов может приводить к образованию супрамолекулярных структур – супрамолекул. Супрамолекулярная химия – «химия за пределами молекулы». Ее цель – достижение контроля над межмолекулярными нековалентными взаимодействиями. (Молекулярная химия управляет ковалентными связями!!!) Супрамолекулярная химия имеет дело с более сложными образованиями, чем отдельные молекулы, - супрамолекулярными ансамблями, удерживаемыми вместе межмолекулярными связывающими взаимодействиями. Схема перехода от молекулярной химии к супрамолекулярной
Структурные единицы супрамолекулы
|
||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 730; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.161.77 (0.217 с.) |
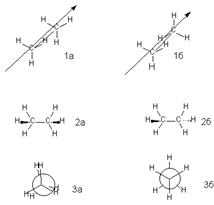 Заслоненная, заторможенная конформации.
Заслоненная, заторможенная конформации.