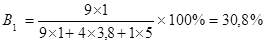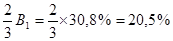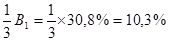Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Галогенохідні вуглеводневих радикалів ⇐ ПредыдущаяСтр 3 из 3
Література: [1 с.281-308, 631-642].
Приклад. Встановлено, що при хлоруванні алканів при температурі 20оС з урахуванням фактору ймовірності відносна швидкість заміщення атома водню змінюється в порядку: третинний > вторинний> первинний і складає (на один атом водню) 5,0:3,8:1. Використовуючи ці дані, передбачте вихід первинних, вторинних, третинних хлорпохідних і дайте назву усім ізомерам, що утворяться при монохлоруванні ізобутану.
Розв’язання. В алканів реакції хлорування проходять за радикальним механізмом, причому найлегше вони відбуваються біля найменш гідрогенізованого атому карбону. Це пояснюється тим, що міцність зв’язку С-Н біля такого атому найменша, а стабільність радикала, що утворюється – найбільша. Для розрахунку виходу різних галогенпохідних використовують такі формули:
де В1, В2, В3 – вихід моногалогенпохідних з галогеном відповідно біля первинного, вторинного і третинного атомів карбону; а,в,с – кількість атомів гідрогену відповідно біля первинних, вторинних і третинних атомів; С1, С2, С3 – відносна швидкість заміщення водню на галоген відповідно біля первинного, вторинного і третинного атомів. Таким чином, для того щоб знайти вихід кожної галогенпохідної необхідно визначити кількість атомів гідрогену біля кожного типу атомів карбону. I III II II I В молекулі ізогексану: СН3 – СН – СН2 – СН2 – СН3 │I СН3 три первинних, два вторинних і один третинний атом карбону. Біля кожного первинного атому карбону знаходиться по три атоми гідрогену, тому загальна кількість атомів гідрогену біля первинних атомів карбону: а = 3 х 3 = 9 атомів. Біля кожного вторинного – по два атоми гідрогену: в = 2 х 2 = 4. Біля третинного – один атом гідрогену: с = 1 х 1 = 1. Підставивши ці значення в наведені вище формули отримаємо:
Вихід первинних монохлорпохідних – 30,8 %; вторинних – 52,1%; третинних – 17,1 %. В процесі монохлорування ізопентану утворюється три ізомери первинних монохлорпохідних (заміщення гідрогену на хлор відбувається біля кожного з трьох первинних атомів карбону):
1) 2) 3) СН2 – СН – СН2 – СН2 – СН3 СН3 – СН – СН2 – СН2 – СН3 СН2 – СН – СН2 – СН2 – СН2 │ │ │ │ │ Cl СН3 Cl – СН2 СН3 Cl причому ізомер (1) ідентичний ізомеру (2) – це 2-метил-1-хлорпентан. Ізомер (3) має назву 2-метил-5-хлорпентан. Виходячи з того, що 2-метил-1-хлорпентан утворюється біля двох атомів карбону, вихід його буде в двічі більший, ніж 2-метил-5-хлорпентану. Тому з 30,8% продуктів реакції, що приходяться на первинні галогенпохідні 2/3 – 2-метил-1-хлорпентан і 1/3 – 2-метил-5-хлорпентан.
В молекулі ізогексану 2 вторинних атоми карбону, тому утворюється 2 ізомери вторинних монохлорпохідних: 1) 2) СН3 – СН – СН – СН2 – СН3 СН3 – СН – СН2 – СН – СН3 │ │ │ │ СН3 Cl СН3 Cl 2-метил-3-хлорпентан 2-метил-4-хлрпентан ймовірність утворення цих ізомерів однакова, тому з 52,1% продуктів половина – 2-метил-3-хлорпентан; половина – 2-метил-4-хлорпентан. Біля одного третинного атому карбону утворюється одна третинна монохлорпохідна: Cl │ СН3 – С – СН – СН2 – СН3 │ СН3 2-метил-2-хлорпентан і її вихід складає 17,1%. Таким чином в процесі монохлорування ізогексану утворюється 5 ізомерів: 1. 2 -метил-1-хлорпентан; вихід = 2. 2-метил-5-хлорпентан; вихід = 3. 2-метил-3-хлорпентан; вихід = 4. 2-метил-4-хлорпентан; вихід = 5. 2-метил-2-хлорпентан; вихід =
Завдання для самостійного розв’язування
Встановлено, що при хлоруванні алканів при температурі 20оС з урахуванням фактору ймовірності відносна швидкість заміщення атома водню змінюється в порядку: третинний > вторинний> первинний і складає (на один атом водню) 5,0:3,8:1. Використовуючи ці дані, назвіть і передбачте вихід всіх ізомерів первинних, вторинних і третинних хлорпохідних при монохлоруванні 28. Ізобутану; 29. 2-метилпентану; 30. 3-метилгексану; 31. 2,2-диметилпентану; 32. 2,4-диметилпентану; 33. 2-метилпропану; 34. 2,2-диметилпропану; 35. 2,3-диметилбутану; 36. 2,5-диметилгексану; 37. 3-етилпентану; 38. Пропану; 39. Бутану; 40. Пентану; 41. Гексану; 42. Ізопентану; 43. 2,2,3-триметилбутану; 44. Неогексану; 45. 2,3-диметилпентану; 46. 2,2,4-триметилпентану; 47. 2,2,3,4-тетраметилпентану.
СПИРТИ Література: [1 стор.309-340, 684-711].
Приклад 1. 1. Вкажіть правильну схему синтезу. Напишіть усі необхідні реакції.
+H+ +Br2 Alc KOH +Br2 AlcKOH A) бутанол → (A) → (B) → (C) → (D) → бутин-2 -H2O -HBr -2HBr
+H+ +HBr Alc KOH +Br2 AlcKOH
B) бутанол → (A) → (B) → (C) → (D) → бутин-2 -H2O -HBr -2HBr
+HBr Alc KOH +HBr Alc KOH [О] C) бутанол → (A) → (B) → (C) → (D) → бутин-2 -H2O -HBr -HBr (за Вагнером)
Розв’язання. Для виконання цього завдання необхідно використати не тільки знання хімічних властивостей спиртів, а і інших класів органічних сполук. Розглянемо послідовно кожен з ланцюжків реакцій: +H+ +Br2 Alc KOH +Br2 AlcKOH A) бутанол → (A) → (B) → (C) → (D) → бутин-2 -H2O -HBr -2HBr
В присутності кислоти (+H+) від спирту відщеплюється вода за правилом Зайцева (атом гідрогену відщеплюється від найменш гідрогенізованого атому карбону) з утворенням алкену: +H+ СН3–СН2–СН2–СН2ОН → СН3–СН2–СН=СН2 (А) бутанол -H2O бутен-1
Взаємодія алкену з Br2 приводить до приєднання брому по подвійному зв’язку з утворенням дибромпохідної: +Br2 СН3–СН2–СН=СН2 → СН3–СН2–СНBr –СН2Br (В) бутен-1 1,2-дибромбутан
В спиртовому розчині лугів галогенпохідні відщеплюють HBr за правилом Зайцева з утворенням ненасичених вуглеводнів. Якщо відщеплюється одна молекула HBr (як це зазначено в умовах реакції), то утворюється сполука з подвійним зв’язком: Alc KOH СН3–СН2–СНBr –СН2Br → СН3–СН2–СBr=СН2 (С) 1,2-дибромбутан -НBr 2-бромбутен-1
Взаємодія бромалкену з Br2 приводить до приєднання брому по подвійному зв’язку з утворенням трибромпохідної: +Br2 СН3–СН2–СBr=СН2 → СН3–СН2–СBr2 –СН2Br (D) 2-бромбутен-1 1,2,2-трибромбутан
В спиртовому розчині лугів галогенпохідні відщеплюють HBr за правилом Зайцева з утворенням ненасичених вуглеводнів. Якщо відщеплюються дві молекули HBr (як це зазначено в умовах реакції), то утворюється сполука з потрійним зв’язком: Alc KOH Alc KOH СН3–СН2–СBr2 –СН2Br → СН3–СН2–СBr=СНBr → СН3–СН2–С≡СBr 1,2,2-трибромбутан -НBr 1,2 - дибромбутен-1 -НBr 1-бромбутин-1
Таким чином ланцюжок перетворень (А) не дає можливості отримати необхідну речовину – бутин-2. +H+ +HBr Alc KOH +Br2 AlcKOH B) бутанол → (A) → (B) → (C) → (D) → бутин-2 -H2O -HBr -2HBr
В присутності кислоти (+H+) від спирту відщеплюється вода за правилом Зайцева з утворенням алкену: +H+ СН3–СН2–СН2–СН2ОН → СН3–СН2–СН=СН2 (А) бутанол -H2O бутен-1
Взаємодія алкену з НBr приводить до приєднання НBr по подвійному зв’язку за правилом Марковникова з утворенням бромпохідної: +НBr СН3–СН2–СН=СН2 → СН3–СН2–СНBr –СН3 (В) бутен-1 2-бромбутан В спиртовому розчині лугів моногалогенпохідні відщеплюють HBr за правилом Зайцева з утворенням ненасичених вуглеводнів. Alc KOH СН3–СН2–СНBr –СН3 → СН3–СН=СН–СН2 (С) 2-бромбутан -НBr бутен-2 Взаємодія алкену з Br2 призводить до приєднання брому по подвійному зв’язку з утворенням дибромпохідної: +Br2 СН3–СН=СН–СН2 → СН3–СНBr–СНBr–СН3 (D) бутен-2 2,3-дибромбутан
В спиртовому розчині лугів галогенпохідні відщеплюють HBr за правилом Зайцева з утворенням ненасичених вуглеводнів. Якщо відщеплюється дві молекули HBr (як це зазначено в умовах реакції). то утворюється сполука з потрійним зв’язком: Alc KOH Alc KOH СН3–СНBr–СНBr–СН3 → СН3–СН=СBr– СН3 → СН3–С≡С–СН3 2,3-дибромбутан -НBr 2-дибромбутен-2 -НBr бутин-2
Таким чином ланцюжок перетворень (В) дає можливість отримати необхідну речовину – бутин-2.
+HBr Alc KOH +HBr Alc KOH [О] C) бутанол → (A) → (B) → (C) → (D) → бутин-2 -H2O -HBr -HBr (за Вагнером)
В результаті взаємодії спиртів з галогеноводнями відбувається заміщення ОН-групи на галоген:
+HBr СН3–СН2–СН2–СН2ОН → СН3–СН2–СН2–СН2Br (А) бутанол -H2O 1-бромбутан
В спиртовому розчині лугів моногалогенпохідні відщеплюють HBr за правилом Зайцева з утворенням ненасичених вуглеводнів. Alc KOH СН3–СН2–СН2–СН2Br → СН3–СН2–СН=СН2 (В) 1-бромбутан -НBr бутен-1
Взаємодія алкену з НBr призводить до приєднання НBr по подвійному зв’язку за правилом Марковникова з утворенням бромпохідної: +НBr СН3–СН2–СН=СН2 → СН3–СН2–СНBr –СН3 (С) бутен-1 2-бромбутан
В спиртовому розчині лугів моногалогенпохідні відщеплюють HBr за правилом Зайцева з утворенням ненасичених вуглеводнів. Alc KOH СН3–СН2–СНBr –СН3 → СН3–СН=СН–СН3 (D) 2-бромбутан -НBr бутен-2 Реакція за Вагнером полягає в м’якому окисненні алкену до двоатомного спирту (гліколю) розбавленим розчином КМnO4 у нейтральному або слаболужному середовищі. При цьому знебарвлюється рожевий розчин КМnO4 і випадає коричневий осад оксиду марганцю (IV): СН3–СН=СН–СН3 + КМnO4 + Н2O → бутен-2 СН3–СН–СН–СН3 + 2КОН + 2МnO2 │ │ ОН ОН Бутандіол
Таким чином ланцюжок перетворень (С) не дає можливості отримати необхідну речовину – бутин-2. Завдання для самостійного розв’язування
Вкажіть правильну схему синтезу. Напишіть усі необхідні реакції.
161. KOH +Br2 Alc KOH A) 4-бром-2,3-диметилпентан → (A) → (B) → 2,3-диметилпентен-2 -KBr -HBr
+2Na +HBr Alc KOH B) 4-бром-2,3-диметилпентан → (A) → (B) → 2,3-диметилпентен-2 -2NaBr -HBr
Alc KOH +HBr Alc KOH С) 4-бром-2,3-диметилпентан → (A) → (B) → 2,3-диметилпентен-2 -HBr -HBr
162. +HBr +2Na +Br2 Alc KOH + H2 [O] A) етанол → (A) → (B) → (C) → (D) → (D) → бутандіол-2,3 -H2O 2NaBr -HBr -HBr (за Вагнером)
+H+ +Br2 2Na [O] +HBr Alc KOH B) етанол → (A) → (B) → (C) → (D) → (D) → бутандіол-2,3 -H2O -2NaBr (за Вагнером) -KBr
(+H+) (+HBr) +2Na +Br2 Alc KOH [O] С) етанол → (A) → (B) → (C) → (D) → (D) → бутандіол-2,3 -H2O -2NaBr -HBr -HBr (за Вагнером)
163. +H+ +O3 A) бутанол-2 → (A) → ацетальдегід -H2O
+Na +O3 B) бутанол-2 → (A) → ацетальдегід -H2
[O] Alc KOH С) бутанол-2 → (A) → ацетальдегід (за Вагнером) -H2O
164. +2Na + HBr A) етилбромід → (A) → 2-брометанол -2NaBr
Alc KOH + HOBr B) етилбромід → (A) → 2-брометанол -HBr
Alc KOH + Br2 С) етилбромід → (A) → 2-брометанол -HBr
165. H+ +HBr Alc KOH A) 3-метилбутанол-1 → (A) → (B) → ізопрен -H2O -HBr
H+ +Br2(450oC) Alc KOH B) 3-метилбутанол-1 → (A) → (B) → ізопрен
-H2O -HBr
+HBr Alc KOH (Ni) C) 3-метилбутанол-1 → (A) → (B) → ізопрен -H2O -HBr –H2
166. Alc KOH +HBr +Nа A) октанол-1 → (A) → (B) → октен-2 -H2O -NaBr
+HBr Alc KOH H+ C) октанол-1 → (A) → (B) → октен-2 -H2O -HBr –H2O
H+ +HBr Alc KOH D) октанол-1 → (A) → (B) → октен-2 -H2O -HBr
167. Alc KOH +HOCl A) хлорциклопентан → (A) → транс-2-хлорциклопентанол-1 -HCl
+2Na +H2O B) хлорциклопентан → (A) → транс-2-хлорциклопентанол-1 -2NaCl
Alc KOH +Cl2 С) хлорциклопентан → (A) → транс-2-хлорциклопентанол-1 -HCl
168. +Br2(450oC) +H2O [O] A) циклопентан → (A) → (B) → транс-циклопентадіол-1,2 -HBr -HBr (за Вагнером)
H+ [O] +H2O В) циклопентан → (A) → (B) → транс-циклопентадіол-1,2 (за Вагнером)
+Br2(450oC) Alc KOH [O] C) циклопентан → (A) → (B) → транс-циклопентадіол-1,2 -HBr -HBr (за Вагнером)
169. + Na +HBr Alc KOH A) 3-метилбутанол-1 → (A) → (B) → триметилетилен -H2 -H2O -HBr
H+ +HBr Alc KOH B) 3-метилбутанол-1 → (A) → (B) → триметилетилен -H2O -HBr
H+ +Br2 Alc KOH C) 3-метилбутанол-1 → (A) → (B) → триметилетилен -H2O -HBr
170. H+ +HBr Alc KOH A) пентанол-1 → (A) → (B) → пентен-2 -H2O -HBr
H+ +Br2 Alc KOH B) пентанол-1 → (A) → (B) → пентен-2 -H2O -HBr
+Na +HBr Alc KOH C) пентанол-1 → (A) → (B) → пентен-2 -H2 -HBr
171. Н+ Alc KOH A) пропанол-2 → (А) → пропін -H2O -H2
+НCl Alc KOH B) пропанол-2 → (А) → пропін -H2O -HCl
Н+ +Br2 Alc KOH С) пропанол-2 → (А) → (B) → пропін -H2O -2HBr
172. +H2O +Cl2 A) бутин-2 → (А) → 3-хлорбутанол (Ni)
+H2 +HOCl B) бутин-2 → (А) → 3-хлорбутанол (Ni)
+Cl2 +H2O C) бутин-2 → (А) → 3-хлорбутанол (Ni)
173. KOH +Br2 Alc KOH A) 2-метил-3-хлорбутан → (A) → (B) → 2-метилбутен-2 -KBr -HBr
+2Na +HBr Alc KOH B) 2-метил-3-хлорбутан → (A) → (B) → 2-метилбутен-2 -2NaBr -HBr
Alc KOH +HBr Alc KOH С) 2-метил-3-хлорбутан → (A) → (B) → 2-метилбутен-2 -HBr -HBr
174. +HBr +2Na +Br2 Alc KOH + H2 A) бутанол-2 → (A) → (B) → (C) → (D) → 3,4-диметилгексен-3 -H2O 2NaBr -HBr -HBr
+H+ +Br2 2Na [O] +HBr B) етанол → (A) → (B) → (C) → (D) → 3,4-диметилгексен-3 -H2O -2NaBr (за Вагнером)
(+H+) (+HBr) +2Na +Br2 Alc KOH С) етанол → (A) → (B) → (C) → (D) → 3,4-диметилгексен-3 - - -H2O -2NaBr -HBr -HBr
175. +H+ +O3 A) етанол → (A) → мурашиний альдегід -H2O
+Na +O3 B) етанол → (A) → мурашиний альдегід -H2
[O] Alc KOH С) етанол → (A) → мурашиний альдегід (за Вагнером) -H2O
176. +2Na + HBr Alc KOH A) ізобутанол → (A) → (В) → 2,2,3,3-тетраметилбутан -H2 -HBr
+H+ + HOBr +2Na B) ізобутанол → (A) → (В) → 2,2,3,3-тетраметилбутан -H2O -2NaBr
+H+ + HBr +2Na С) ізобутанол → (A) → (В) → 2,2,3,3-тетраметилбутан -H2O -2NaBr
177. H+ +HBr Alc KOH A) 3-метилбутанол-1 → (A) → (B) → триметилетилен -H2O -HBr
H+ +Br2(450oC) Alc KOH B) 3-метилбутанол-1 → (A) → (B) → триметилетилен -H2O -HBr
+HBr Alc KOH (Ni) C) 3-метилбутанол-1 → (A) → (B) → триметилетилен -H2O -HBr –H2
178. Alc KOH +HBr +Nа A) гексанол-1 → (A) → (B) → гексен-2 -H2O -NaBr
+HBr Alc KOH H+ В) гексанол-1 → (A) → (B) → гексен-2 -H2O -HBr –H2O
H+ +HBr Alc KOH С) гексанол-1 → (A) → (B) → гексен-2 -H2O -HBr
179. Alc KOH +HOВr A) бромциклогексан → (A) → транс-2-бромциклогексанол-1 -HBr
+2Na +H2O B) бромциклогексан → (A) → транс-2-бромциклогексанол-1 -2NaBr
Alc KOH +Br2 С) бромциклогексан → (A) → транс-2-бромциклогексанол-1 -HBr
180. +Br2(450oC) +H2O [O] A) циклогексан → (A) → (B) → транс-циклогексадіол-1,2 -HBr -HBr (за Вагнером)
H+ [O] +H2O В) циклогексан → (A) → (B) → транс-циклогексадіол-1,2 (за Вагнером)
+Br2(450oC) Alc KOH [O] C) циклогексан → (A) → (B) → транс-циклогексадіол-1,2 -HBr -HBr (за Вагнером)
ЕТЕРИ Література: [1 с.341-360].
Приклад 1. Напишіть рівняння реакції і назвіть вихідні речовини, з яких в результаті міжмолекулярної дегідратації утворюється етилметиловий етер.
де R1, R2 – вуглеводневі радикали. Для метилетилового етеру цю реакцію можна записати наступним чином:
СН3–ОН + СН3– СН2–ОН СН3–О–СН2–СН3 + Н2О Метанол етанол етилметиловий етер Приклад 2. Напишіть рівняння реакції і назвіть вихідні речовини з яких в результаті реакції Вільямсона утворюється етилметиловий етер.
Розв’язання. Реакція Вільямсона полягає у дії на галогеналкани алкоголятів або фенолятів з утворення етерів за схемою:
Для метилетилового етеру цю реакцію можна записати наступним чином: СН3–ОNa + СН3– СН2–I → СН3–О–СН2–СН3 + NaI метилат натрію брометан етилметиловий етер
Завдання для самостійного розв’язування
Напишіть рівняння реакції і назвіть вихідні речовини з яких в результаті міжмолекулярної дегідратації утворюється:
Напишіть рівняння реакції і назвіть вихідні речовини, з яких в результаті реакції Вільямсона утворюється:
ЗМІСТ Організаційно-методичні вказівки................................................ 3 Список рекомендованої літератури.............................................. 7 Навчальна програма дисципліни „Органічна хімія”.................. 7 Таблиця варіантів контрольних завдань..................................... 16 Завдання для контрольної роботи 1. Будова та номенклатура органічних сполук.......................... 19 2. Вуглеводні відкритої будови. Алкани.................................... 30 3. Вуглеводні відкритої будови. Алкени.................................... 33 4. Вуглеводні відкритої будови. Алкадієни............................... 36 5. Вуглеводні відкритої будови. Алкіни..................................... 40 6. Циклічні вуглеводні. Неароматичні вуглеводні.................... 42 7. Циклічні вуглеводні. Ароматичні вуглеводні.......................46 8. Галогенпохідні вуглеводневих радикалів.............................. 51 9. Спирти....................................................................................... 54 10. Етери........................................................................................ 65
Навчально-методичне видання
ОРГАНІЧНА ХІМІЯ
Практикум та контрольні завдання для студентів Інституту заочного та дистанційного навчання напряму 0916 “Хімічна технологія та інженерія”
Автори: Кустовська Антоніна Дмитрівна Білокопитов Юрій Васильович Іванов Сергій Віталійович В авторській редакції
Підп. До друку 26.11.04. Формат 60х84/16. Папір офс. Офс. Друк. Ум. Фарбовідб. 18. Ум. Друк. Арк. 3,95. Обл.-вид. Арк. 4,25. Тираж 150 пр. Замовлення № -1. Вид.№ 17/ІІІ.
Видавництво НАУ. 03058. Київ-58, проспект Космонавта Комарова, 1 Свідоцтво про внесення до Державного реєстру ДК № 977 від 05.07.2002
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-07-14; просмотров: 342; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.32.86 (0.251 с.) |