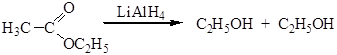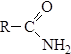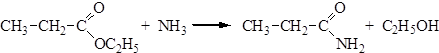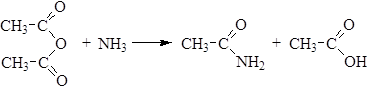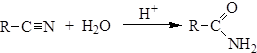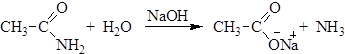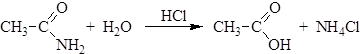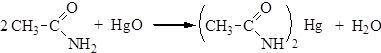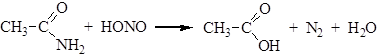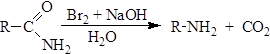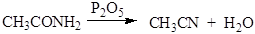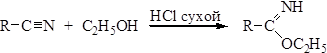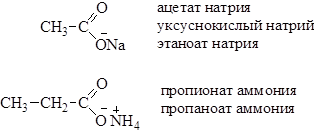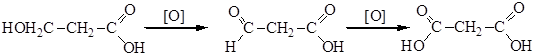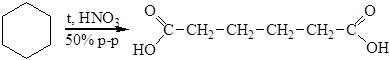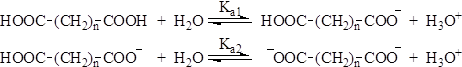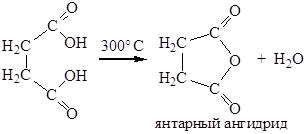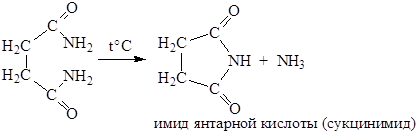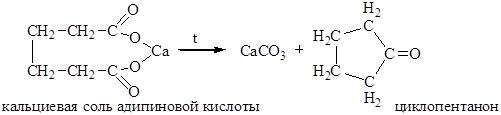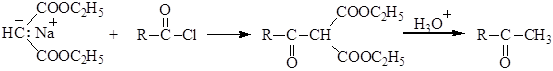Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи между карбонильным атомом углерода и кислородом алкоксигруппы
Восстановление можно проводить под действием натрия в этаноле. Амиды Это производные карбоновых кислот, в которых гидроксил в карбоксильной группе замещен на аминогруппу. Общая формула этих соединений:
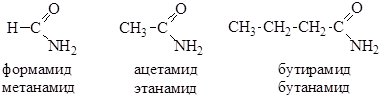
Амиды можно называть по названию ацилов. По систематической номенклатуре к названию соответствующего алкана добавляется окончание –амид:
Способы получения Методы получения амидов мы рассмотрели при изучении химических свойств карбоновых кислот и их галогенангидридов. Кроме указанных методов, амиды могут быть получены из сложных эфиров, ангидридов и нитрилов. 1. Ацилирование аммиака сложными эфирами:
2. Ацилирование аммиака ангидридами кислот:
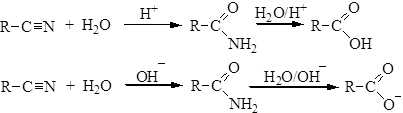
3. Гидролиз нитрилов:
4. Промышленный способ получения формамида:
Физические свойства Простейший амид – формамид – жидкость при обычных условиях, остальные амиды твердые вещества. Амиды имеют самые высокие температуры плавления из всех производных карбоновых кислот, что связано с образованием сильных межмолекулярных водородных связей. Химические свойства 1. Гидролиз амидов. При нагревании амидов с водой происходит их гидролиз, в результате которого в зависимости от рН среды образуются карбоновые кислоты или их соли:
2. Дегидратация амидов происходит при нагревании с Р2О5 и приводит к образованию нитрилов:
3. Замещение атомов водорода на металл. Основные свойства аминогруппы в амидах сильно понижены, она проявляет кислотные свойства – замещение атомов водорода на металл:
4. Действие азотистой кислоты на амиды приводит к образованию карбоновых кислот:
5. Образование аминов (перегруппировка Гофмана). При взаимодействии со щелочными растворами галогенов амиды подвергаются расщеплению по Гофману с получением аминов, содержащих на один атом углерода меньше, чем исходный амид:
Нитрилы Важнейшими представителями нитрилов являются ацетонитрил СН3СN (применяется как полярный растворитель) и акрилонитрил CH2=CH-CN (мономер для получения синтетического волокна нитрона и для производства дивинилнитрильного синтетического каучука, обладающего масло- и бензостойкостью).
Способы получения Основным способом получения нитрилов является дегидратация амидов на кислотных катализаторах:
Нитрилы также образуются по реакции нуклеофильного замещения галогена в галогеналканах (см. лекцию№12). Химические свойства 1. Гидролиз нитрилов в кислой и щелочной среде проходит с образованием амидов и далее до карбоновых кислот или их солей:
2. Алкоголиз нитрилов приводит к образованию иминоэфиров, также являющихся производными карбоновых кислот:
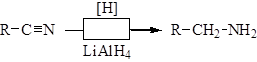
3. Восстановление нитрилов позволяет получать амины с тем же числом углеродных атомов, что и в соответствующей карбоновой кислоте:
Соли карбоновых кислот По систематической номенклатуре названия солей карбоновых кислот образуют путем добавления окончания –оат к названию соответствующего алкана и названия противоиона (металла или аммония). Используют также тривиальные названия карбоксилат-анионов, добавляя к ним название металла:
Методы получения солей рассмотрены выше. С химическими свойствами солей знакомились при рассмотрении методов получения алканов (электролиз по Кольбе и декарбоксилирование), альдегидов и кетонов (пиролиз кальциевых и бариевых солей). ДВУХОСНОВНЫЕ НАСЫЩЕННЫЕ КИСЛОТЫ Двухосновные предельные (насыщенные) кислоты имеют общую формулу СnН2n(СООН)2- Из них важнейшими являются: HOOC-COOH – щавелевая, этандикарбоновая кислота HOOC-СН2-COOH – малоновая, пропандикарбоновая кислота HOOC-СН2-СН2-COOH – янтарная, бутандикарбоновая кислота HOOC-СН2-СН2-СН2-COOH – глутаровая, пентандикарбоновая кислота HOOC-СН2-СН2-СН2-СН2-COOH – адипиновая, гександикарбоновая кислота Способы получения Общие методы получения двухосновных кислот аналогичны способам получения одноосновных кислот (окисление гликолей, гидролиз динитрилов, синтез Кольбе - см. Лекцию№20). Существуют и специфические способы получения двухосновных карбоновых кислот 1. Окисление оксикислот:
2. Окисление циклоалканов. Это промышленный способ получения адипиновой кислоты
Побочно образуются также янтарная и щавелевая кислоты. Адипиновая кислота применяется для синтеза волокна найлон 6,6 и пластификаторов.
Физические свойства Дикарбоновые кислоты – твердые вещества. Низшие кислоты хорошо растворимы в воде, но плохо в органических растворителях. Химические свойства Двухосновные кислоты более сильные, чем одноосновные, они характеризуются двумя константами диссоциации Ка1 и Ка2
Диссоциация первой карбоксильной группы протекает легче. Это особенно заметно для щавелевой и малоновой кислот и связано с тем, что неионизированная карбоксильная группа проявляет электроноакцепторный индуктивный эффект по отношению к ионизированной карбоксильной группе и стабилизирует тем самым образующийся карбоксилат-анион. Дикарбоновые кислоты, в которых две карбоксильные группы разделены цепью из шести и более атомов проявляют свойства, аналогичные монокарбоновым кислотам. Механизм реакций образования диамидов, сложных диэфиров и др., для дикарбоновых кислот тот же, что и для монокарбоновых кислот. 1. Отношение к нагреванию. Примером необычного поведения дикарбоновых кислот, обусловленного наличием двух карбоксильных групп, могут служить реакции, протекающие при нагревании. Так, щавелевая кислота при нагревании до 150°С отщепляет диоксид углерода с образованием муравьиной кислоты: НООС–СООН ® НСООН + СО2 Малоновая кислота и ее моно- и дизамещенные гомологи, при нагревании несколько выше их температур плавления отщепляет СО2 с образованием уксусной кислоты или ее моно- и дизамещенных гомологов: НООС–СН2–СООН ® СН3СООН + СО2 НООС-СН(СН3)-СООН ® СН3СН2СООН + СО2 НООС-С(СН3)2-СООН ® (СН3)2СНСООН + СО2 Дикарбоновые кислоты, содержащие четыре или пять атомов углерода между карбоксильными группами (янтарная и глутаровая кислоты) при нагревании отщепляют воду и образуют циклические ангидриды:
Подобные циклические соединения получают и из амидов:
2. Пиролиз кальциевых и бариевых солей. При пиролизе кальциевых или бариевых солей адипиновой, пимелиновой и пробковой кислот происходит отщепление СО2 и образуются циклические кетоны:
3. Синтезы на основе малонового эфира. Имеют большое значение в органической химии. Атом водорода метиленовой группы, находящейся между ацильными группами диэтилового эфира малоновой кислоты (малоновый эфир), обладает кислотными свойствами и дает натриевую соль с этилатом натрия. Эту соль - (натрий – малоновый эфир) алкилируют галогеналканами по механизму нуклеофильного замещения SN2. На основе натрий - малонового эфира получают одно- и двухосновные кислоты:
Синтез на основе малонового эфира является одним из лучших способов получения карбоновых кислот. Планирование синтеза карбоновых кислот с использованием малонового эфира сводится к выбору подходящего алкилгалогенида. Для этого получаемую кислоту рассматривают как моно- или диалкилуксусную кислоту. При действии галогенангидридов карбоновых кислот с последующим гидролизом и декарбоксилированием из натрий - малонового эфира получают кетоны:
|
||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 412; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.101.192 (0.02 с.) |