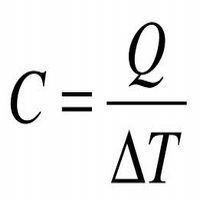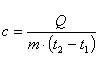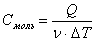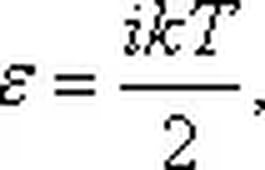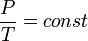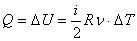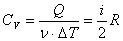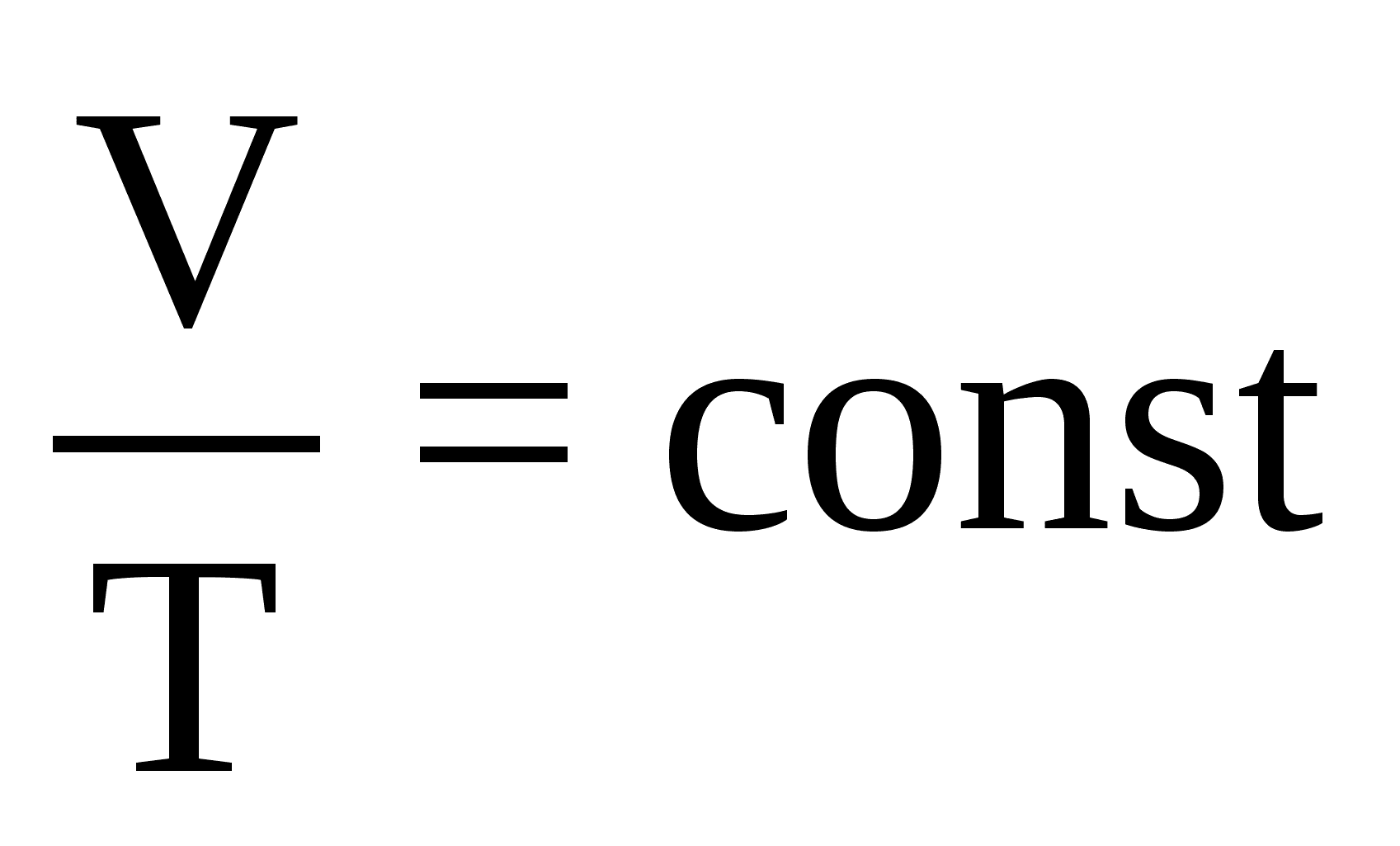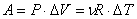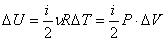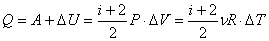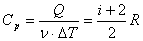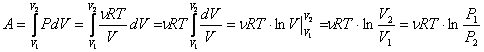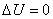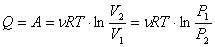Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Количество теплоты. Теплоемкость.⇐ ПредыдущаяСтр 11 из 11
Принцип равнораспределения энергии по степеням свободы молекул и теплоемкость идеальных газов при изопроцессах. Количество теплоты. Количеством теплоты (Q) называется изменение внутренней энергии тела, происходящее в результате теплопередачи. Количество теплоты всегда передается от более горячих тел к более холодным до достижения ими одинаковой температуры (теплового равновесия), если нет иных процессов, кроме теплопередачи.В замкнутой системе тел выполняется уравнение теплового балланса: Q1 + Q2 +... = 0 - количество теплоты, которое теряют горячие тела, равно количеству тепла, получаемому холодными. Первый закон термодинамики(Q=ΔU+A') Количество теплоты, переданное телу, идет на изменение его внутренней энергии (ΔU) и на совершение им работы(A'). Теплоемкость. ТЕПЛОЁМКОСТЬ -отношение подведенного к телу количества теплоты ΔQ к достигнутой при этом разности температур тела ΔT(кол-во теплоты,поглощаемой телом при нагревании):
Удельная теплоемкость — это способность разных веществ к поглощению теплоты при их нагревании. Удельная теплоемкость вещества определяется отношением количества теплоты, полученной им при нагревании, к массе вещества и изменению его температуры:
Молярная теплоемкость — количество теплоты, необходимое для нагревания 1 моль вещества на 1 К:
Принцип равнораспределения энергии по степеням свободы молекул. В статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, которая находится в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень обладает вдвое большей энергией, т.к. на нее приходится как кинетическая энергия (как в случае поступательного и вращательного движений), так и потенциальная, причем средние значения потенциальной и кинетической и энергии одинаковы. Значит, средняя энергия молекулы:
где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы: i = iпост. + iвращ. + 2iколеб.
Закон равнораспределения показывает, что при тепловом равновесии, любая степень свободы (компоненты векторов положения или скорость частицы), которая появляется только как квадратичная функция в энергии, обладает средней энергией равной ½k в T и поэтому вносит вклад ½k в теплоёмкость системы. Теплоемкость идеальных газов при изопроцессах. 1)Изохорический (изохорный) процесс – процесс изменения состояния газа, при котором объём газа остаётся постоянным: V=const.Для изохорического процесса:
Работа газа при изохорном процессе равна нулю: А=0. Все полученное тепло идет на изменение внутренней энергии в соответствии с первым началом термодинамики:
Молярная теплоемкость при изохорном процессе:
(Q- количество теплоты, c -удельная теплоемкость, M -молярная масса, i -количество степеней свободы, R -универсальная газовая постоянная, T -температура). Изобарический (изобарный) процесс - процесс изменения состояния газа, при котором давление газа остаётся постоянным: р = const. Для изобарного процесса:
Работа газа при изобарном расширении:
Изменение внутренней энергии:
Количество полученного тепла в соответствии с первым началом термодинамики:
Молярная теплоемкость при изобарном процессе:
Изотермический процесс- процесс изменения состояния газа, при котором температура газа остаётся постоянным: Т = const. Для изотермического процесса: PV=const Работа газа при изотермическом расширении:
Изменение внутренней энергии при изотермическом процессе равно нулю:
Все полученное тепло идет на совершение работы в соответствии с первым началом термодинамики:
|
|||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 2255; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.156.80 (0.006 с.) |