Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Засоби для інгаляційного наркозуСтр 1 из 7Следующая ⇒
ЗАСОБИ ДЛЯ НАРКОЗУ Засоби для наркозу – лікарські речовини, що пригнічують функціональну активність центральної нервової системи, спричинюють тимчасову втрату больової та інших видів чутливості з одночасною втратою свідомості й розслаблення скелетної мускулатури. Наркозні засоби викликають тимчасовий зворотний функціональний параліч ЦНС. Лікарські речовини, що викликають наркоз, використовуються для загального знеболення і проведення хірургічних втручань на органах і системах організму людини. Засоби для наркозу неоднаково діють на різні відділи ЦНС, а саме: спочатку послаблюється функція кори великих півкуль і підкірки, потім – спинного мозку в останню чергу під впливом великих (токсичних) доз пригнічуються функції довгастого мозку, де знаходяться життєво важливі центри (дихальний, судиноруховий). Механізм дії наркозних засобів – порушення (блокування) синаптичних (міжнейронних) передач збудження в різних відділах ЦНС. Електрофізіологічними дослідженнями встановлено, що засоби для наркозу гальмують передачу нервових імпульсів у неспецифічній аферентній системі стовбура мозку (ретикулярна формація). Засоби для наркозу в анестетичних концентраціях ослаблюють пресинаптичне виділення, зворотне захоплення і швидкість кругообігу ацетилхоліну (АХ), норадреналіну (НА), серотоніну (СТ), меншою мірою — дофаміну (ДА), гаммааміномасляної кислоти (ГАМК) і опіоїдних пептидів (ОП). Поряд з цим зміна пресинаптичних механізмів зворотного захоплення і швидкості обміну медіаторів викликає збільшення рівня АХ, НА, СТ, ГАМК, зниження концентрації ДА і ОП у нервовій тканині. Однак ці показники не дозволяють думати про напрям функціонування" міжневронної передачі під час наркозу. Анестетичні речовини конкурентно блокують м- і н-холінорецептори, a і ß-адренорецептори, рецептори ДА, N-метиласпартату і глютамату. При цьому збуджуються опіатні, а2-адренергічні, ГАМК-і бензодіазепінові рецептори. Засоби для наркозу в цілому порушують адренергічну, посилюють ГАМК- і опіатну передачу нервових імпульсів. При цьому пригнічуються холіно-, дофаміно- і активізуються серотонінергічні медіаторні процеси. Засоби блокують рецептори збуджувальних медіаторних амінокислот (глутамат, аспартат) і активують — гальмуючих (гліцин, таурин).
Синаптичні утворення центральної нервової системи мають неоднакову чутливість до засобів для наркозу. Це може бути зумовлено багатьма причинами, зокрема поліморфізмом клітин нервової тканини, різноманітністю фосфоліпідів у мембранах, ступенем їх змін під впливом наркотичних засобів, різною чутливістю хімічних синапсів на різних рівнях головного і спинного мозку тощо. Однією з найбільш аргументованих теорій наркозу, що пояснює механізми послідовної зміни його стадій (фаз) вибірковою чутливістю окремих утворень нервової системи до наркотичних речовин є еволюційна теорія (Г. О. Батрак, С. І. Хрустальов). Використання еволюційного методу для оцінки впливу засобів для наркозу на різні відділи ЦНС дало змогу постулювати положення, згідно з яким «під час наркозу понад усе пригнічуються більш давні малолабільні утворення підкіркової ділянки і зберігається функція філогенетично молодших утворень, таких як кора великого мозку і дихальний центр, які забезпечують корелятивні функції і життя організму як цілого» Первинне активне гальмування еволюційно більш давнього сітчастого утвору стовбура головного мозку викликає, з одного боку, зменшення аферентної стимуляції кори великого мозку, зниження її тонусу і відображувальної функції, в результаті — втрату свідомості, з другого — деаферентація кори великого мозку розгальмовує структури підкіркової ділянки. В експерименті виявляється короткочасне високочастотне зрушення домінуючого ритму біоелектричної активності у мигдалику, морському конику, хвостатому ядрі. Поширюючись на кіркові та інші структури мозку, високоамплітудна швидка активність формує теленцефалічну, а інколи і генералізовану фазу судомного збудження. Клінічно вона виявляється при використанні засобів для наркозу, що діють повільно і мають подразнювальні властивості (наприклад, ефір для наркозу). У механізмах наступного розслаблення скелетної мускулатури лежить пригнічення вищих рухових центрів середнього мозку і мозочка, а також субординаційне гальмування сегментарних рефлексів у поєднанні з прямою дією засобів для наркозу на чутливі елементи спинного мозку.
Засоби для наркозу поділяються на: 1) засоби для інгаляційного наркозу (рідкі або газоподібні речовини, які вводяться через дихальні шляхи); 2) засоби для неінгаляційного наркозу, які вводяться внутрішньовенно, підшкірно, внутрішньом’язово, ректально. ІНШІ ВИДИ загального знеболювання Однією з основних умов для ефективного проведення оперативного втручання є адекватний анестезіологічний захист організму хворого від операційної травми, забезпечений мінімальною дією лікарських засобів із арсеналу засобів для наркозу. Потреба у розробленні, вивченні і впровадженні нових видів загальної анестезії визначається насамперед індивідуальною чутливістю організму хворого, а також недоліками й ускладненнями, зумовленими застосуванням лікарських засобів для анестезіологічного забезпечення операцій. Крім мононаркозу і комбінованого наркозу все частіше використовують інші види загального знеболювання. Транквіланестезія, транквіланальгезія (атаральгезія) — багатокомпонентне збалансоване загальне знеболювання, що грунтується на використанні транквілізаторів переважно бензодіазепінового ряду в поєднанні із засобами для наркозу або наркотичними анальгетиками. Невролептанальгезія грунтується на спільному використанні невролептиків переважно бути-рофенонового ряду (стан невролепсії) і наркотичних анальгетиків або засобів для наркозу. Центральна анальгезія — досягається введенням переважно наркотичних анальгетиків у великих дозах з обов'язковою штучною вентиляцією легень. Тотальна внутрішньовенна анестезія — досягається введенням неінгаляцій-них засобів для наркозу з препаратами, що забезпечують надійний рівень вегетативного захисту: невролептиками, транквілізаторами, наркотичними і ненаркотичними анальгетиками СПИРТ ЕТИЛОВИЙ Спирт етиловий пригнічує життєдіяльність будь-яких клітин організму. Найбільш чутлива до спирту етилового тканина головного мозку, а саме – кора головного мозку. Внаслідок пригнічення її вищих затримуючих центрів, етанол викликає алкогольне збудження (ейфорію), яке не приводить до підвищення творчої активності, а лише до розгальмування підкоркової діяльності, і зниження самоконтролю. Виділяють декілька стадій в дії етилового спирту (етанолу). 1. Концентрація алкоголю у крові 0,015 – 0,05 г/л (15 – 50 мг %) – погіршується зір. 2. Вміст алкоголю у крові 0,05 – 0,075 г/л (50 – 75 мг %) – головокружіння, м’язове розслаблення, починається порушення координації. 3. Концентрація алкоголю у крові 0,075 – 0,1 г/л (75 – 100 мг %) – без наслідків. 4. Концентрація алкоголю у крові 1 – 2 г/л (100 – 200 мг %) – легке сп’яніння, емоціональна нестійкість. 5. Вміст алкоголю у крові 2 – 3 г/л (200 – 300 мг %) – сильне сп’яніння, безладна, невиразна мова. 6. Вміст алкоголю у крові 2 – 4 г/л (300 – 400 мг %) – оціпеніння. 7. Концентрація алкоголю 4 – 5 г/л (400 – 500 мг %) – важкий стан, небезпечний для життя, втрачається свідомість, розвивається кома. 8. Концентрація алкоголю більше 5 г/л може призвести до смерті. При місцевій дії спирт етиловий подразнює шкіру і слизові оболонки від його властивості осаджувати білки і відбирати воду від тканин. Слабкі розчини етилового спирту діють на слизові оболонки як в’яжуча речовина, що пояснюється зневодненням (дегідратацією) білкових речовин слизової оболонки і осадженням білків протоплазми. Крім того, спирт етиловий діє наркотично на всяку живу протоплазму і в першу чергу – на бактерії. Спирт має велику бактерицидну дію, що пояснюється осадженням білків мікроорганізмів. Менш концентрований етиловий спирт, навпаки, швидко й глибоко проникає у тканини. Цим пояснюється, що в таких випадках більшу дезинфекційну силу має 60 – 70% розчин спирту. Проте, для стерилізації інструментів більшу дезинфікуючу силу має 96% розчин спирту.
Подразнення тканин алкоголем (слизові оболонки і шкіра) проявляється розширенням судин, почервонінні, відчуття тепла, пощипуванням і печінням через подразнення закінчень чутливих нервів, а надалі, навпаки, настає оніміння через параліч цих нервів. У шлунково-кишковому тракті всмоктується швидко. Розподіляється по всьому організму, проникає через біологічні бар’єри. Уже невелика доза (10 – 15 мл алкоголю або 1 склянка вина) знижує збудливість центрів кори мозку, які складають чутливу й інтелектуальну його сферу, внаслідок чого сприйняття зовнішніх вражень, особливо відчуття на дотик, слух і зір знижується. Разом із тим послаблюється увага, здатність до міркування, критики, що несприятливо відбивається на продуктивності розумової праці. При цьому послаблюються процеси гальмувальних центрів і через те настає ейфорійний стан: людина стає веселою, життєрадісною, більш жвавою і товариською; обличчя її червоніє, очі блищать. При вживанні більшої кількості етилового спирту ще дужче пригнічуються чутливість й інтелектуальна сфера, знижується свідомість. Зникає критичне ставлення до своїх думок, слів і вчинків, переоцінюються власні сили і здібності, настає рухове пожвавлення, балакучість. При прийомі великих доз настає невпевненість і втрата координації рухів (ураження мозочка), знижуються рефлекси (ураження спинного мозку). Сп’яніла людина лежить, засинає, температура тіла знижується. Поступово настає параліч дихального і судинорухового центрів. Дихання стає рідким, поверхневим, хрипучим. Нарешті настає глибокий наркоз з втратою свідомості, вольових рухів, чутливості, рефлексів і м’язового тонусу. І остання стадія сп’яніння – колапс (параліч), коли настає різкий занепад кровообігу, дихання, параліч нервових центрів і смерть від зупинки дихання.
Серце після введення невеликої дози алкоголю працює частіше, що пояснюється стадією збудження і пожвавлення рухів. Невеликі дози алкоголю впливають на серце тонізуюче, що пояснюється впливом алкоголю на обмін речовин в організмі. Проникаючи в клітинні елементи і швидко окислюючись в них, алкоголь подібно цукру може бути джерелом енергії, яка підвищує функцію ослабленого серця. Але тривале вживання алкоголю позначається на серці дуже шкідливо і часто веде до переродження серцевого м’язу.
Виділяється із організму за рахунок окислення у печінці (80 – 95%) і виводиться у незміненому виді нирками всього 1%, легенями – 5%. Тривале застосування етилового спирту приводить до імпотенції, гінекомастії, еритематозних змін. В будь-яких випадках має місце значне зниження тестостерону, зв’язане з прямим токсичним впливом етанолу і ацетальдегіду на клітини Лейдига (пригнічення перетворення андростендіолу в тестостерон), а також значне підсилення катаболізму тестостерону в печінці. Під впливом етанолу розвивається розширення судин, брадикардія, гіпотонія. Посилюється діурез за рахунок зменшення виділення вазопресину. Температура тіла знижується. Підвищується вміст цукру у кров за рахунок збільшення викиду катехоламінів. Збільшується виділення брадикініну. Підвищується концентрація ліпопротеїдів високої щільності. Пригнічується секреція вазопресину, збільшується вміст кортикотропіну, глюкокортикоїдів і катехоламінів. Пізніше концентрація катехоламінів зменшується. Окислення алкоголю відбувається у дві стадії. 1. Утворення оцтового альдегіду (зворотна реакція, яка каталізується алкогольдегідрогеназою). 2. Утворення оцтової кислоти (незворотна реакція, каталізується ацетальдегіддегідрогеназою). В нормальних умовах іде окислення спирту. Гостре отруєння алкоголем залежить від швидкості всмоктування, тривалості прийому, дози, функції печінки, стану організму. При помірній і середній стадії сп’яніння необхідне рефлекторне збудження ЦНС – вдихати розчин аміаку, вводити кофеїн. При важких отруєннях втрачається свідомість і рефлекси, пригнічуються життєво-важливі центри. Артеріальний тиск знижується, пригнічується дихання, розвивається синюшність шкіри. Для допомоги вводять аналептики (бемегрид, етимізол, кофеїн), промивають шлунок, вводять сечогінні засоби, глюкозу, кислоту аскорбінову, фруктозу, зігрівають тіло. Хронічне отруєння настає при регулярному прийомі алкоголю. Повторний прийом веде до привикання. Одночасно із звиканням розвивається залежність (пристрасть – психічна і фізична), яка характеризується розвитком психозу, важким переживанням, неспокоєм без споживання алкоголю і сильним потягом до повторних прийомів. Тривале застосування етанолу призводить до розвитку хронічних запальних процесів шлунково-кишкового тракту (езофагіт, гастрит, пептичні виразки, панкреатит), печінки (гепатит, цироз, холецистит), переродження серцевого м’яза, кардіоміопатії, міопатії скелетних м’язів, порушення психіки з галюцинаціями. Настає Корсаковський психоз, атрофія мозку, алкогольна полінейропатія, алкогольний синдром плода.
Лікування хворих на алкоголізм основане на розвитку відрази до алкоголю. Для цього використовують блювотні засоби: апоморфін, еметин, відвар трави баранцю. З допомогою цих речовин виробляється умовно-рефлекторна реакція на алкоголь. В останні роки використовують тетурам (антабус, аверсан, дисульфірам), інмекарб, мебікарб, метронідазол, транквілізатори, еспераль (радотер) – препарат тривалої дії. Таблетки еспералю імплантують у підшкірну клітковину. Фармакологічні ефекти тетураму і його аналогів пов’язані з тим, що перетворюючись у диетилтіокарбамат, дисульфірам блокує фермент альдегіддегірогеназу і сприяє накопиченню ацетальдегіду в печінці та крові після прийому алкоголю. На фоні тетураму: Спирт етиловий è Ацетальдегід Це лежить в основі виникнення антабус-алкогольної реакції, яка виражається соматичними розладами, (відчуття страху, болі в ділянці серця, зниження артеріального тиску, нудота, блювання), які роблять неможливим сумісний прийом тетураму й етилового спитру. Метронідазол менш токсичний, ніж тетурам, але і його сенсибілізуюча дія до алкоголю набагато слабша. Блокує алкогольдегідрогеназу. Застосовують при алкоголізмі також препарати тимонейролептичної дії (терален, труксал, тіоридазин), похідні фенотіазину (трифтазин, етаперазин) – при білій гарячці. Транквілізатори – похідні бензодіазепіну (сибазон), похідні ненасичених біциклічних сполук (інмекарб, мебікарб). СНОДІЙНІ ЗАСОБИ Снодійними засобами називають фармакологічні речовини, які за відповідних умов сприяють розвитку сну. Основна вимога до снодійних засобів полягає в тому щоб вони викликали сон, максимально наближений до нормального фізіологічно сну. Сон є активним життєво необхідним фізіологічним процесом, характеризується повною відсутністю свідомості, зниженням збудливості і пригнічення рефлекторної діяльності. Мозковий кровообіг підвищується, дихання стає рідшим, температура тіла падає. Обмінні процеси у головному мозку (утворення АТФ, креатин фосфату, синтез глюкози) підвищуються. Вихід соматотропного гормону під час сну збільшується. У стані сну відбуваються ритмічні чергування двох фаз: повільно хвильової та швидко хвильової (парадоксальної). На долю повільно хвильової фази припадає 75 – 80% від загальної тривалості сну. Характерною ознакою повільно хвильової фази є наявність на електроенцефалограмі повільних, високо амплітудних хвиль. Швидко хвильовий сон порівняно з повільно хвильовим більш ”тендітний”. Як відомо, підтримування стану сну чи бадьорості залежить у першу чергу від функції активуючої системи мезодіенцефальної ретикулярної формації. При її пригніченні розвивається сон, при збудженні – настає стан бадьорості. Сон розвивається в результаті пригнічуючої дії на ретикулярну формацію гіпногенної системи. Гіпногенна система є холінергічною, вона складається із висхідної (спинноталамічні шляхи, бульбарні центри, вароліїв міст) і низхідної частини (кортикальні відділи, лімбічна система). Обидві частини гіпногенної зони проявляють гальмуючий вплив на мезодіенцефальну ретикулярну формацію. Фази сну (швидка і повільно хвильова) залежать від того, чи розповсюджується гальмування ретикулярної формації на таламокортикальну систему (швидко хвильовий сон), чи ні (повільно хвильовий сон), оскільки ядра таламуса мають синхронізуючий вплив на кору головного мозку. Снодійні засоби у дозах, які викликають сон, пригнічують активуючу систему ретикулярної формації ствола мозку. Звідси виходить, що принципова різниця між медикаментозним і фізіологічним сном полягає у тому, що останній є активним процесом, результатом діяльності гіпногенної системи, в той час як медикаментозний сон є наслідком гальмування ретикулярної формації ствола мозку. Порушення сну є поширеною патологією. Виділяють такі форми розладу сну: 1. Розлади процесу засинання. Цією формою розладу частіше всього страждають молоді люди. В основі її лежить гіперфункція лімбічної системи мозку, яка відповідає за емоції. 2. Передчасне пробудження (скорочений сон). Ця форма безсоння буває у людей похилого віку, причиною цієї форми безсоння є зниження активності гіпногенної системи. 3. Пробудження серед ночі. Як правило така форма безсоння комбінується з соматичними захворюваннями (болі). Лікування розладів сну повинно бути причинно обумовленим, і тільки після ліквідації причини можна призначати симптоматичні засоби, тобто снодійні препарати. Наприклад, часто порушення сну обумовлене зловживанням кави, (гіподинамія). В цих випадках призначати снодійні засоби недоцільно. Розлади засинання нерідко бувають одним із проявів неврозу. Таким людям призначають седативні засоби. Снодійні засоби слід призначати лише у тому випадку, коли етіотропне лікування безсоння неможливе або не дає позитивного ефекту. До снодійних засобів ставляться такі вимоги: 1. Швидкість і надійність. 2. Відсутність неприємного смаку, запаху, подразнення. 3. Достатньо швидка інактивація і виведення із організму. 4. Відсутність від’ємного впливу на органи і системи. 5. Відсутність тератогенної дії. ПРОТИЕПІЛЕПТИЧНІ ЗАСОБИ Протиепілептичні засоби застосовують для попередження або зменшення судом чи відповідних їм еквівалентів, які виникають при різних формах епілепсії. ПРОТИПАРКІНСОНІЧНІ ЗАСОБИ Хвороба Паркінсона та синдром паркінсонізму – це хронічне прогресуюче нейродегенеративне захворювання нервової системи, яке проявляється характерними руховими розладами – акінезією, тремором, м’язовою ригідністю. По даним світової статистики, частота паркінсонізму складає від 60 до 190, а в Україні – 133 випадки на 100 тисяч населення. У зв’язку із збільшенням тривалості життя людей захворюваність паркінсонізмом росте. Паркінсонізм представляє собою поліетіологічне захворювання, яке виникає при самих різних пошкодженнях нервової системи – дегенеративні, інфекційні, токсичні, травматичні, судинні та інші. Згідно сучасній класифікації виділяють первинний (ідіопатичний) паркінсонізм або хворобу Паркінсона, симптоматичний паркінсонізм та паркінсоноподібний синдром Паркінсонізм вважають хворобою нейромедіаторного обміну. Специфічною біохімічною особливістю захворювання є недостатність продукції дофаміну в базальних гангліях і розвиток ДОФА-дефіцитного нейромедіаторного дисбалансу допаміну, що утворюється в процесі біосинтезу норадреналіну. Зменшення вмісту допаміну в базальних гангліях веде до порушення функції екстрапірамідної системи мозку і розвитку паркінсонізму. Лікарські речовини, які послаблюють ригідність м’язів і тремтіння рук, голови, зменшують надмірне слиновиділення і виявляють лікувальну дію при хворобі Паркінсона та інших гіперкінезах. Класифікація протипаркінсонічних засобів. 1. Лікарські речовини, які активують дофамінергічний вплив: а) Попередники дофаміну (леводопа); б) Засоби, які підвищують концентрацію дофаміну у синаптичній щілині (мідантан); в) Засоби, які стимулюють дофамінові рецептори (бромокриптин, лізирид, каберголін); г) Інгібітори МАО (депреніл, селегінін). д) Інгібітори КОМТ – периферичні (ентакапон) та центральні (толкапон). 2. Засоби, які пригнічують холінергічний вплив – алкалоїди беладонни (атропін), скополії (скополамін) та синтетичні сполуки – циклодол, тригексифенідин, бензтропін, біперидин. Самостійні групи протипаркінсонічних засобів складають інгібітори допа-декарбоксилази і різні засоби, які послаблюють прояви симптомів даного захворювання, а саме – м’язові релаксанти, антидепресанти та інші засоби, які не належать до специфічних препаратів. Більшість протипаркінсонічних засобів належать до антихолінергічних речовин, які зменшують чутливість органів і тканин до ацетилхоліну. Алкалоїди беладонни з давніх часів застосовують для лікування хвороби Паркінсона, паркінсонізму та інших нейродегенеративних захворювань. Холінолітична дія, тобто здатність зменшувати чутливість органів і тканин до ацетилхоліну є характерною фармакологічною особливістю цих алкалоїдів. Препарати алкалоїдів беладонни володіють більш вираженою дією на периферичні холінорецептори і в меншій мірі – на центральні. Тому терапевтична ефективність цих препаратів при паркінсонізмі відносно невелика, крім того, вони викликають різні побічні ефекти. Велику групу лікарських речовин для лікування хвороби Паркінсона складають речовини, які взаємодіють з дофамінергічною системою мозку. Вони підвищують активність дофамінергічної системи або посилюють дію дофаміну, пригнічуючи процес його інактивації шляхом гальмування його зворотного захвату пресинаптичними нервовими закінченнями. Основним препаратом, що компенсує зниження вмісту дофаміну при хворобі Паркінсона, є леводопа. Леводопа представляє собою лівоповертаючий ізомер диоксифенілаланіну, який є попередником дофаміну. Проникає через гематоенцефалічний бар’єр, а потім у нейрони, де леводопа перетворюється у дофамін. Накопичення в базальних гангліях дофаміну послаблює прояви паркінсонізму. Леводопа – найбільш ефективний засіб для лікування хвороби Паркінсона і симптоматичного паркінсонізму. Дія леводопи розвивається повільно і максимального ефекту можна досягти приблизно через 30 днів від початку лікування. Препарат призначають після їди. Лікування проводять тривало. Леводопа із шлунково-кишкового тракту всмоктується швидко. Метаболіти леводопи виводяться нирками. Побічні ефекти – нудота, втрата апетиту, ортостатична гіпотензія, серцеві аритмії, психічні розлади. Для зменшення побічних ефектів комбінують з карбідопою. Комбінований препарат леводопи з карбідопою – синемет. Комбінація леводопи з бенсеризадом – мадопар. Така комбінація підвищує кількість леводопи, що надходить у ЦНС. Не можна комбінувати леводопу з інгібіторами моноаміноксидази (може розвинутись гіпертензія). Мідантан сприяє вивільненню дофаміну із нейронів і пригнічує його нейрональний захват. Відомо, що сам дофамін є агоністом Д 2-рецепторів, функції яких зв’язані з покращенням або відновленням рухової активності при паркінсонізмі. У зв’язку з цим одним із напрямків у розробці нових протипаркінсонічних засобів є пошук препаратів, стимулюючих Д 2-рецептори дофаміну. Серед таких препаратів – похідні алкалоїдів спорині (бромокриптин і лізурид). Бромокриптин є селективним агоністом дофамінових Д 2-рецепторів. Бромокриптин – напівсинтетичний препарат – похідний ергокриптину, активно впливає на обіг дофаміну і норадреналіну в ЦНС, зменшує виділення серотоніну, гальмує секрецію пролактину і соматотропіну. Із шлунково-кишкового тракту всмоктується біля 30%. Депреніл (селегілін) селективний інгібітор МАО, зменшує руйнування дофаміну у головному мозку і потенціює дію леводопи. Сприяє дії дофаміну. Циклодол є центральним холіноблокатором. Пригнічує стимулюючий вплив холінергічної іннервації на базальні ганглії завдяки пригніченню центральних холінорецепторів. Застосовують циклодол при хворобі Паркінсона, паркінсонізмі та інших порушеннях екстрапірамідної системи. Із шлунково-кишкового тракту всмоктується добре. Пригнічуючи М-холінорецептори, може приводити до побічних ефектів (сухість шкіри і слизових оболонок, тахікардія і ін.). При передозуванні циклодолом можуть розвиватись порушення з боку ЦНС (збудження, галюцинації). Застосування циклодолу протипоказане при порушеннях сечовиділення, викликаного гіпертрофією простати, захворюваннях серця, печінки, нирок. Протипаркінсонічні засоби знімають або послаблюють синдром хвороби Паркінсона, лікувальний ефект зберігається тільки під час прийому препаратів. До нової генерації протипаркінсонічних засобів належать інгібітори КОМТ – ферменту, який бере участь у розпаді дофаміну. Інгібітори КОМТ центральної (тасмар) та периферичної (ентакапон) дії доцільно включати в комплексну патогенетичну терапію на всіх етапах хвороби Паркінсона. АНАЛЬГЕТИКИ І. Природні сполуки. 1. Які містять суму діючих речовин – алкалоїди і допоміжні компоненти (порошок опію, омнопон); 2. Похідні піперидинфенантрену: а) алкалоїди опію – морфін, кодеїн; б) напівсинтетичні препарати – етилморфін. І.Похідні кислот. 1. Арилкарбонові кислоти: а) Препарати саліцилової кислоти – саліцилати (кислота ацетилсаліцилова, метилсаліцилат, саліцилат натрію, трисаліцилат, дифлунісал, бенорилат); б) Похідні фенілантранілової кислоти (мефенамова, флуфенамова, меклофенамова кислоти). 2. Арилалканові кислоти: Препарати арилоцтової кислоти – диклофенак (вольтарен, ортофен); аклофенак, фенклофенак, фентіазак; Препарати арилпропіонової кислоти – ібупрофен, флурбіпрофен, кетопрофен, напроксен, оксапрозин, фенопрофен, індопрофен, бенаксопрофен. Препарати гетероарилоцтової кислоти – зомепірак, кеторолак трометамін, клоперак, толметин; Препарати індол/інденоцтової кислоти – індометацин, суліндак, етодолак. 3. Енолікові кислоти: Препарати піразолідиндіони – азапропазон, фенілбутазон (бутадіон), оксифенілбутазон, фепразон; Препарати оксиками – піроксикам, ізоксикам, лорноксикам, судоксикам; Препарати ізонікотинової кислоти (амізон). ІІ.Не кислотні ненаркотичні анальгетики: а) Похідні піразолону (анальгін, амідопірин). б) Похідні аніліну (парацетамол, фенацетин). в) Препарати інших груп – проквазон, тіарамід, буфексамак, епіразол, набуметон, флюрпроквазон, флуфізон, тинорид, колхіцин. ІІІ.Комбіновані препарати –“артротек” (диклофенак+мізопростон), “цитрамон”, “пенталгін”, “ седалгін”, “ темпалгін”, “ цитропак”. Механізм аналгезуючої дії ненаркотичних анальгетиків полягає у блокуванні утворення та активності кінінів; зменшують їх взаємодію з больовими рецепторами в ділянці запалення. Крім того, вони зменшують утворення простагландинів, які беруть участь у процесі формування болю. Зменшення запального набряку тканин також сприяє запобіганню подразнення больових рецепторів. Більшість ненаркотичних анальгетиків володіють і центральною болетамувальною активністю, гальмують передачу больових імпульсів у синапсах таламічної ділянки, блокують надходження їх у больові центри кори головного мозку. Ненаркотичні анальгетики проявляють також жарознижувальну і протизапальну дію. Механізм жарознижувальної дії ненаркотичних анальгетиків полягає у пригніченні центру теплорегуляції, який розміщений у гіпоталамічній ділянці. При лихоманці центри теплорегуляції збуджені. Пригнічення центрів теплорегуляції призводить до розширення шкірних судин, збільшення потовиділення, внаслідок чого підвищується і тепловіддача, температура тіла знижується. Крім того, в механізмі жарознижувальної дії значну роль відіграє гальмування вивільнення ендогенних пірогенних речовин (антипростагландинова і антисеротонінова дії). Механізм протизапальної дії ненаркотичних анальгетиків полягає у пригніченні всіх стадій запалення. Ненаркотичні анальгетики пригнічують активність “медіаторів запалення” (брадикінін) і гальмують взаємодію їх з рецепторами. Крім того, вони знижують активність гіалуронідази, що викликає зменшення проникливості мембран і ексудації. Ненаркотичні анальгетики зменшують міграцію лейкоцитів із судинного русла, гальмують продукцію АТФ, порушуючи окисне фосфорилювання, зменшують проліферацію фібробластів. Похідні саліцилової кислоти наділені явною ліпоїдотропністю і мають подразнювальну дію на слизові оболонки. В малих дозах саліцилова кислота (1 – 2% мазь, присипка, паста) проявляє кератопластичну дію, а у великих дозах (5 – 10%) – кератолітичну. Саліцилати при прийомі всередину подразнюють слизові оболонки шлунка і кишечнику, тривале застосування може призвести до утворення виразок (ульцерогенна дія) шлунково-кишкового тракту. Вплив саліцилатів на ЦНС. Саліцилати, на відміну від наркотичних анальгетиків, викликають полегшення болю без снодійного ефекту і впливу на психічну діяльність. Аналгезуюча дія саліцилатів, очевидно, має як периферичний, так і центральний механізми. Саліцилати діють як у ділянці таламусу, так і гіпоталамусу. Одноразова доза саліцилатів викликає тільки аналгетичний ефект. Тривале застосування у великих дозах зменшує судинний стаз, набряк і проявляє протизапальну дію. Саліцилати не впливають на причину розвитку процесу (при ревматизмі), але мають неспецифічні протизапальні властивості і підсилюють функцію захисної гіпоталамо-гіпофізарно-наднирникової системи, в результаті чого у крові збільшується вміст глюкокортикостероїдів. Жарознижувальна дія саліцилатів. При лихоманці термостатичні механізми перебувають на вищому рівні активності. Саліцилати нормалізують механізми терморегуляції, діючи центрально, тому температура тіла знижується. Нормальної температури тіла вони не знижують. Саліцилати не впливають на продукцію тепла, вони підвищують тепловіддачу за рахунок розширення судин шкіри, а також за рахунок підсилення потовиділення. Саліцилати пригнічують клінічні прояви і покращують клінічну картину при гострій атаці ревматизму. Пригнічують активність калікреїну, фосфорилювання – тобто процес накопичення енергії. Гальмують біосинтез мукополісахаридів, в результаті чого зменшується набряк і запальна реакція. Імунологічна дія саліцилатів. Саліцилати пригнічують реакції антиген-антитіло, в тому числі систему анафілаксії, викликаної введенням яєчного білка. Саліцилати мають позитивну дію при ревматичній лихоманці, завдяки впливу на імунологічні процеси. Крім того, саліцилати пригнічують клітинний імунітет. Урикозурична дія саліцилатів. Саліцилати проявляють двофазну дію на екскрецію уратів. У малих дозах (1 – 2 грами на добу) порушують секрецію уратів в дистальних відділах ниркових канальців, і рівень уратів у крові підвищується. У великих дозах (5 і більше грамів на добу) блокують реабсорбцію уратів в проксимальних канальцях і, оскільки цей ефект значно підвищує блокаду їх секреції, то з’являється урикозурія. Але великі дози саліцилатів мають небажані ефекти, тому їх не використовують при подагрі. Вплив саліцилатів на кров. Кислота ацетилсаліцилова пригнічує агрегацію тромбоцитів, які відіграють роль у процесі утворення тромбу. Крім того, саліцилати пригнічують синтез простагландинового ендопероксида тромбоксана А, який викликає агрегацію тромбоцитів (див. с.245). Одноразова доза кислоти ацетилсаліцилової може впливати на активність тромбоцитів на протязі 4 – 7 днів. Це може мати практичне значення для попередження тромбемболічної хвороби, в тому числі інсульту. Вплив саліцилатів на ендокринну систем у. Саліцилати у великих дозах стимулюють гіпоталамічні симпатичні центри і викликають підсилення виділення адреналіну із мозкової речовини наднирників, крім того, збільшують рівень кортикостероїдів у крові і сечі. При тривалому застосуванні саліцилатів порушується процес зв’язування тироксину з білками крові (альбумінами). Не зв’язаний тироксин швидше надходить у тканини, і при високому рівні вільного тироксину в тканинах пригнічується секреція тиреотропного гормону передньою долею гіпофіза. Великі дози саліцилатів у здорових людей викликають гіперглікемію і глюкозурію, очевидно, цей ефект зв’язаний з вивільненням вільних жирних кислот із жирової тканини, що знижують рівень холестерину при застосуванні великих доз і тривалий час. Із шлунково-кишкового тракту саліцилати добре всмоктуються, ефект розвивається через 30 хвилин і триває 4 – 6 годин. Виділяються нирками. Побічні ефекти саліцилатів. Серед побічних ефектів слід відмітити: алергічні реакції (висипи на шкірі, кропивниця, свербіння), тромбоцитопенічна пурпура, гемоліз еритроцитів по типу ідіосинкразії, диспептичні прояви (нудота, блювання, проноси) ульцерогенна дія, кровотечі. Великі дози саліцилатів знижують рівень протромбіну. Вплив саліцилатів на шлунково-кишковий тракт. При прийомі саліцилатів спостерігаються неприємні відчуття в епігастральній ділянці, нудота, блювання, подразнення слизової оболонки шлунка і дванадцятипалої кишки, підвищення секреції соляної кислоти, що в кінцевому рахунку призводить до ульцерогенної дії (виразки), кровотечі. Тривале застосування саліцилатів може викликати жирову інфільтрацію нирок і печінки. Похідні антранілової кислоти близькі по структурі і фармакологічним властивостями до похідних саліцилової кислоти. Особливість дії похідних антранілової кислоти – більша аналгезуюча активність. Похідні індолоцтовоії кислоти – найбільш активні протизапальні засоби. Мають високу жарознижувальну, аналгезуючу й ульцерогенну дію. Похідні фенілоцтової кислоти мають найбільш виражену анальгетичну та протизапальну дію. Широко застосовуються при артритах, хворобі Бехтєрева, гломерулонефриті. Курс лікування 5 – 6 тижнів. Ефект розвивається через 15 – 20 хвилин і триває 5 годин після прийому препарату всередину. Побічна дія – підсилення секреції шлунково-кишкового тракту. Похідні пропіонової кислоти проявляють виражену аналгетичну дію і менше – протизапальну. Застосовують тривалий час при артритах, артрозах. При довгому застосуванні проявляють ульцерогенну дію. Похідні ізонікотинової кислоти – амізон, виявляє аналгезуючу, протизапальну, жарознижувальну та інтерфероногенну (противірусну) активність.
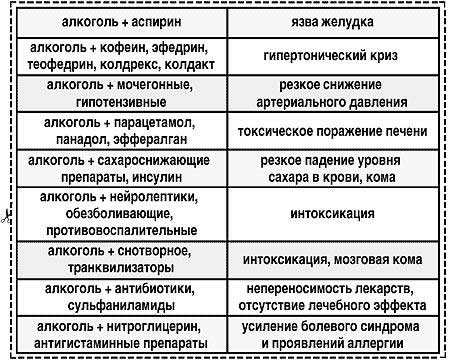
|
|||||||||
|
Последнее изменение этой страницы: 2016-07-11; просмотров: 73; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.85.201 (0.097 с.) |