
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотно-основное титрованиеСтр 1 из 4Следующая ⇒
Варианты
1.1. Нейтрализации (прямое титрование) - основан на свойстве неорганических и органических оснований вступать во взаимодействие с кислотами с образованием солей. По данному варианту определяют аммиак (ФС), метенамин (гексаметилентетрамин) (неофицинальный метод, см. дальше сокращенно неоф. метод), кодеин (ФС), этилендиамин в аминофиллине (эуфиллине) (ФС).
1.1.1. Кодеин (ФС):
f экв =1
1.1.2. Метенамин (гексаметилентетрамин) (неоф. метод). (СH2)6N4 + HCl → (СH2)6N4 × HCl f экв =1
1.1.3. Аминофиллин (эуфиллин) (определение по этилендиамину) (ФС).
f экв =1/2
1.2. Вытеснения (прямое титрование) – основан на вытеснении сильной кислотой (титрант) слабой кислоты из ее соли. 1.2.1. Натриевые соли неорганических кислот (натрия гидрокарбонат (ФС), натрия тетраборат (ФС)). NaHCO3 + HCl → NaCl + H2O + CO2 f экв = 1 Na2B4O7 + 2 HCl + 5 H2O → 4 H3BO3 + 2 NaCl f экв = 1/2 1.2.2. Соли органических кислот. 1.2.2.1. Соли производных барбитуровой кислоты (ФС) – барбитал-натрий, гексобарбитал-натрий (гексенал), этаминал-натрий.
f экв = 1
1.2.2.2. Соли производных сульфаниламидов – сульфацетамид-натрий (сульфацил-натрий) (неоф. метод).
f экв = 1
1.2.2.3. Натрия бензоат (ФС), натрия салицилат (ФС), кофеин-бензоат натрия (по бензоату натрия) (ФС).
f экв = 1
Определение проводят в присутствии органического растворителя, не смешивающегося с водой (эфир), который извлекает образующиеся кислоты и подавляет их диссоциацию. Титрование натриевых солей барбитуровой кислоты и сульфаниламидов (соли более слабых кислот) проводят без добавления органических растворителей.
1.3. Гидролиза (обратное титрование). По этому варианту определяют метенамин (гексаметилентетрамин) (ФС). Метод основан на свойстве ЛВ гидролизоваться при нагревании с избытком титрованного раствора серной кислоты.
H2SO4 + 2 NaOH → Na2SO4 + 2 H2O f экв = 1/4
2. АЛКАЛИМЕТРИЯ – кислотно-основное титрование. Титранты: растворы калия и натрия гидроксида. Индикаторы: кислотно-основные – фенолфталеин, бромфеноловый синий, тимоловый синий, бромтимоловый синий, тимолфталеи, феноловый красный и другие. Варианты
2.1. Нейтрализации (прямое титрование) - основан на свойстве неорганических и органических кислот взаимодействовать со щелочами с образованием солей.
2.1.1. Растворы кислоты хлористоводородной (ФС), кислота борная (ФС). HCl + NaOH → NaCl + H2O f экв = 1
2.1.2. Бензойная, салициловая, ацетилсалициловая кислоты (ФС).
кислота бензойная f экв = 1
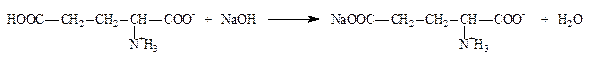
2.1.3. Аминокислоты: глутаминовая кислота по бромтимоловому синему (ФС) и вариант по Серенсену (формольное титрование) (неоф. метод).
f экв = 1/2
Кислота глутаминовая содержит две карбоксильные группы, поэтому в зависимости от условий анализа может титроваться как одноосновная или как двухосновная кислота. При титровании в присутствии бромтимолового синего (без формалина) во взаимодействие вступает только свободная карбоксильная группа:
f экв = 1
2.1.4. Производные барбитуровой кислоты – барбитал, фенобарбитал (неоф. метод), бензолсулфониламиды – норсульфазол (неоф. метод), бутамид (ФС) – проявляют кислотные свойства за счет имидной и сульфамидной групп. Определение проводят в водно-спиртовом и водно-ацетоновом растворах. (Индикатор – тимолфталеин).
f экв = 1
При определении фталилсульфатиазола (фталазола) (неоф. метод) – обратное титрование, нейтрализация протекает по сульфамидной и карбоксильной группам.
NaOH + HCl → NaCl + H2O изб. f экв = 1/2
2.1.5. Аскорбиновая кислота (неоф. метод).
f экв = 1
2.1.6. Фенилбутазон (бутадион) (ФС). Проявляет кислотные свойства за счет образования енольной формы. Растворитель – ацетон или спирт (ндикатор – фенолфталеин).
f экв = 1
2.2. Щелочного гидролиза (обратное титрование) – основан на гидролитическом разложении вещества по сложно-эфирной или амидной группе в присутствии избытка титрованного раствора натрия гидроксида, остаток которого далее оттитровывается кислотой.
2.2.1. Полусинтетические пенициллины (ампициллин, оксациллина натриевая соль – ФС).
NaOH + HCl → NaCl + H2O изб. f экв кисл.формы = 1/2; f экв Na солей = 1
2.2.2. Фенилсалицилат (ФС), ацетилсалициловая кислота (международная фармакопея III-го издания, см. дальше сокращенно МФ III).
NaOH + HCl → NaCl + H2O изб. f экв = 1
2.3. Косвенный (см. часть 1, «Вторичная аминогруппа», количественное определение, п. 2)
HNO3 + NaOH → NaNO3 + H2O f экв = 1 2.4. Вытеснения (прямое титрование). Основан на вытеснении слабого основания из его соли более сильным минеральным основанием. Титруют в присутствии органических растворителей. Метод используется для количественного определения солей органических оснований – папаверина гидрохлорида, пилокарпина гидрохлорида, атропина сульфата, бендазола гидрохлорида (дибазола), хлорпромазина гидрохлорида (аминазина), прокаина гидрохлорида (новокаина) (для всех неоф. метод), хинозола (ФС) и т.д.
2.4.1. Прокаина гидрохлорид (новокаин) (неоф. метод) (см. часть 1, «Третичный и четвертичный атом азота», количественное определение, п. 3).
2.4.2.Кодеина фосфат (неоф. метод):
f экв = 1/2
2.4.3. Хинозол (ФС):
f экв = 1/2
Если соль образована слабым или средней силы основанием, то титрование ведут в водной или водно-спиртовой среде (бендазола гидрохлорид (дибазол), пилокарпина гидрохлорид). Если соль образована сильным основанием (хинозол, хлорпромазина гидрохлорид или аминазин), то титруют в присутствии органического растворителя (хлороформ, спирто-хлороформная смесь) для извлечения органического основания. В НЕВОДНЫХ СРЕДАХ. Метод кислотно-основного титрования в неводных растворителях применяется для количественного определения веществ, представляющих собой кислоты, основания или соли, титрование которых в воде затруднено или невозможно из-за слабых кислотно-основных свойств или малой растворимости. Слабыми считают электролиты (кислота или основание), если Кд < 10-8. т.е. рКа > 8.
Варианты
НИТРИТОМЕТРИЯ. Титрант: раствор натрия нитрита.
Варианты 4.1. Диазотирования – основан на свойстве первичных ароматических аминов вступать в реакцию диазотирования с образованием солей диазония.
4.1.1. Производные пара-аминобензойной кислоты – прокаина гидрохлорид (новокаин), прокаинамида гидрохлорид (новокаинамид), бензокаин (анестезин) – ФС; сульфаниламиды – норсульфазол, сульфацетамид-натрий (сульфацил-натрий) и др. – ФС (см. часть 1, «Первичная ароматическая аминогруппа», количественное определение, п. 1).
4.1.2. ЛВ, содержащие замещенную первичную ароматическую аминогруппу (парацетамол – по ФС, оксазепам (нозепам) – неоф. метод) после кислотного гидролиза (см. часть 1, «Первичная ароматическая аминогруппа», количественное определение, п. 1).
4.1.3. Ароматические нитропроизводные: хлорамфеникол (левомицетин) (ФС), нитроксолин (неоф. метод), нитразепам (неоф. метод) после восстановления ароматической нитрогруппы до первичной ароматической аминогруппы.
f экв = 1
4.2. Образование азидов. Гидразид изоникотиновой кислоты (изониазид) (неоф. метод):
азид f экв = 1
Нитрозирования. Тетракаина гидрохлорид (дикаин) (ФС), содержащий вторичную ароматическую аминогруппу.
f экв = 1
ЙОДОМЕТРИЯ. Титранты: растворы йода и натрия тиосульфата. Вспомогательный раствор – раствор калия йодид.
Индикаторы: раствор крахмала, хлороформ (для экстракции йода) или безиндикаторный способ.
Варианты
5.1. Окисления – основан на окислении лекарственных веществ йодом.
5.1.1. Раствор формальдегида (ФС), глюкоза (неоф. метод), содержащие альдегидную группу. Вариант обратного титрования (см. часть 1, «Карбонильная группа», количественное определение, п. 1).
5.1.2. Сумма природных пенициллинов (бензилпенициллина натриевая или калиевая соль и др. – ФС). Вариант обратного титрования. Метод основан на окислении йодом продуктов гидролитического расщепления вещества – пенальдиновой кислоты и пеницилламина.
изб. f экв = 1/8
5.1.3. Производные гидразина – нитрофурал (фурацилин) (неоф. метод), изониазид (неоф. метод). Вариант обратного титрования. Метод основан на окислении йодом гидразина, образующегося при гидролизе веществ в щелочной среде (NH2 – NH2 + 2 I2 → N2 + 4 HI)
f экв = ¼
5.1.4. Аскорбиновая кислота (неоф. метод):
f экв = 1/2 -2ē 5.1.5. Метамизол-натрий (Анальгин) (ФС) – прямое титрование (S+4 → S+6):
f экв = 1/2
5.1.6. Унифицированный йодометрический метод для йодсодержащих органических препаратов (лиотропин, тиреоидин, кислота йопаноевая) (см. часть 1, «Ковалентно связанный галоген», количественное определение, п.2).
5.2. Восстановления – основан на восстановлении лекарственных веществ калия йодидом, выделившийся йод титруют раствором натрия тиосульфата (косвенное титрование). +1ē 5.2.1. Меди сульфат (CuSO4 × 5H2O) (ФС) (Cu+2 → Cu+1) 2CuSO4 + 4 KI → 2CuI↓ + I2 + K2SO4 I2 + 2Na2S2O3 → 2NaI + Na2S4O6 f экв = 1
5.2.2. Раствор водорода пероксида (неоф. метод). +2ē (O22- → 2O2-) H2O2 + 2 KI + H2SO4 → I2 + 2 H2O + K2SO4 I2 + 2Na2S2O3 → 2NaI + Na2S4O6 f экв = ½
5.2.3. Хлорамин Б, галазон (пантоцид) (ФС) Определение хлорамина проводят в среде хлороводородной кислоты, галазона (пантоцида) в среде натрия гидроксида (т.к. пантоцид (галазон) мало растворим в воде). Вещества разлагаются с выделением активного хлора, который определяют йодометрически.
Cl2 + 2KI → I20 + 2KCl I2 + 2Na2S2O3 → 2NaI + Na2S4O6 +1ē (Cl0 → Cl-) f экв = 1 Независимо от количества атомов хлора в молекуле f экв = 1 (атомарного хлора). Рассчитывают содержание активного хлора: хлорамин Б должен содержать 25-29% хлора, галазон (пантоцид) – не менее 50%.
5.3. Замещения – основан на свойстве йода вступать в реакцию электрофильного замещения с лекарственными веществами (фенолопроизводными – резорцин (ФС), тимол (ФС), фенол (ФС), салициловая кислота (неоф. метод); аминопроизводными – сульфаниламиды (неоф. методы), прокаина гидрохлорид (новокаин) и др. производные пара–аминобензойной кислоты (неоф. методы). Вариант обратного титрования.
5.3.1. Фенол (ФС). (см. часть 1, «Фенольный гидроксил», количественное определение, п. 1.2.).
5.3.2. Антипирин (ФС). Обратное титрование:
(HI + CH3COONa → NaI + CH3COOH) I2 + 2Na2S2O3 → 2NaI + Na2S4O6 f экв = 1/2
5.3.3. Фенилбутазон (Бутадион) (неоф. метод). Прямое титрование:
f экв = 1/2
5.4. Комплексообразования – основан на свойстве лекарственных веществ, содержащих третичную аминогруппу, образовывать с раствором йода осадок полийодида. Вариант обратного титрования. Определяют кофеин в кофеин-бензоате натрия (ФС), атропина сульфат (неоф. метод), папаверина гидрохлорид (неоф. метод) и др. производные алкалоидов. R3N × HCl + n I2 + KI → R3N × n I2 × HI↓ + KCl; I2 + 2Na2S2O3 → 2NaI + Na2S4O6 f экв = 1/2 n, где n – количество молекул йода в составе полийодида.
5.4.1. Кофеин в кофеин-бензоате натрия (ФС). Обратное титрование (см. часть 1, «Третичный и четвертичный атом азота», количественное определение, п. 4). Варианты
6.1. Классический метод Кьельдаля (см. часть 1, «Ковалентно связанный азот», количественное определение, п. 1).
Примеры лекарственных веществ: Примидон (ФС) Осадмид (ФС) Гексамидин (ФС)Оксафенамид (ФС)Дипрофиллин (ФС)
f экв = 1/2 f экв = 1 f экв = 1/4 ЛВ ЛВ ЛВ
6.2. Видоизмененный метод Кьельдаля – основан на гидролитическом разложении лекарственных веществ по амидным группам:
Фактор эквивалентности зависит от числа амидных групп.
6.2.1. Гидролитическое разложение амидов в присутствии натрия гидроксида и дальнейшее определение образовавшегося аммиака по методу Кьельдаля (пирацетам (ноотропил) – ФС) Метод основан на свойстве вещества гидролизоваться под действием натрия гидроксида с выделением аммиака. Определение проводят в установке Кьельдаля. Аммиак отгоняют и улавливают раствором борной кислоты, отгон титруют раствором хлороводородной кислоты по смешанному индикатору (метиловый красный в смеси с метиленовым синим).
f экв = 1 т.к. из 1 молек. вещества ® 1 молек. NH3 ® 1 молек. HCl 6.2.2. Гидролитическое разложение амидов в присутствии серной кислоты с образованием соли амина, которую разлагают щелочью до летучего амина и далее определяют по методу Кьельдаля (никетамид или диэтиламид никотиновой кислоты – неоф. метод).
f экв вещ. = 1
Видоизмененный метод Кьельдаля используется для определения салициламида (ФС), можно по этому методу определить никотинамид (неоф. метод).
7. Комплексонометрия – метод основан на свойстве катионов металлов количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных, растворимых в воде бесцветных внутрикомплексных соединений. Титрант: раствор трилона Б – динатриевая соль этилендиаминтетрауксусной кислоты (сокращенно (Na2H2TrБ).
Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом. Действие металлоиндикаторов зависит от pH среды: а) pH 9,5-10 создается аммиачным буфером. Индикаторы: кислотный хром черный специальный (или эриохром черный Т), кислотный хромовый темно-синий (или хромовый темно-синий), переход окраски от красно-фиолетовой или вишнево красной к синей или сине-фиолетовой. Титруют: Zn2+, Mg2+, Ca2+. б) pH 1-2 создается добавлением разведенной азотной кислоты; pH 4-5-6 создается добавлением ацетатного буферного раствора; pH 7,8-8,2 создается добавлением гексаметилентетрамина (метенамина). Индикатор: ксиленоловый оранжевый, переход окраски от красной к желтой. Титруют: Bi3+ (pH 1-2); Cu2+ (pH 4-5-6); Zn2+, Pb2+, Al3+ (pH 7,8-8,2). в) pH 12-14 создается 30% раствором натрия гидроксида вблизи точки эквивалентности. Индикатор: кальконкарбоновая кислота, переход окраски от красновато-сиреневой к голубой. Титруют: Ca2+.
Варианты
7.1. Прямого титрования. Определяют цинка сульфат, кальция хлорид, магния сульфат, цинка оксид, магния оксид, кальция лактат, кальция глюконат, висмута нитрат основной (ФС). Реакция комплексообразования идет быстро. 1) Ca2+ + H2Ind ® CaInd + 2 H+
2)
3) в точке эквивалентности: CaInd + Na2H2TrБ ® CaNa2TrБ + H2Ind Окраска раствора за счет свободного индикатора
7.2. Обратного титрования. Используется, если: - реакция комплексообразования проходит медленно (Al3+); - нет подходящего индикатора (Pb2+); - анализируемое вещество не растворяется в воде
1) Pb2+ + Na2H2TrБ ® PbNa2TrБ + 2 H+ изб. количество pH 9,5-10 2) Na2H2TrБ + ZnSO4 ® ZnNa2TrБ + (NH4)2SO4 + 2 H2O (NH4OH, NH4Cl) в точке эквивалентности: H2Ind + Zn2+ ® ZnInd + 2 H+ окраска раствора за счет комплекса металла с индикатором
Трилон Б образует с катионами металлов комплексонаты в стехиометрическом соотношении 1:1 независимо от заряда катиона, поэтому f экв = 1. Исключение составляет препарат – висмута нитрат основной, т.к. это вещество непостоянного состава и расчет идет на Bi2O3, поэтому f экв Bi2O3 = 1/2.
7.3. Косвенного титрования. Основан на свойстве органических лекарственных веществ с третичной аминогруппой (папаверина гидрохлорид, морфина гидрохлорид, атропина сульфат, хлорпромазина гидрохлорид (аминазин), хинина гидрохлорид и др.) образовывать комплексные соли с общеалкалоидными реактивами, например, тетрароданоцинкатом аммония, калия тетрайодовисмутатом (III) (неоф. метод) (см. часть 1, «Третичный и четвертичный атом азота», количественное определение, п. 5).
Примеры лекарственных веществ:
Хлорпромазина гидрохлорид (Аминазин), Атропина сульфат f экв = 2/n = 2/1 = 2 f экв = 2/n = 2/2 = 1
8. ЦЕРИМЕТРИЯ (окислительно-восстановительное титрование). Титрант: раствор церия (IV) сульфата. Индикация: 1) безиндикаторный; 2) дифениламин или ферроин - комплекс Fe (II) с о-фенантролином; 3) потенциометрический способ индикации.
Метод основан на свойстве препаратов окисляться солями церия (IV), которые в кислой среде восстанавливаются до церия (III). +1ē Ce4+ ® Ce3+
Варианты Прямого титрования.
8.1.1. Хлорпромазина гидрохлорид (Аминазин) (МФ II) (безиндикаторный метод) – окисление за счет серы до моносульфоксида.
f экв = 1/2 Титруют до исчезновения образующегося в процессе титрования красного окрашивания.
8.1.2. Менадиона натрия бисульфит (викасол) (ФС) (в присутствии индикатора – ферроина). Метод основан на окислении восстановленной формы менадиона сульфатом церия (IV) до 2-метил-1,4-нафтохинона и восстановлении церия (IV) до церия (III). Предварительно действием щелочи выделяют 2-метил-1,4-нафтохинон, извлекают хлороформом, хлороформ отгоняют, менадион восстанавливают цинковой пылью в кислой среде до 2-метил-1,4-дигидроксинафталина, который окисляют сульфатом церия (IV).
f экв = 1/2 В точке эквивалентности избыточная капля титранта (Ce(SO4)2 окисляет Fe2+ в составе комплекса с- фенантролином до Fe3+, который с о-фенантролином дает комплекс голубого цвета. Титруют до зеленого окрашивания (голубой цвет комплекса с желтым раствором титранта (Ce(SO4)2)дает зеленую окраску).
красный голубой 8.1.3. Аскорбиновая кислота (неоф. метод) (в присутствии индикатора – ферроина).
f экв = 1/2 дегидроаскорбиновая кислота
8.1.4. Нифедипин (ФС для субстанции) (в присутствии индикатора – ферроина). Метод основан на окислении нифедипина сульфатом церия (IV) и восстановлении церия (IV) до церия (III).
f экв = 1/2
8.1.5. Токоферола ацетат в 50% масляном растворе (ФС) после кислотного гидролиза (индикатор – дифениламин).
f экв = 1/2
В точке эквивалентности появляется сине-фиолетовое окрашивание:
дифениламин иммониевая соль дифенилбензидина 8.2. Обратного титрования. Избыток церия (IV) сульфата (титранта) определяют йодометрически. 8.2.1. Гидрохлоротиазид (дихлотиазид) (ФС), метамизол-натрий (анальгин) (неоф. метод), фенилбутазон (бутадион) (неоф. метод)
f экв = 1/2
2Ce(SO4)2 + 2 KI ® I2 + Ce2(SO4)3 + K2SO4 остаток I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6;
8.2.2. Кофеин (теобромин, теофиллин) (неоф. метод). Избыток титрованного раствора церия (IV) сульфата при нагревании окисляет вещества в кислой среде до образования аллоксанов (1,3-диметилаллоксан образуется при окислении кофеина и теофиллина, 3-метилаллоксан – при окислении теобромина).
f экв = 1/4 Избыток церия (IV) сульфата определяют йодометрически (см. п. 8.2.1.).
БРОМАТОМЕТРИЯ. Титранты: растворы калия бромата и натрия тиосульфата. Вспомогательные растворы – калия бромида и калия йодида. Индикация: 1) раствор крахмала, 2) метиловый оранжевый, 3) без индикатора, 4) хлороформ (экстракционный способ).
Варианты
9.1. Замещения – основан на свойстве лекарственных веществ - фенолов и ароматических аминов вступать в реакцию электрофильного замещения атомов водорода ароматического кольца на атомы брома.
9.1.1. Прямого титрования: Тимол (ФС), прокаина гидрохлорид (новокаин), бензокаин (анестезин), сульфаниламид (стрептоцид) и другие производные п-аминобензойной кислоты и сульфаниламидов (неоф. методы).
9.1.1.1. Тимол (ФС) (см. часть 1, «Фенольный гидроксил», количественное определение, п. 1.1.1.).
9.1.1.2. Сульфаниламид (Стрептоцид) (неоф. метод). KBrO3 + 5 KBr + 6 HCl ® 3 Br2 + 6 KCl + 3 H2O
f экв = 1/4
9.1.2. Обратного титрования. Избыток брома определяют йодометрическим методом. Фенолопроизводные (фенол, резорцин (ФС)), салициловая кислота (с декарбоксилированием), натрия салицилат, фенилсалицилат (после гидролиза) (неоф. методы), раствор гексэстрола (синэстрола) в масле 2% для инъекций (ФС), производные урацила (неоф. методы).
9.1.2.1. Резорцин (ФС) (см. часть 1, «Фенольный гидроксил», количественное определение, п. 1.1.2.).
9.1.2.2. Тегафур (фторафур) (неоф. метод).
Br2 + 2 KI ® I2 + 2 KBr остаток I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6 f экв = 1/2
9.1.2.3. Хинозол (неоф. метод):
f экв = 1/8 Вариант обратного титрования.
9.1.2.4. Салициловая кислота (неоф. метод) (с декарбоксилированием). Можно определить сложные эфиры и амиды (фенилсалицилат, ацетилсалициловую кислоту, салициламид) после гидролиза (неоф. метод).
f экв = 1/6 Вариант обратного титрования.
9.1.2.5. Гексэстрол (синэстрол) (масляный 2% р-р для инъекций - ФС).
f экв = 1/8 Вариант обратного титрования.
Окислительного титрования.
9.2.1. Для экспресс-анализа йодсодержащих лекарственных веществ – основан на окислении йодид-иона (I-) до йодмонохлорида (ICl) броматом калия в сильно кислой среде HCl (1:1).
Титрант: раствор калия бромата. Индикация: 1)метиловый оранжевый (переход окраски от красно-бурой до лимонно-желтой); 2) безиндикаторный способ (переход окраски от бурой в лимонно-желтую).
9.2.1.1. Прямого титрования. Калия йодид (неоф. метод). 6 KI + KBrO3 + 6 HCl ® 3 I2 + KBr + 6 KCl + 3 H2O
6 KI + 2 KBrO3 + 12 HCl ® 6 ICl + 2 KBr + 6 KCl + 3 H2O или 2 KI + KBrO3 + 6 HCl ® 3 ICl + KBr + 3 KCl + 3 H2O f эквKI = 1/2
Косвенного титрования. Тиамина бромид (неоф. метод) – при взаимодействии с реактивом Драгендорфа образуется комплексное соединение, после растворения осадка в растворе хлороводородной кислоты образующиеся йодид-ионы косвенно определяют броматометрическим методом окислительного титрования. Метод разработан на кафедре фармхимии ПГФА доцентом Г.И. Савельевой. Предложен для анализа тиамина в многокомпонентных лекарственных препаратах, при малом содержании тиамина, когда другие титриметрические методы использовать невозможно.
Тиамин осаждают реактивом Драгендорфа. [T+]Br- × HBr + 2 KBiI4 ® [T+] × [BiI4-] × HBiI4¯ + 2 KBr; 1 моль 1 моль Осадок отфильтровывают, промывают от избытка реактива, затем растворяют в растворе HCl: Осадок + 8 HCl ® 8 HI + [T+]Cl- × HCl + 2 BiCl3; 18-20% 8 молекул 3 HI + KBrO3 + 3 HCl ® 3 ICl + KBr + 3 H2O -2ē I- ® I+ В ходе реакции образуется 8 I- - ионов, следовательно, f эквтиам. = 1/16.
10. Меркуриметрия – метод основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (II). Прямое титрование. Титранты: легко ионизированные соли ртути (II) – ртути (II) нитрат; ртути (II) перхлорат.
10.1. Определение галогенидов. 2 MeX + Hg+2(NO3)2 ® HgX2 + 2 MeNO3 , f экв = 1 где Х – Cl-, Br-, I-. Титрование в азотнокислой среде. Индикация: дифенилкарбазон.
светло-сиреневое окрашивание
10.1.1. Хлориды и бромиды калия и натрия, кальция хлорид (неоф. метод). 2 NaBr + Hg(NO3)2 ® HgBr2 + 2 NaNO3 f экв = 1 CaCl2 + Hg(NO3)2 ® Ca(NO3)2 + HgCl2 f экв = 1/2
10.1.2. Йодиды натрия и калия (неоф. метод). Варианты 10.1.2.1. Безосадочный в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов. Титрант: ртути (II) перхлорат (0,01 моль/л) УЧ [1/2 Hg(ClO4)2] 2 KI + Hg(ClO4)2 ® HgI2¯ + 2 KClO4 спирт: вода (1:1) f экв = 1
10.1.2.2. Осадочного титрования с йодкрахмальным способом фиксации точки эквивалентности, индикация как в методе Кольтгофа.
KIO3 + 5 KI + 3 H2SO4 ® 3 I2 + 3 K2SO4 + 3 H2O I2 + I- ® [I3]- + крахмал ® синее окрашивание. В точке эквивалентности из раствора исчезают йодиды, что сопровождается исчезновением синего окрашивания:
2 I- + Hg(NO3)2 ® HgI2¯ + 2 NO3- или Hg(ClO4)2 или 2 ClO4- f экв = 1 10.2. Определение гидрохлоридов и гидробромидов органических оснований: Тиамина хлорид или бромид; папаверина, этилморфина, эфедрина, пиридоксина, пилокарпина гидрохлориды; скополамина гидробромид и др. (неоф. методы). 2 R º N × HX + Hg(NO3)2 ® 2 R º N × HNO3 + HgX2 f экв = 1/n где n – число молекул HBr или HCl в молекуле анализируемого препарата.
10.2.1. Скополамина гидробромид (неоф. метод).
(индикатор – дифенилкарбазон) f экв = 1
10.2.2. Тиамина бромид или хлорид (неоф. метод). (HNO3) [T+]Br- × HBr + Hg(NO3)2 ® [T+]NO3- × HNO3 + HgBr2 1 молекул (индикатор – дифенилкарбазон) f экв = 1/2 10.3. Определение лекарственных веществ, содержащих ковалентно связанный хлор и бром – основано на предварительном разрушении органического вещества сожжением в колбе с кислородом, растворении продуктов сгорания в поглощающей жидкости (раствор пероксида водорода) и последующим определении элементов в ионном виде. 10.3.1. Нозепам (по хлору) (неоф. метод). (см. п. 12.1).
(HNO3) 2 Cl- + Hg(NO3)2 ® HgCl2 + 2 NO3- Индикатор - дифенилкарбазон f эквхлора = 1
11. АРГЕНТОМЕТРИЯ – метод основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом в виде галогенидов серебра.
Варианты
11.1. Мора (прямое титрование) – используется для титрования хлоридов или бромидов. Титрант: раствор серебра нитрата. Индикатор: калия хромат. Йодиды не определяют, т.к. (ПР AgI = 1,5 × 10-16; ПР AgCl = 1,8 × 10-10; Кроме того осадки серебра йодида и серебра хромата близки по цвету, что затрудняет определения точки эквивалентности. Реакция среды нейтральная или слабощелочная.
11.1.1. Натрия и калия хлориды и бромиды (ФС); кальция хлорид (неоф. метод). NaCl + AgNO3 ® AgCl¯ + NaNO3 2 AgNO3 + K2CrO4 ® Ag2CrO4¯ + 2 KNO3 красноватый осадок f экв = 1
11.1.2. Гидрохлориды и гидробромиды органических оснований - папаверина гидрохлорид, прокаина гидрохлорид (новокаин) (неоф. метод) и др.
2 AgNO3 + K2CrO4 ® Ag2CrO4¯ + 2 KNO3 f экв = 1
Фаянса (прямое титрование). Титрант: раствор серебра нитрата. Индикаторы: адсорбционные – натрия эозинат (для йодидов), бромфеноловый синий, флуоресцеин (для хлоридов и бромидов). Среда – уксуснокислая (разб. CH3cooh). Натрия эозинат не используется для определения хлоридов, т.к. анион в самом начале титрования вытесняет хлориды из осадка и розовая окраска наступает от первой капли титрованного раствора.
11.2.1. Калия и натрия йодиды (ФС), калия и натрия хлориды и бромиды (неоф. метод). а) HInd + H2O «Ind- + H3O+ эозинат натрия б) NaI + AgNO3 ® AgI¯ + NaNO3 в) Ind- + AgI¯ + AgNO3 (изб. капля) ® [(AgI)Ag+]Ind-¯ + NO3- f экв = 1 11.2.2. Гидрохлориды, гидробромиды, гидройодиды органических оснований (эфедрина гидрохлорид, бендазола гидрохлорид (дибазол), дифенгидрамина гидрохлорид (димедрол), этилморфина гидрохлорид, пахикарпина гидрохлорид (неоф. метод)).
f экв = 1
11.2.3. Лекарственные вещества, содержащие ковалентно-связанный галоген после переведения его в ионогенное состояние (гидролитическое разложение, восстановительная минерализация). Кислота йопаноевая (неоф. метод).
1 моль 3 моль 3 NaI + 3 AgNO3 ® 3 AgI¯ + 3 NaNO3 f экв = 1/n, где n- число атомов галогена в органическом соединении; для йопаноевой кислоты f экв = 1/3. Приложение ТЕСТовые задания
1. Наличие какой пары функциональных групп в молекуле придает соединению амфотерные свойства а) альдегидной и кетонной б) спиртового и фенольного гидроксилов в) карбоксильной и первичной алифатической аминогруппы г) сложноэфирной и имидной д) нитрогруппы и фенольного гидроксила
2. Укажите, наличие каких функциональных групп в молекуле обусловливает реакцию взаимодействия лекарственных веществ со щелочью а) карбоксильной б) сложноэфирной в) амидной г) лактамной д) спиртового гидроксила
3. К легко окисляющимся соединениям относятся а) альдегиды б) сложные эфиры в) фенолы г) ароматические амины д) кетоны
4. Для лекарственных веществ, имеющих в молекуле фенольный гидроксил, доказательство подлинности проводят по образованию а) азокрасителя б) бромпроизводного в) ауринового красителя г) индофенолового красителя д) аци-соли
5. Азокраситель не образуют лекарственные вещества, производные а) сульфаниламидов б) п-аминобензойной кислоты в) бензойной кислоты г) о-аминобензойной кислоты д) салициловой кислоты
6. Для доказательства подлинности лекарственных веществ, содержащих третичную аминогруппу, используют а) раствор йода б) реактив Драгендорфа в) аммония тиоцианат г) реактив Марки д) калия дихромат
7. К реактивам, выявляющим кислотные свойства лекарственных веществ, относятся а) FeCl3; CuSO4; NaNO2 б) NaNO2; CoCl2; AgNO3 в) AgNO3; NaOH; FeCl3 8. Реакции комплексообразования используются в анализе лекарственных веществ, содержащих функциональные группы а) альдегидную б) амидную в) имидную г) несколько спиртовых гидроксилов д) фенольный гидроксил
9. Гидроксамовая реакция используется для доказательства подлинности лекарственных веществ, содержащих функциональные группы а) карбоксильную
|
|||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 5649; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.100.118 (0.404 с.) |
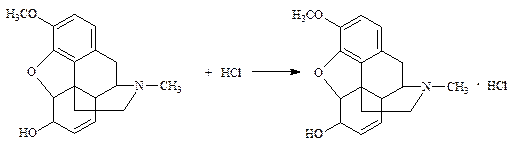

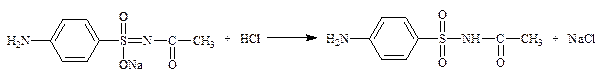


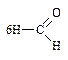 (CH2)6N4 + 2 H2SO4 + 6 H2O
(CH2)6N4 + 2 H2SO4 + 6 H2O  + 2 (NH4)2SO4
+ 2 (NH4)2SO4
 Аминокислоты являются амфотерными соединениями, в водных растворах образуют внутренние соли, поэтому алкалимет-рическое определение затруднено. Для связывания (блокирования) аминогруппы к аминокислоте добавляют формалин. Образующееся N-метиленовое производное титруют раствором натрия гидроксида.
Аминокислоты являются амфотерными соединениями, в водных растворах образуют внутренние соли, поэтому алкалимет-рическое определение затруднено. Для связывания (блокирования) аминогруппы к аминокислоте добавляют формалин. Образующееся N-метиленовое производное титруют раствором натрия гидроксида.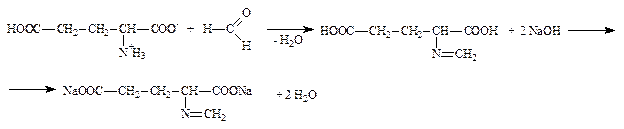
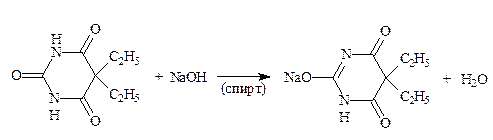
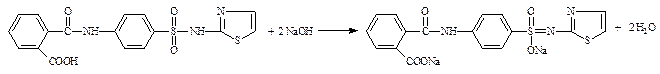



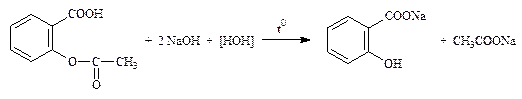
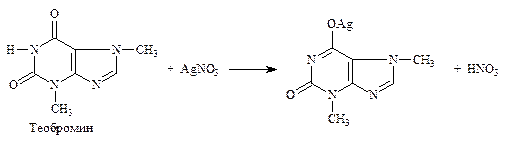



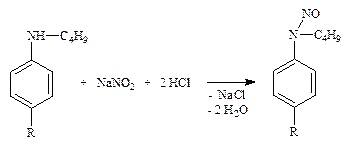




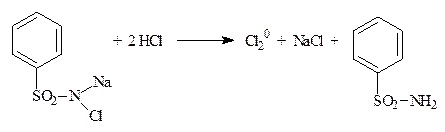








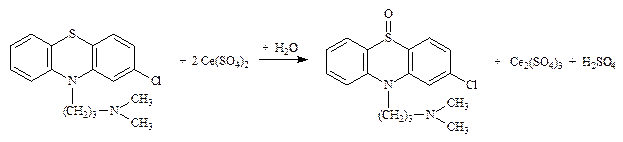









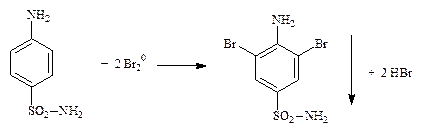




 3 I2 + KBrO3 + 6 HCl ® 6 ICl + KBr + 3 H2O
3 I2 + KBrO3 + 6 HCl ® 6 ICl + KBr + 3 H2O








