Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Устойчивость коллоидных растворов. Коагуляция⇐ ПредыдущаяСтр 20 из 20
Под устойчивостью дисперсной системы понимают постоянство во времени ее состояния и свойств. Различают два вида коллоидной устойчивости: · кинетическую (седиментационную), · агрегативную. Причиной кинетической устойчивости является броуновское движение, которое противодействует оседанию частиц под действием силы тяжести. Агрегативная устойчивость золей обусловлена наличием двойного электрического слоя у коллоидных частиц, что препятствуют их слипанию при столкновении. Другими словами, наличие одноименных зарядов у коллоидных частиц приводит к их отталкиванию друг от друга и повышению устойчивости золя. При нарушении агрегативной устойчивости золей происходит их коагуляция. Коагуляция — это процесс объединения коллоидных частиц в более крупные агрегаты вследствие полной или частичной потери электрических зарядов. С точки зрения термодинамика, коагуляция протекает самопроизвольно вследствие стремления системы перейти в состояние с более низкой свободной энергией. Коагуляцию может вызывать целый ряд факторов: · изменение температуры, · увеличение концентрации дисперсной фазы, · механическое воздействие, · добавление электролитов. Наибольшее практическое значение имеет коагуляция золей электролитами. Коагуляция электролитами протекает в живом организме, т.к. коллоидные растворы клеток находятся в соприкосновении с электролитами, содержащимися в биологических жидкостях. Коагуляцию золей вызывают все сильные электролиты при увеличении их концентрации в растворе до некоторого значения, называемого порогом коагуляции. Порог коагуляции (γ) – это минимальное количество электролита, которое надо добавить к 1 л золя, чтобы вызвать начало коагуляции. Порог коагуляции рассчитывается по уравнению:
где γ — порог коагуляции (моль/л), с — концентрация электролита (моль/л), V — объем раствора электролита (л) V3 — объем золя (л). Коагулирующие действие электролитов описывается правилом Шульце – Гарди: коагуляцию вызывают ионы, заряд которых противоположен заряду гранулы. Коагулирующая способность тем больше, чем выше заряд иона-коагулятора. Дерягин и Ландау показали, что порог коагуляции золя обратно пропорционален заряду иона-коагулятора, возведенному в шестую степень:
Правило Шульце - Гарди носит приблизительный характер, так как не учитывает влияние ионных радиусов на коагулирующую способность ионов. Ионы с одинаковыми зарядами, но различными ионными радиусами, образуют лиотропные ряды:
Увеличение коагулирующей способности ионов
Единой теории коагуляции золей электролитами не существует. Чаще всего коагулирующие действие электролитов объясняют уменьшением заряда коллоидных частиц в результате сжатия диффузного слоя. Сжатие диффузного слоя можно представить схемой:
Процесс коагуляции золя характеризуется определенной величиной скорости коагуляции, которую можно определить как изменение числа коллоидных частиц в единице объема за единицу времени (рисунок 71).
Рисунок 71 — Кинетическая кривая коагуляции
Отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою устойчивость. В точке А начинается явная коагуляция, которая соответствует уменьшению ξ-потенциала коллоидных частиц до 30 мВ. На участке БВ скорость коагуляции достигает максимального значения; этот отрезок кинетической кривой соответствует периоду быстрой коагуляции (ζ-потенциал равен нулю). При коагуляции золя смесью электролитов можно наблюдать: (а) явление аддитивности — суммирование коагулирующего действия ионов; (б) явление антагонизма — ослабление коагулирующего действия одного иона в присутствии другого; в) явление синергизма — усиление коагулирующего действия одного иона в присутствии другого. При введении лекарственной смеси солей следует убедиться, что эти ионы не являются синергистами. В противном случае препарат может инициировать вредный для организма коагуляционный процесс. При введении в организм электролита, надо учитывать не только его концентрацию, но и заряд ионов. Так, физиологический раствор NaCl нельзя заменить изотоничным раствором MgCl2, т.к. Mg2+ обладает высоким коагулирующим действием. Решение многих проблем в медицине (протезирование кровеносных сосудов и клапанов сердца) связано с проблемой коагуляции крови.
Коагуляция может происходить при смешении золей с различными знаками заряда их частиц (взаимная коагуляция). Такой тип коагуляции применяется в санитарно-гигиенической практике при очистке воды от взвешенных коллоидных частиц. Лекция 17 Растворы ВМС ПЛАН 17.1. Общая характеристика ВМС. 17.2. Набухание и растворение ВМС. 17.3. Полиэлектролиты. 17.4. Коллоидная защита.
17.1. Общая характеристика ВМС
Высокомолекулярными соединениями (ВМС) называют вещества, имеющие молекулярную массу от 10 тысяч до нескольких миллионов. Длина макромолекулы в вытянутом состоянии составляет около 1 000 нм. К природным ВМС (биополимерам) относятся крахмал, целлюлоза, декстраны, нуклеиновые кислоты, белки и натуральные каучуки. Синтетические полимеры являются продуктами реакций полимеризации и поликонденсации. Реакции полимеризации 1) Получение полиэтилена, применяемого в медицине для изготовления пленок, трубок, флаконов и бутылочек, описывается уравнением: n CH2=CH2 → [–CH2–CH2–]n, где n – это степень полимеризации. 2) Получение тефлона, применяемого в медицине для изготовления протезов сердечного клапана и кровеносных сосудов, протекает в соответствии с уравнением: n CF2=CF2 → [–CF2–CF2–]n Реакции поликонденсации Найлон — продукт поликонденсации адипиновой кислоты с гексаметилендиамином используется для получения искусственных волокон и шовного материала в хирургии. Получение найлона описывается уравнением: n HOOC(CH2)4COOH+n H2N(CH2)6NH2 ® [-CO-(CH2)4-CO-NH-(CH2)6-NH-]n+n H2O
Классификация ВМС
(а) линейные (желатин, натуральный каучук),
(г) сшитые (резина)
2. По элементному составу ВМС различают: (а) гомоцепные ВМС, полимерные цепи которых состоят только из атомов углерода; они являются продуктами реакций полимеризации (например, тефлон); (б) гетероцепные ВМС содержащие в цепи не только углерод, но и гетероатомы (N, S и другие); их получают реакцией поликонденсации (например, найлон). 3. По значению молярной массы ВМС различают: (а) монодисперсные ВМС, состоящие из молекул, имеющих одинаковую молярную массу (например, гемоглобин и некоторые другие белки); (б) полидисперсные ВМС, состоящие из молекул различной массы (ДНК, фибриллярные белки, каучуки). Для них рассчитывается среднеарифметическая молярная масса:
где М1 и М2 – молярные массы молекул полидисперсного полимера, n1 и n2 – число молекул с молярной массой М1 и М2 соотвественно. Молекулы ВМС обладают рядом специфических свойств, среди которых наиболее важными являются: гибкость цепей, наличие прочных межмолекулярных связей.
Набухание и растворение ВМС
ВМС могут образовывать как истинные, так и коллоидные растворы. Истинные растворы образуются при растворении полярного полимера в полярном растворителе (белок в воде) или неполярного полимера в неполярном растворителе (каучук в бензоле). Растворению полимеров предшествует их набухание. Набухание ВМС — это увеличение объема и массы полимера вследствие односторонней диффузии низкомолекулярного растворителя в высокомолекулярное вещество (рисунок 72). Диффузия молекул ВМС в растворитель не протекает из-за их низкой подвижности, обусловленной большой молярной массой и наличием межмолекулярных сил.
Рисунок 72— Набухание полимера
Мерой набухания служит степень набухания полимера (α), рассчитываемая либо по изменению массы, либо по изменению объема полимера:
где mo и m — начальная и конечная масса полимера,
где Vo и V — начальный и конечный объем полимера. Различают ограниченное и неограниченное набухание. Ограниченное набухание (желатин в холодной воде) приводит к образованию геля. Гель — это состояние, являющееся промежуточным между твердым и жидким состоянием вещества. Неограниченное набухание (желатин в горячей воде) завершается образованием истинного раствора. На рисунке 73 представлены кинетические кривые ограниченного и неограниченного набухания.
Рисунок 73— Кинетические кривые набухания
На процесс набухания влияют многие факторы: · природа ВМС и природа растворителя; их воздействие на степень набухания описывается правилом: «Подобное растворяется в подобном». · конфигурация цепи полимера; линейные и разветвленные ВМС набухают лучше, чем пространственные и сшитые; · кислотность среды (только у амфотерных полиэлектролитов); · температура: при нагревании увеличивается степень набухания, так как возрастает скорость диффузии низкомолекулярного растворителя в полимер. В механизме физиологических процессов набухание играет большую роль: рост организма, сокращение мышц, тканевый обмен. К набуханию способны кожа, ткани мозга, стекловидное тело глаза. Степень набухания меняется при патологических процессах: ожог, воспаление, травма. Старение человека сопровождается уменьшением способности тканей организма к набуханию. Растворы ВМС и коллоидные растворы существенно отличаются друг от друга, однако существует и некоторая общность их свойств, обусловленная близкими значениями длины молекул полимера и диаметра коллоидных частиц золей. Сравнительная характеристика свойств растворов ВМС и золей представлена в таблице 27.
Таблица 27 — Сравнительная характеристика свойств растворов ВМС и золей
Полиэлектролиты
Полиэлектролиты — это ВМС, содержащие ионогенные группы. По характеру ионогенных групп полимеры делятся на три вида. 1. Полиэлектролиты кислотного типа содержат кислотные ионогенные группы, являющиеся донорами протонов. К ним относятся карбоксильные и сульфогруппы: –СООН –SO3Н Примерами полиэлектролитов данного типа являются растворимый крахмал и гуммиарабик. 2. Полиэлектролиты основного типа содержат основные ионогенные группы, являющиеся акцепторами протонов. К ним относятся аминогруппа, присоединяющая протон и превращающаяся в катион аммония: –NH2 + H+ 3. Амфотерные полиэлектролиты (полиамфолиты) — это ВМС, содержащие и кислотные, и основные группы. Важнейшими из них являются белки. Кислотно-основное равновесие в растворах белков можно представить схемой:
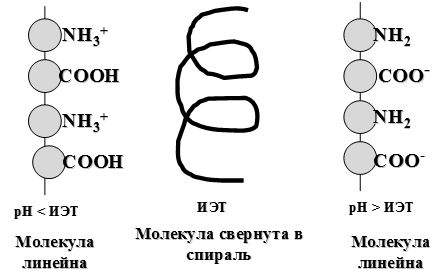
Особым состоянием белка является его изоэлектрическое состояние, в котором суммарный заряд белковой молекулы равен нулю. Упрощенно можно считать, чтов изоэлектрическом состоянии белок существует в виде биполярного иона: +H3N – R – COO-. Изоэлектрическая точка (ИЭТ или pI) — это значение рН раствора, при котором полиамфолит находится в изоэлектрическом состоянии. Для большинства белков рI изменяется в диапазоне 4,5-6,0 (таблица 28).
Таблица 28 — Изоэлектрические точки некоторых белков
В ИЭТ белки имеют специфические свойства, что объясняется особой конфигурацией их молекул. Возможные конфигурации белковой молекулы представлены на следующей схеме:
В изоэлектрическом состоянии белковая молекула имеет конфигурацию α-спирали, что соответствует ее состоянию при физиологических значениях рН. При увеличении кислотности среды (рН < ИЭТ) молекула приобретает линейную конфигурацию вследствие отталкивания положительно заряженных катионов аммония. При увеличении щелочности среды (рН > ИЭТ) молекула также становится линейной в результате отталкивания отрицательно заряженных карбоксилат-ионов. Методы экспериментального определения ИЭТ белков 1) Путем измерения степени набухания белков в растворах с различной кислотностью. В ИЭТ степень набухания белка минимальна (рисунок 74).
Рисунок 74 — Влияние кислотности среды на степень набухания Полиамфолита
2) Путем измерения степени коагуляции белка в растворах с различной кислотностью. В ИЭТ степень коагуляции максимальна (рисунок 75).
Рисунок 75— Влияние кислотности среды на степень Важнейшими факторами, вызывающими коагуляцию белка и других ВМС являются: · добавление электролитов (высаливание),
· добавление нерастворителей — жидкостей, в которых полимер практически не растворим. Коагулирующее действие, как электролитов, так и нерастворителей обусловлено их десольватирующем действием; они связывают молекулы растворителя, уменьшая тем самым плотность сольватной оболочки вокруг молекул ВМС. 3) Путем измерения электрофоретической подвижности белков (u) в растворах с различной кислотностью. В ИЭТ электрофоретическая подвижность белков равна нулю, так как их молекулы электронейтральны (рисунок 76).
Рисунок 76 — Кривая электрофоретической подвижности белков И других полиамфолитов
Электрофорез используют не только для определения ИЭТ, но и для разделения смесей белков на фракции.
Коллоидная защита
Коллоидная защита — это повышение порога коагуляции гидрофобных золей в присутствии поверхностно-активных веществ и высокомолекулярных соединений. Механизм их защитного действия состоит в том, что адсорбируясь на поверхности частиц дисперсной фазы, молекулы ПАВ и ВМС превращают лиофобные системы в лиофильные. Образовавшиеся частицы становятся устойчивыми к коагуляции вследствие эффекта сольватации. Мерой защитного действия ВМС является «золотое» число — это минимальная масса (мг) сухого полимера, необходимая для защиты 10 мл золя золота от коагуляции при добавлении 1мл 10% раствора NaCl (таблица 29).
Таблица 29 — Золотые числа некоторых полимеров (мг)
Измерение «золотого» числа спинномозговой жидкости используется как важный диагностический тест; оно существенно отличается от нормы при менингите и некоторых других заболеваниях. Кроме «золотых», для количественной оценки защитного действия ВМС используют «рубиновые», «серебряные», «железные» и другие числа. Коллоидная защита играет важную роль в жизнедеятельности организма. Например, белки крови стабилизируют дисперсии жиров, холестерина и малорастворимых солей кальция, предупреждая их выделение на стенках кровеносных сосудов. При пониженной защитной функции белков возникает целый ряд заболеваний: подагра, атеросклероз, кальциноз, образование почечных и печеночных камней. Изучение коллоидной защиты имеет большое значение для понимания процессов нормального роста костной ткани, патологического отложения солей при атеросклерозе, подагре и образовании почечных и желчных камней. Способность крови удерживать в растворенном состоянии большое количество газов (О2 и СО2) также обусловлена защитным действием белков. В фармацевтической промышленности защитные свойства ВМС используются для получения концентрированных золей серебра, ртути, золота и их радиоактивных изотопов. Например, лекарственный препарат колларгол — это коллоидный раствор, содержащий 70% высокодисперсного металлического серебра, стабилизированного гидролизатами белков.
Литература Основная: 1. Ленский, А.С. Введение в бионеорганическую и биофизическую химию. – М.: «Высшая школа», 1989 г. – 256 с. 2. Общая химия. / Под редакцией Ю.А. Ершова.– М: «Высшая школа», 2002г. – 560 с. 3. Зеленин, К.Н. Общая и биоорганическая химия. – С.-Пб.: «Элби-СПб», 2003г. – 711 с. 4. Введение в химию биогенных элементов и химический анализ. / Под редакцией Е.В. Барковского. – Мн.: Выш. Шк., 1997 г. – 176 с. 5. основы биофизической и коллоидной химии: учебн. пособие / Е.В. барковский [и др.]. – Мн: Выш. шк., 2009. – 413с.: ил. Дополнительная литература 1. Мушкамбаров, Н.Н. Физическая коллоидная химия» – М.: «Высшая школа»., 2001 г. – 226 с. 2. Суворов, А.В. Общая химия. / А.В. Суворов, А.Б. Никольский. /– С-Пб.: «Специальная литература», 1994 г. – 312 с. 3. Сумм, Б.Д. Основы коллоидной химии. – М.: «Академия», 2006 г. – 189 с.
Содержание Лекция 1
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1925; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.205.123 (0.1 с.) |
 ,
,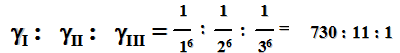
 Li+ > Na+ > K+ > Rb+ > Cs+
Li+ > Na+ > K+ > Rb+ > Cs+


 1. По конфигурации цепи ВМС различают:
1. По конфигурации цепи ВМС различают: (б) разветвленные (крахмал, гликоген),
(б) разветвленные (крахмал, гликоген), (в) пространственные (фенолформальдегидные смолы),
(в) пространственные (фенолформальдегидные смолы),
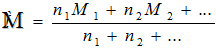

 ,
, ,
,
 – СOO- + H+
– СOO- + H+