
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидролиз солей. Типыгидролиза. Степень и константа гидролиза. Факторы,вызывающиеусилинеие или ослабление гидролиза данной соли.
Гидролиз-реакция обмена между различными веществами о водой. Неорганич вещ-во +вода наз-сягидролизом,аорганичвещ.+воданаз-сягидротация.Гидролиз солей протекает в природе:водоемах,почве.Хлорирует воду:CL2 +H2O=HCL+HCLO(хлорноватитая)В природе протекает гидролиз жиров,сложныхэфиров,алюмосиликатов.В результате гидролиза происходит разрушение горных пород.Применяется при очистке воды,устранение жесткости воды,а так же при гидролизе целлюлозы,крахмала и крахмала содержащих продуктов получают спирт,глюкозу.Процес гидролиза-пищеварение в организме. (соль)NaCl=7;(сода) Na2 CO3 >7;(бурая соль)FeCl3<7 При дабовлении воды р-р приобретает определенное значение pH. Гидролизом называется обратимый процесс взаимодействия ионов соли с ионами воды,приводящий к образованию слабого электролита и изменению реакции среды.Сущ. 4 типа гидролиза(4 типа солей:кислые,средние,основные железо-аммонийные квасцы).Соль,образованная сильным основанием и слабой кислотой;соль,образованная слабым основанием и сильной кислотой,соль,образ-ая сильным основанием и сильной к-той;слабым основанием и слабой кислотой. Константа гидролиза:Kгид= -Природа соли.Чем слабее электролит (меньше Кд),тем выше константа гидролиза(вытекает из ф-лы)и так же чем Кгид больше тем больше и степень гидролиза. -Концентрация соли.С разбавлением р-ра соли становиться степень гидролиза и константа гидролиза становиться больше. -Температура.С повышением t константа воды повышается и константа гидролиза увеличивается. Факторы.NH4++HOH=NH4OH+H+ pH< 7 1 )+H2O. Разбавление ра-ра соли гидролиз усиливает. Принцип ле-шателье:2 )>t, -Q (гидролиз усиливется) 3)+HCl,Гидролиз подавляется.[H+]↑,значит смещается влевоэ 4)Na(OH).H++OH-=H2O гидролиз усиливается. 5)Na2CO3 pH>7(усил) AlCl3 pH<7(ослаб) NaClpH=7 (усил)
Как протекает гидролиз соли,образованной сильным оснаванием и слабой кислотой;слабым основанием и сильной кислотой?Расчет константы,степени гидролиза и pH для такого типа солей. Сильноеоснавание и слабая кислота. NaCN, CH3COONa, K2CO3, K3PO4. NaCN: NaOH-сильный электролит,
HCN-слабый электролит NaCN+H2O=↔NaOH+HCN
CN-+HOH↔OH-+HCN,pH>7,щелочная. Вывод:Соль,образованная сильным осн. и слабой кисл.-гидролиз идет по аниону(кисл. остатку).Реакция среды щел. pH>7.Форма гидролиза-одноступ. K2CO3: KOH-сильное основание H2CO3-слабая кислота. Ι)K2CO3 + HOH↔KOH+KHCO3
CO32-+HOH↔OH-+HCO3. II)KHCO3+HOH↔KOH+H2CO3
HCO3-+HOH↔OH-+CO2+H2O В: идет по аниону CO3-.Форма гидролиза-двухступ.Среда-щелочная, т.к. pH>7. Слабое основание и сильная кислота. NH4CL,HCL,HBr,HI,HCNS,HNO3,HCLO4,H2SO4,CuSO4,Fe2(SO4)3. NH4CL: NH4OH-слабое основание Kд=1,8∙10-5 HCL- сильная кислота. NH4CL+HOH↔NH4OH+HCL NH4++CL-+YOH↔NH4OH+H++CL- NH4++HOH↔HN4OH+H+. В:Гидролиз идет по катиону NH4+.Среда-кислая,Форма гидролиза-одноступ. CuSO4: Cu(OH)2-слабый электролит H2SO4-сильная кислота. I)2CuSO4+2HOH↔(CuOH)2SO4+H2SO4 2Cu2++2SO42-+2H2O↔2CuOH++SO42-+2H++SO42- Cu2++HOH↔CuOH++H+. II)(CuOH)2SO4+2H2O↔2Cu(OH)2+H2SO4 2CuOH++SO42-+2H2O↔2Cu(OH)2+2H++SO42- CuOH++HOH↔Cu(OH)2+H+. Вывод:Гидролиз идет по катиону соли Cu2+.Форма гидролиза - двухступенчатая[Cu(OH)2]. Среда-кислая.pH<7. М.О-красная Ф.Ф.-бесцветная. Расчет константы,степени гидролиза и pH для 1. NH4CL; NH4++HOH↔HN4OH+H+.; Кд= NH4OH↔NH4++OH-: Kдис= h = [H+]= Расчет константы,степени гидролиза и pH для 2. KCN: CN-+H2O↔HCN+OH-, pH>7 Kгидр= [OH-]= Как протекает гидролиз соли,образованной слабым основанием и слабой кислотой,сильным основанием и сильной кислотой?Расчет к гидролиза,h и pH для такого типа солей.У каких солей гидролиз идет до конца? Слабоеоснавание и слабая кислота: -Солислабоготипа: NH4CN,CH3COONH4,(NH4)2S,(NH4)2CO3 NH4CN: NH4OH-слабый электролит Кд=1,8∙10-5 HCN-слабая кислота Кд=7,2∙10-10 NH4CN+HOH↔NH4OH+HCN NH4+HOH↔NH4OH+H+ CN+HOH↔HCN+OH- Параллель протекают два процесса по катиону и аниону.Реакция среды-нейтральня.Определяется величиной Кд.(Кд осн>Кд.HCN) pH≥7,следовательно среда щелочная. - соли в таблице растворимости прочерк (NH4)2SiO3. Al3+,Cr3+,Fe3+ S2-,SO32-,CO32-,SiO32-rfnzd94 Al2S3, Al2SiO3,Fe2(CO3)3,Cr2(SO3)3 Соли,образованные трехосновными кислотными основаниями.Подвергютсяполному,глубокомугидролизу,образуется осадок и газообразное вещество.В уравнении реакции ставиться знак равенства.
(NH4)2SiO3+HOH=NH3↑+H2O+H2SiO3(раз наSiO2 и H2O) Fe2S3+6HOH=2Fe(OH)3↓+3H2S 2FeCl3+3Na2S→ Fe2S3 +NaCl Расчет константы,степени гидролиза и pH CN3COONH4 NH4++CH3COO- +HOH↔ NH4OH+CH3COOH Kгидр= CH3COOH↔ H++ CH3COO- NH4OH↔NH4++ OH- Kд= [NH4OH]= Kгидр= h= pH= 7+ 1/2Lg
|
||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 322; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.169.94 (0.013 с.) |
 ;Степень гидролиза h=
;Степень гидролиза h= 
 моль/л(
моль/л( 100%);h=
100%);h=  моль,%.Еслиh= 30%,то 30 молекул соли гидролизованны,а 70% не подвержены гидролизу.Степень гидролиза зависит от природы соли,концентрации соли и температуры.
моль,%.Еслиh= 30%,то 30 молекул соли гидролизованны,а 70% не подвержены гидролизу.Степень гидролиза зависит от природы соли,концентрации соли и температуры. ; Kд∙[H2O]=Kгидролиза; [H+]=
; Kд∙[H2O]=Kгидролиза; [H+]= 

 ;Кгидр=ch2-закон разбавления Оствальда.
;Кгидр=ch2-закон разбавления Оствальда. моль/л; (%) [H+]=
моль/л; (%) [H+]=  моль/л
моль/л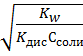 ; pH=7+1/2LgKд осн – 1/2LgCсоли
; pH=7+1/2LgKд осн – 1/2LgCсоли =
=  =
=  =
= 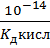
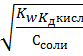 pH=7-1/2Lg
pH=7-1/2Lg  1/2Lg
1/2Lg 

 Kд=
Kд= 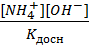 [CH3COOH]=
[CH3COOH]= 
 =
=  =
= 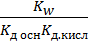
 ,концентрация соли не влият на степень гидролиза,Кгидр и pH
,концентрация соли не влият на степень гидролиза,Кгидр и pH - 1/2Lg
- 1/2Lg 



