Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глутаминовая кислота (глутамат)
Исторически сложилось так, что первыми открытыми медиаторами стали ацетилхолин и моноамины. Это обусловлено их широким распространением в периферической нервной системе (по крайней мере, в случае ацетилхолина и норадреналина). Однако далеко не они являются наиболее часто встречающимися медиаторами ЦНС. Более 80% нервных клеток головного и спинного мозга используют в качестве медиаторов вещества-аминокислоты, которые переносят основную часть сенсорных, двигательных и прочих сигналов по нейронным сетям (возбуждающие аминокислоты), а также осуществляют управление таким переносом (тормозные аминокислоты). Можно сказать, что аминокислоты реализуют быструю передачу информации, а моноамины и ацетилхолин создают общий мотивационно-эмоциональный фон и «наблюдают» за уровнем бодрствования. Существуют и еще более «медленные» уровни регуляции деятельности мозга — это системы нейропептидов и гормональные влияния на ЦНС. По сравнению с образованием моноаминов синтез медиаторов-аминокислот является для клетки более простым процессом, и все они несложны по химическому составу. Медиаторы этой группы характеризуются большей специфичностью синаптических эффектов — либо конкретному соединению присущи возбуждающие свойства (глутаминовая и аспарагиновая кислоты), либо тормозные (глицин и гамма-аминомасляная кислота — ГАМК). Агонисты и антагонисты аминокислот вызывают более предсказуемые эффекты в ЦНС, чем агонисты и антагонисты ацетилхолина и моноаминов. С другой стороны, воздействие на глутамат или ГАМК-ергические системы нередко приводит к слишком «широким» изменениям во всей ЦНС, что создает свои трудности. Главным возбуждающим медиатором ЦНС является глутаминовая кислота. В нервной ткани взаимные превращения глутаминовой кислоты и ее предшественника глутамина выглядят следующим образом:
Будучи заменимой пищевой аминокислотой, она широко распространена в самых разных белках, и ее суточное потребление составляет не менее 5—10 г. Однако глутаминовая кислота пищевого происхождения в норме очень плохо проникает через гематоэнцефалический барьер, что предохраняет нас от серьезных сбоев в деятельности мозга. Практически весь глутамат, необходимый ЦНС, синтезируется прямо в нервной ткани, но ситуация усложняется тем, что данное вещество является также промежуточной стадией в процессах внутриклеточного обмена аминокислот. Поэтому нервные клетки содержат много глутаминовой кислоты, лишь небольшая часть которой выполняет медиаторные функции. Синтез такого глутамата происходит в пресинаптических окончаниях; основной источник-предшественник — аминокислота глутамин.
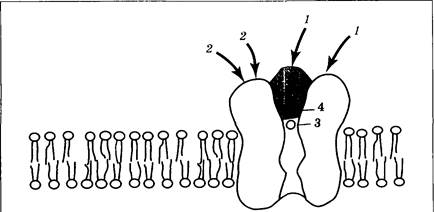
Выделяясь в синаптическую щель, медиатор действует на соответствующие рецепторы. Разнообразие рецепторов к глутаминовой кислоте чрезвычайно велико. В настоящее время выделяют три типа ионотропных и до восьми типов метаботропных рецепторов. Последние менее распространены и менее изучены. Их эффекты могут реализоваться как путем подавления активности аценилатциклазы, так и через усиление образования диацилглицерола и инозитолтрифосфата. Ионотропные рецепторы к глутаминовой кислоте получили свои названия по специфическим агонистам: NMDA-рецепторы (агонист N-метил-D-аспартат), АМРА-рецепторы (агонист альфа-аминогидроксиметилизоксанолпропионовая кислота) и каинатные (агонист каиновая кислота). Сегодня наибольшее внимание уделяется первому из них. NMDA-peцепторы широко распространены в ЦНС от спинного мозга до коры больших полушарий, больше всего их в гиппокампе. Рецептор (рис. 3.36) состоит из четырех белков-субъединиц, имеющих два активных центра для связывания глутаминовой кислоты 1 и два активных центра для связывания глицина 2. Эти же белки формируют ионный канал, который может блокироваться ионом магния 3 и канальными блокаторами 4.
Функция глицина состоит в усилении ответов NMDA-peцептора. Происходит это при низких концентрациях аминокислоты — меньших, чем необходимо для проявления собственных медиаторных свойств глицина. Сам по себе глицин постсинаптических потенциалов не вызывает, но при полном отсутствии глицина их не вызывает и глутамат. Ионный канал NMDA-рецептора проходим для ионов Na+, К+, Ca2+ (в этом его сходство с никотиновым рецептором). На уровне потенциала покоя через него могут осуществлять движение ионы натрия и кальция. Однако их токи оказываются выключены, если канал заблокирован ионом Mg2+ (что обычно наблюдается в некоторое время «на работавшем» синапсе).
При поляризации мембраны нейрона до уровня примерно −40 мВ происходит выбивание магниевой пробки и рецептор переходит в активное состояние (рис. 3. 37, а). Такая деполяризация в реальных условиях наблюдается на фоне срабатывания других (не-NMDA) рецепторов к глутаминовой кислоте. Возврат «магниевых пробок» может занимать несколько часов, и в течение всего этого периода соответствующий синапс будет сохранять повышенную активность, т. е. при появлении глутаминовой кислоты (ГлК) каналы NMDA-рецепторов будут
Рис. 3.37. Схема срабатывания NMDA-рецептора: выбивание Mg2+-пробки (а) приводит к переходу рецептора в рабочее состояние (б) открываться, создавая условия для входа Na+ и Ca2+ (рис. 3.37, б). Данное явление лежит в основе одного из типов кратковременной памяти и называется долговременной потенциацией. Канальные блокаторы кетамин, дизоцилпин (синоним — МК-801) и другие перекрывают канал NMDA-рецептора и прерывают идущие через него ионные токи. При этом в одних случаях наблюдается прочное установление «пробки», и соответствующий препарат оказывается стабильно связан с внутренней поверхностью канала; в других случаях блокада оказывается потенциал-зависимой, и молекулы препарата ведут себя, подобно ионам Mg2+, покидая канал при деполяризации мембраны. Последний вариант оказался наиболее перспективным с точки зрения клинического применения. Вход через канал NMDA-рецепторов ионов Na+ и Ca2+ означает, что в итоге возникнет не только ВПСП, но и ряд метаболических изменений в цитоплазме постсинаптического нейрона, поскольку ионы кальция способны регулировать деятельность многих внутриклеточных ферментов, в том числе связанных с синтезом других вторичных посредников. Избыточная активация этого механизма может быть опасна: если каналы NMDA-рецепторов открыты слишком долго, в клетку войдет очень много Ca2+ и произойдет чрезмерная активация внутриклеточных ферментов, а взрывообразный рост интенсивности обмена веществ может привести к повреждению и даже гибели нейрона. Подобный эффект определяется как нейротоксическое действие глутамата. С ним приходится считаться при различных видах перевозбуждения нервной системы, особенно велика вероятность таких повреждений у людей с врожденными нарушениями внутриклеточного транспорта и связывания ионов кальция (например, их переноса из цитоплазмы в каналы ЭПС). В редких случаях наблюдается нейротоксическое действие глутамата, принимаемого с пищей: плохо проходя из крови в нервную ткань, он все же способен частично проникать в ЦНС в тех зонах, где гематоэнцефалический барьер ослаблен (гипоталамус и дно четвертого желудочка — ромбовидная ямка). Возникающие при этом активационные изменения используют в клинике, назначая по 2—3 г глутамата в сутки при задержках психического развития, истощении нервной системы. Кроме того, глутамат широко используется в пищевой промышленности как вкусовая добавка (имеет мясной вкус) и входит в состав многих пищевых концентратов. Очень богаты им также некоторые восточные приправы, изготовленные из морской капусты. Человек, съевший несколько блюд японской кухни, может одномоментно получить 10—30 г глутамата; последствиями этого нередко становятся активация сосудодвигательного центра продолговатого мозга, рост артериального давления и учащение сердцебиения. Это состояние опасно для здоровья, поскольку может вызвать сердечный приступ и даже инфаркт. В более тяжелом случае происходит локальная гибель нейронов, «перенасытившихся» кальцием. Развитие таких очагов нейродегенерации напоминает по форме микроинсульт.
Поскольку глутамат как медиатор ЦНС распространен очень широко, эффекты его агонистов и антагонистов захватывают многие системы мозга, т. е. они очень генерализованы. Типичным следствием введения агонистов является заметная активация ЦНС — вплоть до развития судорог. Особенно известна в этом смысле каиновая кислота — токсин одной из водорослей Японского моря, вызывающий в больших дозах дегенерацию глутаматергических нейронов (табл. 3.4). Антагонисты глутаминовой кислоты в норме оказывают тормозящее действие на работу мозга и способны избирательно снижать патологическую активность ЦНС. Препараты этой группы эффективны при эпилепсии, паркинсонизме, болевых синдромах, бессоннице, повышенной тревожности, некоторых видах депрессии, после травм и даже при болезни Альцгеймера. Однако конкурентные антагонисты NMDA-рецепторов пока не нашли клинического применения в силу слишком большой генерализованноети изменений. Наиболее перспективной группой оказались блокаторы ионных каналов, причем не связывающиеся с каналом слишком прочно (например, амантадин, будипин, мемантин). Внедрение этих препаратов во врачебную практику в настоящее время только начинается. Они особенно эффективны в ситуациях избыточной активности NMDA-рецепторов, которые возникают как результат недостаточно прочного удержания магниевых пробок; в этих же целях пытаются использовать блокаторы места связывания глицина с NMDA-рецептором (ликостинел). Другое соединение, уже получившее практическое применение, — ламотриджин. Механизм его действия, тормозящего глутаматергическую систему, заключается в стабилизации пресинаптических мембран, поэтому выделение медиатора в синаптическую щель заметно снижается. Ламотриджин — перспективный противоэпилептический препарат, особенно при сочетании с агонистами ГАМК.
Особой категорией веществ, связанных с деятельностью NMDA-рецепторов, являются «прочные» блокаторы их ионных каналов. Наиболее известен среди них кетамин (синоним — калипсол), который используется в клинике как препарат, оказывающий мощное анальгезирующее действие, а также вызывающий быстрый наркоз. Побочный эффект кетамина — появление галлюцинаций. Галлюциногенное действие значительно более выражено у второго препарата данной группы — фенциклидина, который исходно также использовался для обезболивания, но затем перестал применяться, сохранив «значение» как наркотик-галлюциноген.
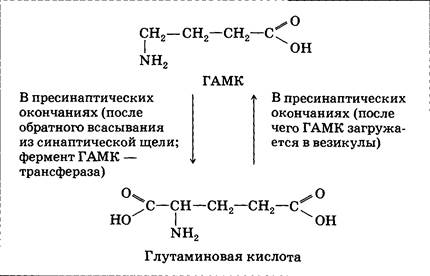
Эффекты фенциклидина своеобразны: в малых количествах он вызывает эйфорию и онемение; речь и координация движений нарушаются. При увеличении дозы возникает затуманенность зрения, однако визуальные (зрительные) галлюцинации редки (в отличие от ЛСД), и в основном происходит нарушение осязательных ощущений. Действие наркотика продолжается обычно несколько часов, но после больших доз — до нескольких дней и даже недель. Вероятность «плохих путешествий» очень велика — 50—80%. Нередко наблюдаются вспышки ярости и даже депрессии, требующие дальнейшего медицинского вмешательства. Инактивация глутаминовой кислоты осуществляется в основном путем захвата глиальными клетками (астроцитами), затем происходит превращение ее в глутамин, аспарагиновую кислоту и ГАМК. Аспарагиновая кислота (аспартат) также может выполнять в ЦНС функции возбуждающего медиатора. По своей химической формуле она очень близка к глутаминовой и действует на те же рецепторы. Гамма-аминомасляная кислота Гамма-аминомасляная кислота (ГАМК) — непищевая аминокислота. Это значит, что она не входит в состав белков и полностью синтезируется в организме. В пищевых аминокислотах NH2-группа находится в альфа-положении (у ближайшего к COOH-концу атома углерода); у ГАМК — в более удаленном гамма-положении. Взаимные превращения ГАМК и глутаминовой кислоты представлены ниже:
ГАМК, как и глутаминовая кислота, играет важную роль в процессах внутриклеточного обмена веществ (в ферментативном разложении глюкозы); лишь небольшая часть ГАМК выполняет функции медиатора. В этом случае она легко образуется из глутаминовой кислоты прямо в пресинаптических окончаниях, затем происходит перенос ГАМК в везикулы и выброс в синаптическую щель. В ЦНС ГАМК распространена не меньше, чем глутаминовая кислота; в основном она является медиатором относительно мелких нейронов, осуществляющих тормозную регуляцию проведения сигналов. Иными словами, передачу информации от одной нервной структуры к другой осуществляют прежде всего глутаматергические нейроны (релейные, тип Гольджи I). Функции торможения реализуются преимущественно за счет деятельности ГАМК-ергических клеток. В некоторых зонах ЦНС встречаются и крупные нейроны, использующие ГАМК в качестве медиатора: клетки Пуркинье (кора мозжечка) и клетки бледного шара, играющие важную роль в работе двигательных центров головного мозга.
Выделяясь в синаптическую щель, ГАМК действует на соответствующие рецепторы: ГАМКА и ГАМКБ. Первый определяется как постсинаптический, ионотропный, он содержит Cl−-каналы; второй — как пост-, так и пресинаптический, метаботропный, он влияет на К+-каналы (табл. 3.5). Более исследованы ГАМКА-рецепторы, агонисты которых нашли широкое применение в клинической практике. Антагонисты ГАМКА-рецепторов бикукулин и пикротоксин — сильные яды, которые вызывают судороги. При этом бикукулин (токсин растений семейства дымянковых) является конкурентным антагонистом и связывается с местом присоединения к рецептору самой ГАМК. Пикротоксин — неконкурентный антагонист и блокирует Сl−-канал. Структура ГАМКА-рецептора очень сложна: кроме активного центра, присоединяющего собственно медиатор, он содержит места связывания других веществ. Наиболее известными в их ряду являются барбитураты и бензодиазепины, увеличивающие время открывания Cl−-каналов. В результате этого наблюдаются агонистические по отношению к ГАМК эффекты. Это позволило широко использовать бензодиазепины и барбитураты в клинике как успокоительные (седативные средства и транквилизаторы), противоэпилептические, снотворные препараты, средства для наркоза. Нередко все эти эффекты способно вызвать одно и то же вещество по мере увеличения используемой дозы.
Барбитураты были открыты в конце XIX века. Все они — производные барбитуровой кислоты: циклического соединения, содержащего внутри шестичленного кольца 2 атома азота. В их названиях обычно присутствует суффикс «-ал». Барбитураты действуют во всех отделах мозга, вызывая генерализованное торможение, поэтому они чаще используются как средства для наркоза (гексенал), а также при тяжелых формах эпилепсии (фенобарбитал, бензонал). Барбитураты-снотворные (барбитал, нембутал) в настоящее время находят все меньшее применение, поскольку вызываемый ими сон отличается от естественного (уменьшается выраженность парадоксальной стадии). После такого сна может наблюдаться сильная заторможенность, нарушение скорости реакции и координации движений. Длительное применение барбитуратов вызывает зависимость, при этом синдром отмены проявляется в виде бессонницы, беспокойства, а в тяжелых случаях — бреда и судорог. Прием барбитуратов совместно с алкоголем усиливает их действие, в результате возможна передозировка, приводящая к остановке дыхания. Перечисленные недостатки барбитуратов вызвали поиск более избирательно действующих агонистов ГАМК. В результате в начале 50-х годов появились бензодиазепины, содержащие в своей структуре три сложным образом соединенных кольца. Их названия нередко содержат суффиксы «-ам» и «-ум». Бензодиазепины действуют в основном на конечный мозг. Используясь как снотворные препараты (нитразепам), они увеличивают глубину и продолжительность сна, но избыточное их количество, как и в случае барбитуратов, может легко привести к дневной заторможенности. Особенно это важно для людей, чья работа связана с повышенным уровнем внимания и необходимостью быстрого реагирования (водители транспорта). Как противосудорожные препараты бензодиазепины применяются при более легких формах эпилепсии по сравнению с барбитуратами. В таких случаях важно не только снизить вероятность припадков, но и сохранить ЦНС в работоспособном состоянии. Следовательно, оптимальным вариантом является не генерализованное торможение мозга, а избирательное снижение активности нейронов эпилептического очага. Эпилептический очаг представляет собой постоянно возбужденную область ЦНС. Причины этого возбуждения могут быть самыми разными: последствия травмы и кровоизлияния в мозг, повышенное внутричерепное давление, локальная гибель или недоразвитие тормозных интернейронов. Периодически «вырываясь» из эпилептического очага, нервное возбуждение может широко распространяться по мозгу, вызывая припадок. Выделяют большие и малые припадки. При большом припадке (grand mal) происходит потеря сознания, падение человека и развитие тонических судорог (напряжение всех мышц, сопровождающееся остановкой дыхания; изгиб тела, часто прикусывается язык; длятся 20—30 с). Тонические судороги сменяются клоническими (ритмические подергивания головы и конечностей; 1—2 мин). После прекращения судорог сознание восстанавливается не сразу. При малом припадке (petit mal) наблюдается кратковременное (несколько секунд) выключение сознания. При этом человек может сохранить предшествовавшую позу (сидеть, стоять, идти), но не всегда знает, что с ним произошло. Окружающие могут заметить малый припадок по «отключению» больного от разговора, падению предмета из его рук, застывшему выражению лица. На электроэнцефалограмме в этот момент зарегистрируется характерная «спайк-волна», представляющая собой чередование высокоамплитудных быстрых и медленных волн (рис. 3.38). К тяжелым последствиям эпилепсии относятся и так называемые «эпилептические сумерки» — помрачение сознания с наплывом зрительных и слуховых галлюцинаций, бредом. Двигательная активность при этом сохраняется, а под влиянием болезненных переживаний возможны агрессивные действия. У многих больных возникают периодические изменения настроения (дисфории) — состояния беспокойства, злобности, придирчивости или, наоборот, оживления и веселости. Сумеречные состояния и дисфории рассматриваются как замещающие эпилептический припадок явления, позволяющие «разрядиться» скопившемуся патологическому возбуждению. При легких формах эпилепсии изменения психики невелики, а припадки редки (не чаще 1 раза в год). При тяжелых формах в день может наблюдаться 5—10 больших припадков. В особо тяжелых случаях заболевание не удается ослабить фармакологическими препаратами, и последней возможностью является хирургическое устранение очага эпилептической активности (вплоть до удаления целого полушария).
В последнее время особенно эффективным для облегчения состояния эпилептических больных считается совместное введение агонистов ГАМК (бензодиазепинов) и антагонистов глутаминовой кислоты (ламотриджина). В этом случае состояние нервной системы корректируется сразу с двух сторон — за счет усиления тормозных и ослабления возбуждающих процессов. Такой подход позволяет свести к минимуму побочные эффекты, что чрезвычайно важно для сохранения нормального работоспособного состояния мозга пациентов с легкими формами эпилепсии. Термин «транквилизаторы» происходит от латинского «делать спокойным». Их основной эффект — уменьшение эмоциональной напряженности, тревоги и страха. В современной литературе для препаратов этой группы используется также термин «анксиолитики» (от anxiety — тревожность). Транквилизаторы могут применяться в качестве противосудорожных препаратов; на их фоне облегчается сон и усиливается действие снотворных препаратов и анальгетиков. Транквилизаторы отличаются от нейролептиков тем, что практически не уменьшают психотические расстройства (соответствующие двигательные проявления, бред, галлюцинации). С другой стороны, транквилизаторы отличаются и от антидепрессантов. Повышенную тревожность можно рассматривать как избыточный страх перед «отрицательным подкреплением» — болью, неудачами, реальными и мнимыми опасностями. Депрессия же — это снижение значимости «положительного подкрепления» (различных субъективно приятных переживаний), потеря интереса к жизни. Наиболее известны среди анксиолитиков-бензодиазепинов элениум (синонимы — либриум, хлозепид), реланиум (диазепам, седуксен, сибазон, валиум), тазепам (нозепам). Более мягким по сравнению с ними действием характеризуется мезапам (нобриум), что позволяет назначать его пожилым людям, детям, а также в качестве «дневного транквилизатора», минимально угнетающего основные функции ЦНС. Кроме уже перечисленных ситуаций, бензодиазепины применяют для облегчения абстинентного синдрома, при мигрени, кожном зуде, сердечных аритмиях, для уменьшения ночного выделения желудочного сока (язвенные заболевания). Так же, как в случае барбитуратов, к ним возможно формирование привыкания и зависимости; наблюдается усиление действия бензодиазепинов на фоне принятия алкоголя и других депрессантов (веществ, снижающих активность ЦНС). Механизм действия бензодиазепинов на ГАМКА-рецептор состоит в следующем: они связываются с активным центром, «настроенным» на особые пептиды — эндозепины, которые являются блокаторами ГАМКА-рецепторов (подавляют открывание Cl−-канала) и вызывают возбуждение, страх, проконфликтное поведение. Бензодиазепины функционируют как антагонисты эндозепинов и тем самым увеличивают уровень торможения в ЦНС. Сходным с эндозепинами действием обладают так называемые бета-карболины (возникают при взаимодействии серотонина с ацетальдегидом, который является продуктом метаболизма этилового спирта). Несколько слов о ГАМКБ-рецепторах. Благодаря открыванию К+-каналов они способны вызывать не только тормозные постсинаптические потенциалы, но и гиперполяризацию пресинаптических окончаний. Последняя снижает кальциевый ток и выброс медиаторов («пресинаптическое торможение»). За счет этого механизма ГАМКБ-рецепторы модулируют высвобождение моноаминов, особенно в лобной коре. Клиническое применение получил агонист ГАМКв-рецепторов баклофен, входящий в группу противосудорожных препаратов. Инактивация ГАМК происходит в основном путем обратного всасывания в пресинаптическое окончание и последующего превращения в глутаминовую кислоту. Реакцию эту осуществляет особый фермент ГАМК-трансфераза. Его блокаторами являются соли вальпроевой кислоты. Они оказывают транквилизирующее и противосудорожное действие. Вальпроаты особенно полезны при малых формах эпилепсии. Вызываемые ими побочные депрессантные изменения, как правило, минимальны. ГАМК при попадании непосредственно в мозг вызывает тормозные эффекты. Однако через гематоэнцефалический барьер эта аминокислота проходит плохо (примерно на 1/10), а проникая в ЦНС, вызывает главным образом метаболические изменения. Тем не менее ГАМК в чистом виде (препарат аминалон) используется в клинике при различных патологиях мозга: после инсультов и травм, при возрастных изменениях, сосудистых заболеваниях, умственной отсталости. Для ГАМК характерно мягкое психостимулирующее действие, реализуемое за счет улучшения работы тормозных интернейронов. Курс лечения обычно составляет несколько месяцев. Сходные эффекты вызывают также производные ГАМК оксибутират и фенибут, для которых более выражены транквилизирующие проявления. Эффективны также «гибриды» ГАМК и витаминов — пантогам (ГАМК плюс пантотеновая кислота — витамин В3) и пикамол (ГАМК плюс никотиновая кислота — витамин РР). Все перечисленные соединения относятся к еще одной группе психотропных препаратов — ноотропам. Этот термин был введен в 70-е годы для обозначения веществ, оказывающих стимулирующее действие на обучение и память, повышающих устойчивость нервной системы к неблагоприятным воздействиям, восстанавливающих нарушенные высшие функции мозга. Классическим представителем ноотропов считается пирацетам (ноотропил), мягко активирующий различные нейромедиаторные системы за счет улучшения метаболических процессов в нервных клетках.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1480; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.159.195 (0.038 с.) |