Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
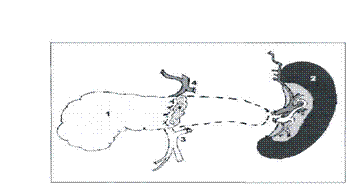
Мочеточник;8-почечная артерия; 9-почечная вена; 10-фрагмент двенадцатиперстной кишки донора.
Данный вид ТПЖ - оптимальный способ лечения больных в возрасте 20-40 лет с минимальными вторичными осложнениями сахарного диабета (рис. 9). Как исключение, могут рассматриваться пациенты младше 20 лет, у которых есть реальная возможность трансплантации почки от живого родственного донора, так как родственная трансплантация почки, в отличие от трупной, имеет xopoшие отдаленные результаты и требует меньшей иммуносупрессивной терапии.
ТРАНСПЛАНТАЦИЯ ЧАСТИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ОТ ЖИВОГО РОДСТВЕННОГО ДОНОРА Поджелудочная железа — второй после почки солидный орган, успешно пересаженный от живого родственного донора. Первая трансплантация произведена 20 июня 1979 г. в университете Миннесоты (США). В противоположность трупному донорству, у родственного имеется ряд неоспоримых преимуществ: хорошая гистосовместимость (как правило, совпадение по двум и более антигенам HLA), низкая вероятность положительной перекрестной лимфоцитотоксической пробы и вследствие этого - возможность уменьшения доз иммунодепрессантов, небольшое время консервации. Основные принципы отбора родственных доноров части поджелудочной железы универсальны и присущи другим видам родственной органной трансплантации. На начальном этапе проверяется наличие или отсутствие абсолютных противопоказаний (диффузные и очаговые заболевания поджелудочной железы, активный инфекционный процесс, психотические состояния, наркотическая, лекарственная и алкогольные зависимости). Медицинская оценка потенциального родственного донора части поджелудочной железы включает общие и специальные методы исследования. Если в результате общего обследования потенциального родственного донора не выявлено отклонений в состоянии здоровья, то цель следующего диагностического этапа - оценка эндокринной функции поджелудочной железы, включающая ряд специальных исследований: определение амилазы и липазы крови; определение уровня глюкозы крови натощак; определение содержания гликозилированного гемоглобина натощак; пероральный глюкозотолерантный тест; внутривенный глюкозотолерантный тест. До 1994 г. пересадка фрагмента поджелудочной железы от живого родственного донора (рис.10, 11) производилась только больным сахарным диабетом I типа без нефропатических осложнений (изолированная трансплантация поджелудочной железы) или больным сахарным диабетом I типа с ранее пересаженной почкой. Но после первой успешной родственной одномоментной трансплантации почки и поджелудочной железы в Миннеаполисе (1994) операция обрела своих сторонников и успешно внедрена в практику.
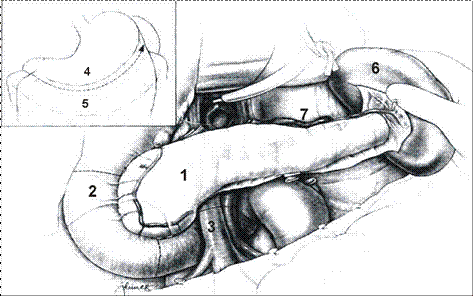
Рисунок 10 - Дистальная резекция поджелудочной железы у живого родственного донора: 1 - культя поджелудочной железы (головка и тело); 2 - селезенка; 3 - культя селезеночной вены у места слияния с верхней брыжеечной веной; 4 - культя селезеночной артерии у места отхождения от чревного ствола.
Рисунок 11 - Трансплантация донорского дистального фрагмента поджелудочной железы:1 - трансплантат; 2 - левая внутренняя подвздошная артерия реципиента, анастомозированная с селезеночной артерией трансплантата; 3 - анастомозы между левой наружной подвздошной веной реципиента и селезеночной веной трансплантата; 4 - выключенная по Roux петля тощей кишки, дренирующая панкреатический проток трансплантата; 5 - мочевой пузырь; 6 - левый мочеточник.
ОСНОВНЫЕ АСПЕКТЫ ТРАНСПЛАНТАЦИИ ТРУПНОЙ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ При трупной трансплантации поджелудочной железы оценка доноров и будущего трансплантата играют первостепенную роль. Мировой опыт позволил сформулировать критерии возможности использования трупного донора поджелудочной железы: • возраст донора до 55 лет (в идеале — до 40 лет); • масса тела донора 30-100 кг (в идеале 30-80 кг); • отсутствие гемодинамических нарушений, адекватная перфузия и оксигенация органов; •нормальный уровень гликозилированного гемоглобина, отсутствие в анамнезе сведений о больных сахарным диабетом; •отсутствие очаговых и диффузных поражений поджелудочной железы. К противопоказаниям для трупного донорства поджелудочной железы относятся: • сахарный диабет I, II типов в анамнезе; • хирургические операции на поджелудочной железе в анамнезе; • тяжелые травмы поджелудочной железы; • острый и хронический панкреатит; • интраабдоминальные гнойно-септические процессы;
• хронический алкоголизм; • длительная гипотензия или гипоксемия с развитием значительных органных (печень, почки) нарушений; • распространенный атеросклероз.
;
Рисунок 12 - Забор поджелудочной железы для трансплантации (линии разрезов): 1-поджелудочная железа; 2-фрагмент двенадцатиперстной кишки; 3-верхняя брыжеечная вена; 4-желудок; 5-поперечно-ободочная кишка;
Для трансплантации забирается сегмент двенадцатиперстной кишки в зоне впадения вирсунгового протока, вся поджелудочная железа и селезенка (рис. 12). Для консервации используется. Трупные доноры поджелудочной железы условно разделяются на: идеальные, хорошие и маргинальные. К маргинальным относятся доноры в возрасте старше 45 лет; с гемодинамической нестабильностью во время взятия трансплантата (доза допамина> 10 мкг/кг/мин или использование двух разных вазопрессоров).
ХИРУРГИЧЕСКАЯ ТЕХНИКА ТРАНСПЛАНТАЦИИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Хирургическая техника трансплантации донорской поджелудочной железы зависит, прежде всего, от вида трансплантата (сегмент поджелудочной железы от живого или трупного донора, целая трупная поджелудочная железа) и от сочетания пересадки поджелудочной железы с пересадкой почки. Хирургическим доступом на операции у реципиента могут служить срединная лапаротомия или внебрюшинные доступ в нижних квадрантах живота справа или слева как при трансплантации почки. Трансплантация донорской поджелудочной железы начинается с реконструкции венозного оттока трансплантата. Выделяют два основных способа венозной реконструкции - портальный и системный. Теоретически, портальная венозная реконструкция более физиологична, так как нивелирует гиперинсулинемию, а системный венозный сброс может иметь недостатки: периферическая гиперинсулинемия и последующее развитие резистентности к инсулину, нарушения липидного обмена. Однако большинство авторов предпочитают именно системный венозный отток, при этом донорская воротная вена анастомозируется с наружной подвздошной, общей или нижней полой венами реципиента. Артериальный анастомоз формируется с наружной или общей подвздошной артерией. К настоящему времени описано несколько методов трансплантации поджелудочной железы в зависимости от методики формирования экзокринного дренажа. Наиболее распространенным считается анастомоз между сегментом 12-перстной кишки и мочевым пузырем, позволяющая осуществлять мониторинг амилазы мочи на основании чего оценивается функция трансплантата и диагностируется криз.
ПОСТТРАНСПЛАНТАЦИОННЫЙ ПЕРИОД Посттрансплантационный период начинается у реципиента после реперфузии трансплантата поджелудочной железы и формирования экзокринного дренажа. Послеоперационное ведение пациента не имеет принципиальных отличий после родственной или трупной ТПЖ и требует в ранние сроки прецизионного наблюдения, а также незамедлительной коррекции нарушений гомеостаза. С первых часов посттрансплантационного периода проводят профилактику сосудистых тромбозов, риск развития которых значительно выше при родственной ТПЖ. В этих целях сразу после завершения сосудистой реконструкции назначают клексан, фраксипарин.
Реакция отторжения и иммуносупрессивная терапия. Реакция отторжения - неизбежное следствие сложного процесса иммунологического и метаболического взаимодействий хозяин - трансплантат в посттрансплантационном периоде. В настоящее время рациональным иммуносупрессивным лечением принято считать обеспечение эффективного терапевтического диапазона введением минимальных доз препаратов, применяется стандартная многокомпонентная иммуносупрессия. Основная цель трансплантации поджелудочной железы - полное выздоровление и медико-социальная реабилитация больных сахарным диабетом. В первую очередь это касается детей с ювенильным сахарным диабетом до развития у них необратимых осложнений: умственной отсталости, слепоты, терминальной хронической почечной недостаточности, окклюзионных поражений артерий нижних конечностей.
ТРАНСПЛАНТАЦИЯ ТОНКОЙ КИШКИ
Показания к трансплантации, особенности отбора реципиентов
Трансплантация тонкой кишки развивалась в мире с некоторым опозданием по сравнению с трансплантацией других органов, однако к настоящему времени стала признанным методом лечения синдрома кишечной недостаточности, которая возникает при длине тонкой кишки менее 40 см от связки Трейтца. Синдром кишечной недостаточности обусловлен неспособностью желудочно-кишечного тракта обеспечить водно-электролитный баланс и необходимый уровень абсорбции питательных веществ ввиду резкого снижения или отсутствия эффективной площади всасывания и пристеночного пищеварения. Особенно остро проблема кишечной недостаточности стоит в педиатрической практике в связи с высокими метаболическими потребностями детского организма. В патогенезе кишечной недостаточности преобладают процессы мальабсорбции и энергетической задолженности клеток, характеризующиеся формированием абсолютного дефицита липидов, гидрокарбонатов, белков, витаминов и других питательных веществ. Это приводит к низкому уровню метаболизма, тотальному дефициту основных макроэргических соединений и резкому водно-электролитному дисбалансу. В клинической картине заболевания преобладает диарея. Показания к трансплантации кишечника: - некротический энтероколит, - странгуляционная кишечная непроходимость, - нарушение кровоснабжения тонкой кишки вследствие тромбоза брыжеечных вен (гиперкоагуляция вследствие мутации фактора V, белка С или S, дефиците антитромбина III и др. причины);
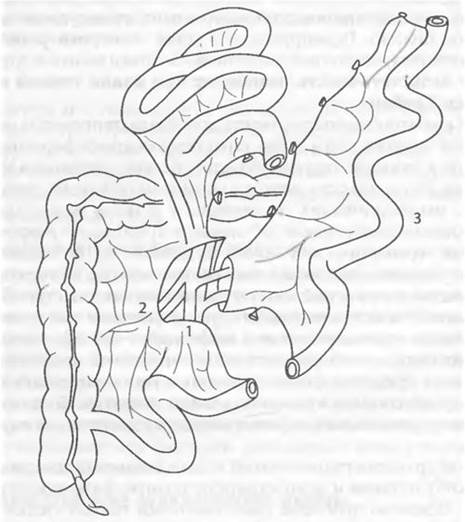
- атрезия кишечника, - гипоплазия кишечника, - отсутствие мышечной оболочки кишки, Противопоказания к трансплантации кишечника: К абсолютным противопоказаниям относят: не поддающиеся медикаментозному лечению нарушения функций жизненно важных органов; наличие инфекционных процессов с выраженной клинической картиной, туберкулез, СПИД, онкологические заболевания вне органа, подлежащего трансплантации, серьезные нарушения психики (в том числе – наркомания). Относительными считаются противопоказания, которые заведомо усложняют техническое выполнение операции. Единственный терапевтический способ продления жизни пациента - полное парентеральное питание. Этот метод имеет существенные недостатки и влечёт за собой риск развития осложнений: катетеризационный сепсис, тромбозы, токсический гепатит, метаболические нарушения, реализующиеся в холелитиаз и нефролитиаз. Постоянная «привязанность» к инфузионно-трансфузионному лечению препятствует активной жизни пациента и его социальной реабилитации. У детей резко замедляются процессы физиологического роста, возникает отставание от сверстников в физическом и интеллектуальном развитии. В течение короткого времени наступает неизбежный дефицит венозного доступа для парентерального питания. При успешной трансплантации тонкой кишки пациенты возвращаются к естественному способу питания и демонстрируют полную физическую и социальную реабилитацию. Варианты трансплантатов тонкой кишки Тонкокишечный трансплантат получают как в результате посмертного донорства, так и от живого родственного донора. В составе мультиорганного изъятия у донора в состоянии смерти мозга тонкую кишку забирают целиком, начиная от связки Трейца до терминального отдела подвздошной кишки, что соответствует бассейнам верхней брыжеечной артерии и вены. Мировой опыт родственного донорства при трансплантации кишки невелик и насчитывает несколько десятков наблюдений. В то же время отсутствие периода ожидания, хорошая или идеальная гистосовместимость пары донор-реципиент и, как следствие, существенно меньший риск отторжения при более щадящем режиме медикаментозной иммуносупрессии делают родственную трансплантацию кишки привлекательной. Получение тонкой кишки от живого донора должно ограничиваться небольшой длиной трансплантата, чтобы не нанести ущерба здоровью донора. В связи с этим представляется логичным использовать живое (родственное) донорство тонкой кишки в педиатрической практике, в основном у детей первых лет жизни. Таким реципиентам для компенсации кишечной недостаточности можно имплантировать участок, не превышающий 1 м, тогда как для взрослого реципиента трансплантат должен быть значительно длиннее, что небезразлично для здоровья донора. Участок кишки, удаляемый у живого донора в качестве трансплантата, можно получить в любом месте тощей или подвздошной кишки, что определяется вариантом кровоснабжения, то есть наличием хорошо сформированной сосудистой аркады, питающейся от одной из ветвей верхней брыжеечной артерии и имеющей отток в один венозный ствол. Чаще всего этим условиям соответствует подвздошная кишка (рис.13).
1 - верхнебрыжеечные артерия и вена; 2 - подвздошно-ободочные артерия и вена; 3 - фрагмент подвздошной кишки, выделенный для трансплантации.
ПРОЦЕДУРА Back-Table Проводится подготовка артерии кишечника, с легированием мелких сосудов и созданием площадки для реимплантации (рис 14).
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 278; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.196.27 (0.035 с.) |