
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Осмос и осмотическое давление
Самопроизвольный переход растворителя через полупроницаемую мембрану, разделяющую раствор и растворитель или два раствора с различной концентрацией растворенного вещества, называется осмосом. Осмос обусловлен диффузией молекул растворителя через полупроницаемую перегородку, которая пропускает только молекулы растворителя. Молекулы растворителя диффундируют из растворителя в раствор или из менее концентрированного раствора в более концентрированный, поэтому концентрированный раствор разбавляется, при этом увеличивается и высота его столба. Количественно осмос характеризуется осмотическим давлением, равным силе, приходящейся на единицу площади поверхности и заставляющей молекулы растворителя проникать через полупроницаемую перегородку. π = СRT, где π – осмотическое давление; С – молярная концентрация раствора; R – универсальная газовая постоянная; T – абсолютная температура. Осмотическое давление измеряется либо в килопаскалях (кПа), тогда R =8,31Дж/(моль∙К); либо в атмосферах, тогда R = 0,082 Для растворов электролитов осмотическое давление (π), ∆ tкип, ∆ tзам превышают значения, рассчитанные по законам Рауля и Вант-Гоффа. Причиной отклонения растворов электролитов от идеальных растворов является распад молекул электролита на ионы. Процесс распада молекул электролита на ионы называется диссоциацией. Для применения законов идеальных растворов к растворам электролитов Вант-Гофф ввёл в соответствующее уравнение поправочный коэффициент i, называемый изотоническим, который показывает, во сколько раз возрастает число частиц в растворе в результате диссоциации: i = Для растворов электролитов формулы, выведенные ранее, принимают вид: ∆tзам = i ККСm ∆tкип = i КЭСm π = i Св RT Для растворов электролитов значение изотонического коэффициента i>1; для неэлектролитов i=1. Количественно электролитическую диссоциацию как равновесный процесс можно охарактеризовать константой диссоциации, определяемой законом действующих масс. Закон действующих масс применим к обратимым реакциям, т.е. к растворам слабых электролитов. Например, для диссоциации уксусной кислоты СН3СООН: СН3СООН ↔ Н+ + СН3СОО– Константа диссоциации КД =
Константа диссоциации зависит от природы растворителя, электролита и температуры, но не зависит от концентрации раствора. Константа диссоциации и степень диссоциации являются количественными характеристиками диссоциации, они связаны между собой соотношением: КД = где С – молярная концентрация электролита. Это соотношение называют законом разведения Оствальда. Если электролит очень слабый, α<<1, его значением в знаменателе можно пренебречь и уравнение принимает вид: КД = α2С или α = В водных растворах сильные электролиты практически полностью диссоциированы (α ~ 100%). Это подтверждено физическими и физико-химическими методами исследования. В отличие от растворов слабых электролитов их растворы содержат значительно большее число ионов. Это приводит к сильному межионному взаимодействию. Как следствие, возникает эффект уменьшения числа ионов, участвующих в химических процессах. Именно поэтому определяемая степень диссоциации сильных электролитов является кажущейся степенью диссоциации, так как она не соответствует реальной степени распада электролита на ионы. Степень диссоциации для сильных электролитов рассчитывается по формуле α = где α – степень диссоциации растворенного вещества; i − изотонический коэффициент; n − число ионов, на которые распадается электролит. Например, для сульфата алюминия: Al2(SO4)3 = 2Al3+ + 3SO42- число ионов n =5. Водородный показатель (рН) В чистой воде или любом водном растворе при постоянной температуре произведение концентраций (активностей) водород- и гидроксид-ионов − величина постоянная, называемая ионным произведением воды. К (H2O) = [H+][OH−] = 10−14 моль2/л2 при 298 К. Растворы, в которых концентрации водород- и гидроксид-ионов равны, называют нейтральными. [H+] = [OH−] = Концентрации гидроксид- и водород-ионов взаимозависимы: зная концентрацию одного из этих ионов, можно рассчитать концентрацию другого иона. В качестве характеристики реакции среды часто используют концентрацию ионов водорода. На практике использование концентраций ионов не очень удобно, поэтому для характеристики среды используют отрицательный десятичный логарифм концентрации (активности) ионов водорода, называемый водородным показателем рН среды: pH = –lg[H+].
Например, если [H+] = 10−3 моль/л (кислая среда), то рН = 3; а когда [H+] = 10−9 моль/л (щелочная среда), то рН=9. В нейтральной среде [H+] = 10−7 моль/л и рН=7. Из этих примеров следует: - в нейтральной среде [H+] = [OH−] = 10−7 моль/л, рН=7; - в кислой среде [H+] > 10−7 моль/л, рН<7; - в щелочной среде [H+] < 10−7 моль/л, рН>7. Если взять отрицательный десятичный логарифм выражения ионного произведения воды, получаем: –lg К (H2O) = –lg[H+] – lg[OH−] = – lg10−14 рН + рОН = 14.
|
||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 479; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.173.227 (0.007 с.) |
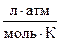 .
.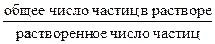 .
.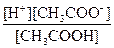 .
.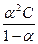 ,
,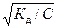 .
.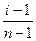 ,
, =
= 



