Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Использование реакций осаждения в качественном анализе
В качественном химическом анализе для разделения и обнаружения ионов широко используются химические реакции всех типов, протекающие в растворах: реакции осаждения и комплексоообразования, кислотно-основные и окислительно-восстановительные. Реакции осаждения очень часто применяют для обнаружения различных ионов. Образование осадков – это один из основных аналитических эффектов, именно поэтому большинство качественных реакций является реакциями осаждения. Например, ионы Mg2+ обнаруживают по выпадению белого аморфного осадка Mg(OH)2: Mg2+ + 2OH– = Mg(OH)2↓, а ионы Ba2+ – по выпадению желтого мелкокристаллического осадка BaCrO4: 2Ba2+ + Cr2O72– + H2O = 2BaCrO4↓ + 2H+. Важную роль играют реакции осаждения и при разделении ионов. Действительно, основа любой аналитической классификации – это осадительное действие различных реагентов на определённые группы ионов. Например, карбонат аммония (NH)4CO3 осаждает катионы II аналитической группы, что позволяет отделить их от катионов I аналитической группы. Используя реакции осаждения, проводят также разделение ионов внутри аналитических групп. Например, при обнаружении ионов Na+ в присутствии ионов Mg2+ сначала отделяют ионы Mg2+, осаждая их щелочью.
Использование кислотно-основных реакций в качественном анализе Кислотно-основные реакции также можно использовать для обнаружения и разделения ионов, хотя с этой целью они применяются реже, чем реакции осаждения. Например, для обнаружения иона NH4+ существует специфическая кислотно-основная реакция: NH4+ + ОН– = NH3 + Н2О. Одна из аналитических классификаций катионов – кислотно-основная – базируется на реакциях кислотно-основного взаимодействия, с помощью которых можно разделить различные группы катионов. Некоторые разделения внутри групп проводят, используя различия в кислотно-основных свойствах соединений. Например, при действии избытка щелочи на катионы III аналитической группы ионы Zn2+ и Al3+ вследствие амфотерности их гидроксидов остаются в растворе в виде ионов [Zn(OH)4]2– и [Al(OH)6]3–, в то время как другие катионы выпадают в осадок в виде малорастворимых гидроксидов (cм. приложение): Fe2+ + 2OH– = Fe(OH)2↓, Fe3+ + 3OH– = Fe(OH)3↓, Mn2+ + 2OH– = Mn(OH)2↓, Cr3+ + 6OH– = [Cr(OH)6]3–, Zn2+ + 4OH– = [Zn(OH)4]2–, Al3+ + 6OH– = [Al(OH)6]3–.
Гораздо чаще кислотно-основные реакции используют для регулирования значения рН растворов при разделении и обнаружении. Ход многих аналитических химических реакций зависит от рН среды, поэтому для поддержания необходимого значения рН используют буферные растворы. В особенности это касается следующих реакций: 1. с участием анионов слабых кислот или катионов слабых оснований. Например, при действии K2Cr2O7 на ионы Ba2+ осадок BaCrO4 может не образоваться, если не поддерживать рН с помощью ацетатного буфера; 2. цветных качественных реакций с органическими реагентами. Например, при обнаружении ионов Al3+ капельной реакцией с ализарином необходимо, помимо анализируемого раствора и реактива, нанести на полоску фильтровальной бумаги HCl и поместить её над ёмкостью с конц. NH4OH (первый компонент аммиачного буфера). При взаимодействии кислоты и слабого основания образуется второй компонент буфера – NH4Cl, и тем самым создаются необходимые условия для протекания цветной реакции. Кроме того, кислотно-основные реакции используют для растворения проб, поскольку многие вещества, не растворимые в воде, растворяются в кислотах или щелочах.
Использование окислительно-восстановительных реакций Существует значительное количество окислительно-восстановительных реакций (ОВР), которые успешно применяются для обнаружения ионов. Например, ионы Cr3+ сначала окисляют до хромат-ионов CrO42–, а затем проводят реакцию с бензидином. При этом хромат-ионы окисляют органический реагент с образованием продукта синего цвета – «бензидиновой сини»: 2Cr3+ + 3H2O2 + 10OH– = 2CrO42– + 8H2O, CrO42– + H2N–(C6H4)2–NH2 + Н+ → Cr3+ + «бензидиновая синь»+H2O. Используя ОВР, можно обнаружить многие анионы: NO2– реакцией с реактивом Грисса, I– реакцией с хлорной водой: 2I– + Cl2 = I2 + 2Cl–. Поскольку при изменении степени окисления меняются свойства ионов, то ОВР нашли применение также для разделения ионов. Например, если подействовать на смесь катионов III аналитической группы раствором Н2О2 в щелочной среде, то ионы Cr3+ окислятся до хромат-ионов CrO42– и останутся в растворе, а ионы Fe2+, Fe3+, Mn2+ перейдут в осадок в виде гидроксидов Fe(OH)3 и MnO(OH)2. Используя окислительно-восстановительную реакцию
2NO2– + 2H+ + CO(NH2)2 = CO2 + 2N2 + 3H2O, можно легко удалить ионы NO2–, которые мешают обнаружению нитрат-ионов NO3– реакцией с дифениламином. Очень часто без ОВР невозможно обойтись при растворении или разложении твёрдых проб. Так, если образец не растворяется в кислотах или щелочах, его приходится растворять в окисляющих реагентах (конц. HNO3, конц. H2SO4, царская водка) или сплавлять с такими реагентами (Na2O2, нитриты, пиросульфаты).
Использование реакций комплексообразования Возможность использования реакций комплексообразования в качественном анализе обусловлена возникновением и интенсивностью аналитических эффектов, а также большой избирательностью реакций этого типа. Комплексные соединения обладают рядом свойств, ценных для химика-аналитика: 1. ионы центрального атома и лигандов, находясь в составе комплекса, практически отсутствуют в растворе в свободном виде, поэтому их не всегда удаётся обнаружить. Это свойство широко используется для разделения и маскирования ионов. Например, при обнаружении ионов Mn2+ в виде малиново-розового соединения H[Mn(C2O4)2] ионы Fe3+, мешающие своей окраской, легко маскируются фторид-ионами F– за счёт образования бесцветного комплекса [FeF6]3–: Fe3+ + 6F– = [FeF6]3–; 2. комплексные соединения часто обладают характерными окрасками или малой растворимостью, на чём основаны многие реакции обнаружения. Например, ионы NH4+ образуют с реактивом Несслера нерастворимое комплексное соединение бурого цвета: NH4+ + 2[HgI4]2– + 4OH– = [NH2Hg2O]I ↓ + 7 I– + 3H2O, а ионы Mn2+ можно надёжно обнаружить по образованию малиново-розового комплексного соединения H[Mn(C2O4)2] при действии H2C2O4 на осадок MnO(OH)2: 2MnO(OH)2↓ + 5H2C2O4 = 2H[Mn(C2O4)2] + 2СО2 + 6H2O. Таким образом, реакции комплексообразования, как и реакции всех других типов, широко используют для обнаружения и разделения, причём разделение часто проводят за счёт селективного осаждения или маскирования. Кроме того, реакции комплексообразования применяют для подготовки проб к анализу (разложение твёрдых веществ с помощью конц. HF, конц. HCl, царской водки), а также для перевода осадков в раствор, например AgCl↓ + 2NH4OH = [Ag(NH3)2]Cl + 2H2O. Коллоидообразование и его роль в качественном анализе Механизм образования осадков достаточно сложен и включает ряд стадий, которые протекают последовательно, начиная с момента смешения растворов (рис. 1). Если выполняется условие образования осадка ПС > ПР, то через определённое время после смешения растворов (индукционный период) начинается зародышеобразование. В результате образуются первичные кристаллы осадка – зародыши. Затем идёт агрегация – соединение зародышей в более крупные агрегаты. При этом образуется коллоидный раствор, содержащий частицы осадка размером 10–5–10–7 см. Частицы продолжают укрупняться. Одновременно с агрегацией происходит ориентация диполей:
В результате этих процессов начинается осаждение. Если скорость ориентации (V ор) больше скорости агрегации (V агр), то выпадает кристаллический осадок, а если скорость агрегации больше скорости ориентации, то аморфный.
Рис. 1. Механизм образования осадков
Таким образом, коллоидообразование – это промежуточная стадия образования любого осадка. Процесс перехода коллоидного раствора в осадок называется коагуляцией, а обратный ему процесс – пептизацией. Свойства коллоидных растворов отличаются от свойств истинных растворов и суспезий – растворов, содержащих твёрдые взвешенные частицы. Сравнительная характеристика свойств, важных для химика-аналитика, приведена в табл. 1.
Таблица 1 Сравнительная характеристика свойств
Отсюда следует, что в случае коллоидообразования осадок не выпадает, его нельзя отделить от раствора фильтрованием или центрифугированием, в то время как большинство разделений в качественном анализе проводится именно с использованием реакций осаждения. Следовательно, коллоидообразование играет отрицательную роль в анализе и химику-аналитику необходимо предпринимать специальные меры с целью коагуляции коллоидных растворов. Коагуляции способствуют: 1. наличие в растворе сильного электролита; 2. нагревание раствора; 3. перемешивание раствора. Например, осаждение катионов III группы в виде сульфидов, которые склонны к образованию коллоидных растворов, ведут из горячих растворов при непрерывном перемешивании и в присутствии электролита-коагулятора NH4Cl. Однако в ряде случаев коллоидообразование играет положительную роль в качественном анализе, т. к. при этом увеличивается чувствительность реакций и становится возможным обнаружение следовых количеств веществ. Например, малые количества иона NH4+ невозможно открыть реакцией со щёлочью, но можно обнаружить по жёлто-бурому окрашиванию коллоидного раствора, полученного при действии на пробу реактива Несслера.
Органические аналитические реагенты и их применение Органические реагенты (ОР) – это органические соединения, вступающие в реакции с веществами неорганической или органической природы с образованием продуктов, обладающих аналитическими свойствами. ОР широко используют в аналитической химии благодаря ряду их преимуществ перед неорганическими реагентами: 1) высокая избирательность действия. По этой причине многие ОР являются специфическими реагентами на неорганические ионы. Например, реактив Грисса является специфическим ОР на нитрит-ионы NO2–; 2) высокая чувствительность реакций с участием ОР, что позволяет обнаружить вещество в очень малых концентрациях. Высокая чувствительность и селективность органических реагентов обусловлены их высокой молярной массой, низкой растворимостью в воде комплексов органических реагентов с ионами металлов, а также интенсивной окраской таких комплексов. В качественном анализе органические реагенты применяют для: А) обнаружения с использованием реакций осаждения и реакций, протекающих с образованием окрашенных продуктов; Б) маскирования мешающих ионов с целью подавления побочных реакций аналитического реагента с посторонними ионами, присутствующими в анализируемом растворе. Обнаружение катионов и анионов осуществляется с помощью органических реагентов, образующих с открываемыми ионами комплексные соединения с интенсивной характерной окраской. Наиболее часто для этой цели используют ализарин (реагент на ион Al3+), дифенилкарбазид (реагент на ион Cr3+), диметилглиоксим (реагент на ион Ni2+), дитизон (реагент на ион Zn2+), дифениламин (реагент на ион NO3-) и др. Маскирование проводят, используя органические комплексообразующие реагенты. Например, Fe3+ мешает определению никеля с диметилглиоксимом в аммиачных растворах из-за осаждения гидроксида Fe(ОН)3. Для маскирования ионов Fe3+ к анализируемому раствору добавляют винную, щавелевую или лимонную кислоту, которые связывают их в бесцветные растворимые комплексы. Кроме органических реагентов, в качественном анализе применяют также органические растворители. Их используют для приготовления растворов органических реагентов и проведения экстракции. Например, раствор дитизона для обнаружения ионов Zn2+ готовят на хлороформе или четырёххлористом углероде. При экстракции вещество переходит из одной жидкой фазы (чаще всего – водного раствора) в другую (органическую), которая не смешивается с ней. Примером использования экстракции в качественном анализе является реакция обнаружения иодид-ионов: 2I– + Cl2 = I2 + Cl–. Образовавшийся продукт реакции I2 плохо растворяется в воде, поэтому аналитический эффект реакции – появление жёлто-бурой окраски раствора выражен очень слабо. Однако если провести последующую экстракцию I2 в органическую фазу (хлороформ, бензол), то слой органического растворителя приобретает характерную для I2 интенсивную фиолетово-розовую окраску. Причина заключается в том, что неполярное вещество I2 лучше растворяется в неполярном органическом растворителе, чем в полярном (воде).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 3278; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.202.187 (0.035 с.) |



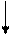 ПС > ПР
ПС > ПР
 Зародышеобразование
Зародышеобразование
 Первичные кристаллы (зародыши)
Первичные кристаллы (зародыши)