
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическая реакция (эксергетический анализ)
(горение метана)
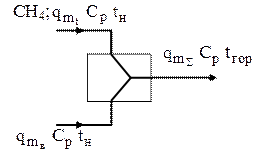
В качестве химической реакции рассматривается процесс горения газообразного топлива в топке. Объект работает в непрерывном и стационарном режиме. В топку подаются потоки газообразного топлива воздуха. Топливо сгорает полностью. Побочные продукты не образуются. Давление в системе остается постоянным. Расходы сред поддерживаются постоянными. Теплоемкости сред зависят от температуры. Температура подаваемых в топку потоков одинакова и близка к температуре окружающей среды. Исходная смесь поступает в печь при температуре 25°С и давлении p ≈ 0,1 МПа и сгорает полностью до диоксида углерода и парообразной воды На рис. представлена расчетная схема объекта.
Рис. Расчетная схема топки Материальный баланс позволяет определить количество используемых веществ в процессе, связать их расходы с расходом топлива и определить поэлементный состав исходной смеси и продуктов горения.
Определение количества воздуха, необходимого для сжигания газообразного топлива Расчет ведется по стехиометрическому уравнению химической реакции. По стехиометрии реакции:
CH4 + 2О2 = СО2 + 2Н2О (63)
на 1 моль CH4 необходимо израсходовать 2 моль О2, а с учетом избытка воздуха 2·(1+a) молей. Количество азота на 1 моль CH4, поступающего с воздухом, равно 4(1+a) молей N2 (содержание азота в воздухе, примерно в 4 раза больше, чем кислорода). В результате СН4 + 2×(1+a)×О2 + 4×(1+a)×N2 ——>СО2 + 2×H2О + 2×a×О2 + 4×(1+a)×N2. (64) Мольная доля компонента в исходной газовой смеси будет равна:
Мольная доля компонента в продуктах горения:
Состав смеси на входе в топку и топочных газов приведен в таблице.1.
Таблица 6 Мольные доли веществ в исходной смеси И в продуктах горения
Температура процесса горения метана определяется из уравнения теплового баланса топки, для адиабатического режима горения и отсутствия потерь. Процесс непрерывный и стационарный. топка представляет собой реактор идеального перемешивания. Для расчета температуры горения целесообразно перейти к массовым единицам. В соответствии со стехиометрическим уравнением химической реакции теоретически необходимое количество воздуха для сжигания одного килограмма топлива (метана) равно b – теоретически необходимое количество воздуха. Это табличные величины. Их значения приведены в справочной литературе. Для метана b = 18,0 коэффициент избытка a* массовый, не менее 0,2. Тепловой баланс (при отсутствии тепловых потерь):
Материальный баланс по установке:
Подставляем соотношение () в уравнение ():
Если теплоемкость газовой смеси и тепловой эффект не зависят от температуры
то температуру продуктов горения можно определить по уравнению:
Это уравнение позволяет оценить влияние коэффициента избытка воздуха на температуру горения. Увеличение коэффициента избытка воздуха приводит к снижению температуры горения топлива. Это позволяет регулировать температуру горения в зависимости от требований к этому параметру. Теперь можно определить потоки энергии приходящие и покидающие объект и перейти к построению диаграммы Сенкея. Для этого необходимо задаться величиной внешней поверхности топки, формой этой поверхности и толщиной и материалом тепловой изоляции.
Рис. Диаграмма Сенкея для процесса горения.
Диаграмма Сенкея для топки аналогична диаграмме смешения потоков. Потери энергии обусловлены рассеянием энергии в окружающее объект пространство. Вторичных потоков нет, т.к. продукты горения являются энергоносителем, используемым в дальнейшем, как высокотемпературный энергоноситель в технологических установках. Эксергетический анализ. При горении топлива, осуществляемого при постоянном общем давлении газовой смеси, происходит изменение состава смеси как за счет образования новых веществ и расходования исходных, так и за счет перехода компонентов из одного потока в другой. Поэтому при определении эксергии потоков необходимо учитывать эксергию образования всех веществ, принимающих участие в процессе. Эта величина не для всех компонентов равна нулю. Значения эксергий образования веществ приведены в табл.2. При отсутствии справочной информации величину эксергии образования можно определить при помощи уравнения:
Значения эксергии при параметрах окружающей среды приведенны в таблице 3. Потери эксергии при осуществлении процесса составят:
где е0 – эксергия чистого вещества при стандартных температуре и давлении по отношению к стандартизированной окружающей среде (определяется по таблице); Δе0-1 – изменение эксергии чистого вещества при переходе от стандартных температуры и давления к конкретным условиям (концентрации, температуре, давлению и агрегатному состоянию):
Поскольку предполагается, газовая смесь представляет собой идеальный газ, то
Поскольку предполагается, газовая смесь представляет собой идеальный газ, то
Эксергия компонентов на входе в печь равна соответственно (температура смеси на входе незначительно отличается от стандартной и поэтому можно пренебречь изменением теплоемкости от температуры): для кислорода:
для азота:
для метана:
При расчете изменения эксергии их от Т0, Р0 к заданным условиям принимают, что оно равно сумме изменения эксергии при изотермическом расширении при начальной температуре и при изобарическом нагревании от исходной до конечной температуры. Расчет ведется по уравнению ().
Эксергия компонентов на выходе из печи (температура смеси на выходе из печи сильно отличается от стандартной и поэтому необходимо учитывать изменение теплоемкости от температуры):
эксергия кислорода:
эксергия паров воды:
эксергия углекислого газа:
эксергия азота:
В итоге эксергия дымовых газов, равна:
Потери эксергии в процессе горения будут равны разнице эксергии потоков на входе и эксергии потоков на выходе:
Таблица 7
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 698; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.172.146 (0.02 с.) |
 ;
; 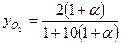 ;
; 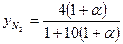 (65)
(65) ;
;  ;
;  ;
; 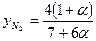 (66)
(66)
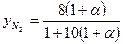


 . (67)
. (67)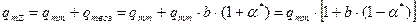 . (68)
. (68)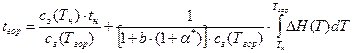 . (69)
. (69)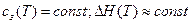 ,
,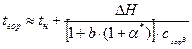 . (70)
. (70)
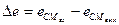 (71)
(71)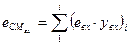 (72)
(72) , (73)
, (73) . (74)
. (74)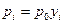 . Уравнение () примет вид:
. Уравнение () примет вид: (75)
(75) (78)
(78) (79)
(79)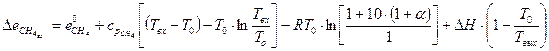 (80)
(80) продуктов сгорания при переходе
продуктов сгорания при переходе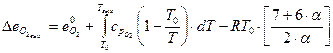 (81)
(81) (82)
(82) (83)
(83) (84)
(84)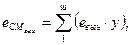 (85)
(85) (86)
(86) При расчете изменения эксергии ΔеО2 продуктов сгорания при переходе их от Т0, Р0 к заданным условиям принимают, что оно равно сумме изменения эксергии при изотермическом расширении при 25 °С и при изобарическом нагревании от 25 до 1800 °С. Результаты расчетов приведены в таблице. Таким образом, несмотря на полное отсутствие тепловых потерь потери эксергии при сгорании достаточно велики, и составляют треть от общего ее «запаса».
При расчете изменения эксергии ΔеО2 продуктов сгорания при переходе их от Т0, Р0 к заданным условиям принимают, что оно равно сумме изменения эксергии при изотермическом расширении при 25 °С и при изобарическом нагревании от 25 до 1800 °С. Результаты расчетов приведены в таблице. Таким образом, несмотря на полное отсутствие тепловых потерь потери эксергии при сгорании достаточно велики, и составляют треть от общего ее «запаса».


