
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Черновую медь рафинируют для удаления вредных примесей, проводят огневое, а затем электролитическое рафинирование.
Сущность огневого рафинирования черновой меди заключается в окислении примесей, имеющих большее сродство к кислороду, чем медь, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99…99,5%. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования. Электролитическое рафинированиепроводят для получения чистой от примесей меди (99,95% Электролиз проводят в ваннах, где анод изготавливают из меди огневого рафинирования, а катод – из тонких листов чистой меди. Электролитом служит водный раствор При пропускании постоянного тока анод растворяется, медь переходит в раствор, а на катодах разряжаются ионы меди, осаждаясь на них слоем чистой меди. Примеси осаждаются на дно ванны в виде шлака, который идёт на переработку с целью извлечения металлов. Катоды выгружают через 5…12 дней, когда их масса достигнет 60…90 кг. Их тщательно промывают, а затем переплавляют в электропечах. Медь по чистоте подразделяется на марки: М0 (99,95% Cu), М1 (99,9%), М2(99,7%), М3 (99,5%), М4 (99%). Производство алюминия. Основным сырьем для производства алюминия служат бокситы, содержание 32-60% глинозема Al2O3. К важнейшим алюминиевым рудам относятся также алунит и нефелин. Алюминий получают из оксида алюминия Al2O3 электролитическим методом. Используемый для этого оксид алюминия должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Очищенный Al2O3 получают переработкой природного боксита. Основное исходное вещество для производства алюминия – оксид алюминия. Он не проводит электрический ток и имеет очень высокую температуру плавления(около 2050С), поэтому требуется слишком много энегрии. Глинозем хорошо расплавляется в расплавленном криолите – минерале состава AlF3.3NaF. Этот расплав и подвергают электролизу при температуре всего около 950C на алюминиевых производствах. Запасы криолита в природе незначительны, поэтому был создан синтетический криолит, что существенно удешевило производство алюминия. Гидролизу подвергают расплавленную смесь криолита Na3[AlF6] и оксида алюминия.Смесь содержащая около 10 весовых процентов Al2O3, плавится при 960 C и обладает электропроводностью, плотностью и вязкостью, наиболее благоприятствующими проведения процесса. Для дополнительного улучшения жтих характеристик в состав смеси входят добавки AlF3, CaF2, MgF2. Благодаря этому проведение электролиза оказывается возможным при 950 С. Электролизер для выплавки алюминия представляет собой железный кожух, выложенный изнутри огнеупорным кирпичем. Его дно, собранное из блоков спрессованного угля, служит катодом. Аноды(один или несколько) располагаются сверху: это – алюминиевые каркасы, заполненные угольными брикетами. На современных заводах электролизеры устанавливаются сериями(каждая серия состоит из 150 и большего числа электролизеров. При электролизе на катоде выделяется алюминий, а на аноде – кислород. Алюминий обладающий большей плотностью, чем исходный расплав, собирается на дне электролизера, откуда его периодически выпускают. По мере выделения металла, в расплав добавляют новые порции оксида алюминия. Выделяющийся при электролизе кислород взаимодействует с углеродом анода, который выгорает, образуя СО и CO2.
Производство титана. Наиболее распространенным сырьем для производства титана служит ильменитовый концентрат, выделяемый при обогащении титаномагнетитовых железных руд, в котором содержится, %: 40-60 ТiO2, ~30 FeO, ~20 Fe2O3 и 5-7 пустой породы(СаО, MgO, Al2O3,SiO2), титан в виде минерала ильменита FeO ` TiO2. Технологический процесс производства титана из ильменитового концентрата состоит из следующих основных стадий: получение титанового шлака восстановительной плавкой, получение тетрахлорида титана хлорированием титановых шлаков, производство титана(губки, порошка) восстановлением их тетрахлорида. Кроме этого зачастую проводят рафинирование полученного титана и иногда переплав для получения титана в виде слитков. Восстановительная плавка ильменитового концентрата имеет целью перевести TiO2 в шлак и отделить оксиды железа путем их восстановления. Плавку проводят в электро- дуговых печах. Сначала загружают концентрат и восстановитель(кокс, антрацит), их нагревают до ~1650 С. Основной реакцией является: FeO *TiO2+C=Fe+TiO2+CO. Из восстановленного и науглероживающегося железа образуется чугун, а оксид титана переходит в шлак, который содержит 82-90% TiO2(титановый шлак). Получение тетрахлорида титана TiCl4 осуществляют воздействием газообразного хлора на TiO2 при температурах 700-900 С, при этом протекает реакция: TiO2+2Cl2+2C=TiCl4+2CO. Исходным титаносодержащим сырьем является титановый шлак. Хлорирование осуществляют в шахтных хлораторах. Шахтный хлоратор – это футерованный цилиндр диаметром до 2 и высотой до 10 м, в который сверху загружают брикеты из измельченного титанового шлака и снизу вдувают газ магниевых электролизеров, содержащий 65-70% Cl2. Взаимодействие TiO2 брикетов и хлора идет с выделением тепла, обеспечивающего необходимые для процесса температуры (~ 950 C в зоне реагирования). Образующийся в хлораторе газообразный TiCl4 отводят через верх, остаток шлака от хлорирования непрерывно выгружают снизу. Солевой хлоратор для производства титана представляет собой футерованную шамотом камеру, наполовину заполненную отработанным электролизом магниевых электролизеров, содержащим хлориды калия, натрия, магния и кальция. Сверху в расплав загружают измельченные титановый шлак и кокс, а снизу вдувают хлор. Температура 800-850 С, необходимая для интенсивного протекания хлорирования титанового шлака в расплаве, обеспечивается за счет тепла протекающих экзометрических реакций хлорирования. Газообразный TiCl4 из верха хлоратора отводят на очистку от примесей, отработанный электролит переодически заменяют. Основное преимущество солевых хлораторов состоит в том, что не требуются дорогостоящее брикетирование шихты. Отводимый из хлораторов газообразный TiCl4 содержит пыль и примеси газов – СО, CO2 и различные хлориды, поэтому его подвергают сложной, проводимой несколько стадий очистке. Производство титана металлотермическое восстановление титана из тетрахлоридаTiCl4 проводят магнием или натрием. Для восстановления магнием служат аппараты, представляющие собой помещенную в печь герметичную реторту высотой 2-3 м из хромо-никелевых сталей. После ввода в рагозретую до ~ 750 C реторту магния в нее подают тетрахлорид титана. Восстановление титана магнием TiCl4+2Mg=Ti+2MgCl2 идет с выделением тепла, поэтому электронагрев печи отключают и реторгу и обдувают воздухом, поддерживая температуру в пределах 800-900 С; ее регулируют также скоростью подачи тетрахлорида титана. За один цикл восстановления длительностью 30-50 ч получают 1-4 т титана в виде губки(твердые частицы титана спекаются в пористую массу- губку). Жидкий MgCl2 периодически выпускают. Титановая губка впитывает много MgCl2 и магния, поэтому после окончания цикла восстановления проводят вакуумную отгонку примесей. Реторту после нагревания до ~1000 С и создания в ней вакуума выдерживают в течении 35-50 ч; за это время примеси испаряются. Иногда отгонку примесей из губки проводят после ее извлечения из реторты. Восстановление титана натрием проводят в аппаратах, схожих с применяемыми для магниетермического восстановления. В реторте после подачи TiCl4 и жидкого натрия идет реакция восстановления титана: TiCl4+4Na=Ti+4 NaCl. Температура в 800-880 С поддерживается за счет выделяющегося при восстановлении тепла. Полученную твердую массу, содержащую 17% Ti и 83% NaCl извлекают из реактора, измельчают и выщелачивают из нее NaCl водой, получая титановый порошок.Рафинирование титана. Для получения титана высокой чистоты применяют так называемый иодидный способ, при котором используется реакция Ti+2I2=TiI4. При температуре 100-200 с реакция протекает в направлении образования TiI4, а при температуре 1300-1400 С – в обратном направлении. Титановую губку (порошок) загружают в специальную репорту, помещаемую в термостат, где температура должна быть на уровне 100-200 С, и внутри нее специальным приспособлением разбивает ампулу с иодом. Через несколько натянутых в репорте титановых проволок пропускают ток, в результате чего они накаливаются до 1300-1400 С. Пары иода реагируют с титаном губки по реакции Ti+2I2-TiI4. ПолученныйTiI4 разлагается на раскаленной титановой проволоке, образуя кристаллы чистого Tiи освобождая иод. Пары Иода вновь вступают во взаимодействие с рафинируемым титаном, а на проволоке постепенно наращивается слой кристаллизующегося титана. Процесс заканчивают при толщине получаемого прутка титана 25-30 мм. Получаемый металл содержит 99,9-99,99% Ti, в одном аппарате получают ~ 10 кг чистого титана в сутки. Производство титановых слитков. Для получения ковкого Tiв виде слитков губку переплавляют в вакуумной дуговой печи. Расходуемый(плавящийся) электрод получают прессованием губки и титановых отходов. Жидкий титан затвердевает в печи в водоохлаждаемом кристаллизаторе.
|
||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 312; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.161.77 (0.007 с.) |
 ).
).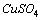 (10…16%) и
(10…16%) и  (10…16%).
(10…16%).


