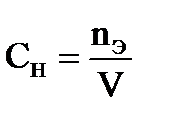Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 4. Влияние одноименного иона на степень диссоциации слабого электролита (смещение равновесия диссоциации)
А. Напишите уравнения диссоциации: NH4OH ______________________________________________________________________________ NH4Cl _____________________________________________________________________________________
КД (NH4OH) = ______________________________.
При добавлении фенолфталеина к раствору аммиака наблюдается _______________________окрашивание. В присутствии хлорида аммония цвет раствора __________________________. Вывод: (как изменяется степень диссоциации слабого электролита исходя из принципа Ле Шателье и константы диссоциации)__________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ____________________________________________________________________________________. Б. Напишите уравнения диссоциации CH3COOH ___________________________________________________________________________ CH3COONa __________________________________________________________________________
КД (CH3COOH) = _____________________________________________________
При добавлении метилового оранжевого к раствору уксусной кислоты наблюдается _______________окрашивание. В присутствии ацетата натрия цвет раствора ___________________ ___________________________________________________________________________________. Вывод: (как изменяется степень диссоциации слабого электролита исходя из принципа Ле Шателье и константы диссоциации)___________________________________________________________________ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № 3
На тему: «Приготовление водных растворов»
Выполнил студент группы БВВ-12-01 ______________ Трясцина Д.В. (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ Сухарева И.А. (Подпись, дата) Цель работы: - освоить навыки приготовления растворов заданной концентрации и методики их количественного анализа. Теоретическая часть Количественный состав растворов выражается концентрацией. Концентрацией раствора называется___________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________.
Массовая доля растворённого вещества – ___________________________________________ ___________________________________________________________________________________
где ω (Х) – ____________________________________________________________________ m(X) –______________________________________________________________________________ m – ________________________________________________________________________________. Молярная концентрация - ________________________________________________________ ____________________________________________________________________________________
где n2 – _________________________________________________________________________ V − ________________________________________________________________________________. Нормальная концентрация - _____________________________________________________ _____________________________________________________________________________________
где nЭ – _________________________________________________________________________ V − ________________________________________________________________________________. Моляльная концентрация – _______________________________________________________ _____________________________________________________________________________________
где n2 – __________________________________________________________________________ mраствора − ____________________________________________________________________________. Мольная доля – ______________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________ Экспериментальная часть Опыт 1. Приготовление раствора заданной концентрации Приготовьте 250 мл ________________ % раствора хлорида натрия из концентрированного раствора и воды. Ход работы: 1. Определите ареометром плотность исходного концентрированного раствора: ____________________________________________________________________________________. 2. Определите по таблице процентную концентрацию исходного раствора, отвечающую найденной плотности (если величина процентной концентрации не числится в таблице, то необходимо воспользоваться методом интерполяции): _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. 3. Определите плотность приготовляемого _________ % раствора хлорида натрия по таблице: ___________________________________________________________________________ ________. 4. Вычислите вес приготовляемого раствора крестом: ______ (_____ - 0) …. 0 _____ (______ - ____)
5. Рассчитайте, какое весовое количество исходного раствора хлорида калия нужно для приготовления заданного раствора: ________________________________________________________________________________
________________________________________________________________________________. 6. Пересчитайте полученную величину навески на объем: _______________________________________________________________________________. 7. Рассчитайте нужный объем воды: _______________________________________________________________________________. 8. Отмерьте мерным цилиндром вычисленные объёмы концентрированного раствора и воды, слейте их, тщательно перемешайте жидкость и определите ареометром плотность полученного раствора: ____________________________________________________________________________________ Определите расхождение найденной и заданной плотностей в процентах: _____________________________________________________________________________________ Вывод: (укажите относительную ошибку эксперимента)____________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № 4
На тему: «Ионообменные реакции»
Выполнил студент группы БПС-12-01 ______________ Шагигалин Г.Ю. (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________Шаймарданов Н. М. (Подпись, дата) Цель работы: - изучить признаки протекания ионообменных реакций.
Теоретическая часть Ионообменные реакции – это _____________________________________________________ ____________________________________________________________________________________. Ионообменные реакции могут протекать в _________________ и ____________________ направлениях. Ионообменные реакции протекают в растворах электролитов в следующих случаях: 1. если ___________________________________________________________________________ 2. если ___________________________________________________________________________ 3. если ___________________________________________________________________________ 4. если ___________________________________________________________________________. В уравнениях реакции в молекулярном виде записываются: 1. ________________________________, например, ________________________________________ 2. ________________________________, например, ________________________________________ 3. ________________________________, например, ________________________________________. В уравнениях реакции в виде ионов записываются: 1. ______________________________, например, __________________________________________ 2. ______________________________, например, __________________________________________ 3. ______________________________, например, __________________________________________. Количественной характеристикой растворимости труднорастворимых веществ является ___________________________________________________ или ____________________________ ____________________________________________________________________________________. В насыщенном растворе при данной температуре ПР есть ____________________ величина. Для системы: AmBn=Am++Bn- ПРAmBn = __________________________________ По значению ПР можно судить о возможности образования осадка: 1. если ПРтабл > произведения концентрации ионов в данном растворе, то осадок _________________________________________________________________________________ 2. если ПРтабл < произведения концентрации ионов в данном растворе, то осадок __________________________________________________________________________________ 3. если ПРтабл = произведению концентрации ионов в данном растворе, то _________________________________________________________________________________.
Экспериментальная часть Заполните таблицу (запишите уравнения реакций в молекулярном, полном ионно-молекулярном и сокращенном ионно-молекулярном формах, запишите наблюдения и выводы).
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № 5
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 407; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.89.85 (0.025 с.) |
 ,
,