
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рівняння адіабати ідеального газу
У ході будь-якого оборотного процесу газ підкоряється своєму рівнянню стану. Для ідеального газу це рівняння має вид
Бувають процеси, у ході яких газ, крім рівняння стану, підкоряється деякій додатковій умові, що визначає характер процесу. Додаткова умова може полягати, наприклад, у тому, що один з параметрів стану залишається постійним. Якщо постійний тиск газу, процес називають ізобаричним. У цьому випадку додаткова умова має вид
що називається рівнянням ізотерми ідеального газу, а крива, обумовлена цим рівнянням, називається ізотермою. Процес, що протікає без теплообміну із зовнішнім середовищем, називається адіабатичним. Запишемо рівняння першого закону термодинаміки, і підставимо в нього вираз для енергії (21.7) і роботу у виді
При відсутності теплообміну із зовнішнім середовищем
Візьмемо диференціал від обох сторін рівняння (21.16), отримаємо
Помножимо рівняння (21.19) на відношення
де
Ліву частину цього рівняння можна уявити у вигляді
Ми отримали рівняння адіабати ідеального газу в змінним Запишемо рівняння (21.23) у вигляді
(сталі З рівняння (21.24) випливає, що при адіабатичному розширенні ідеальний газ охолоджується, а при стиску нагрівається.
Диференціювання рівняння адіабати (21.23) дає, що
Таким чином, тангенс кута нахилу дотичної у адіабати в
Послідовність виконання роботи 1. Ознайомтесь із робочою установкою (на рисунку 21.2 наведено інтерфейс програми). 2. Встановіть початкове значення температури 3. Натисніть мишею кнопку «Старт» на екрані і спостерігайте за переміщенням поршня на лівій картинці моделі і переміщення точки через графік теоретичної адіабати. Спробуйте зупиняти процес натисканням клавіші «Стоп». Наступний запуск процесу здійснюється повторним натисканням кнопки «Старт».
5. Встановіть нове значення температури
Таблиця 21.1 – Початкові значення температури
Таблиці 21.2,3 – Результати вимірювань
Обробка результатів 1. Побудуйте на одному рисунку графіки залежностей тиску від об’єму для обох адіабат (вказавши на них початкові температури). 2. Візьміть натуральні логарифми 3. Побудуйте на одному (іншому) рисунку графіки залежностей логарифма тиску від логарифма об’єму для обох адіабат (вказавши на них початкові температури).
4. Для кожної адіабати визначите за графіком експериментальне значення показника адіабати, використовуючи формулу 5. Визначите кількість ступенів вільності 6. Знайдіть ціну поділки на графіку для зміни внутрішньої енергії одного моля досліджуваного газу, що розташований в нижній лівій частині стенду. Для цього підрахуйте згідно формули (21.13) питому теплоємність при сталому об’ємі газу і внутрішню енергію газу згідно (21.6) для двох різних точок однієї адіабати. 7. Повторіть п.6 для іншої адіабати. Порівняйте отриманні результати. Контрольні запитання 1. Які ви знаєте параметри стану? 2. Сформулюйте перший закон термодинаміки. 3. Що таке «перпетуум мобіле» І роду, ІІ роду? 4. Якому рівнянню підкоряється стан ідеального газу? Напишіть його. 5. Дайте визначення теплоємності тіла. 6. Дайте визначення питомої теплоємності ідеального газу. 7. Напишіть формулу для теплоємності при сталому об’ємі. 8. Напишіть формулу для теплоємності ідеального газу при сталому тиску. 9. Що таке кількість ступенів вільності? Чому вона дорівнює для одноатомної молекули? 10. Що таке показник адіабати? 11. Напишіть формулу зв'язку показника адіабати з кількістю ступенів вільності молекули ідеального газу. 12. Дайте визначення адіабатичного процесу. 13. Напишіть рівняння адіабатичного процесу. 14. Дайте визначення ізопроцеса. Вкажіть відомі ізопроцеси. 15. Напишіть рівняння і намалюйте PV-діаграму ізотермічного процесу. 16. Напишіть рівняння і намалюйте PV-діаграму ізобаричного процесу. 17. Напишіть рівняння і намалюйте PV-діаграму ізохоричного процесу. 18. Поясніть звідки отримана формула для розрахунку показника адіабати
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 271; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.43.140 (0.011 с.) |
 (21.16)
(21.16) . Якщо залишається незмінним об’єм газу (
. Якщо залишається незмінним об’єм газу ( ), процес називається ізохоричним. Нарешті, якщо в ході процесу залишається незмінною температура (
), процес називається ізохоричним. Нарешті, якщо в ході процесу залишається незмінною температура ( ), процес називається ізотермічним. З рівняння (21.16) випливає, що у випадку ідеального газу при ізотермічному процесі тиск і об’єм пов'язані співвідношенням
), процес називається ізотермічним. З рівняння (21.16) випливає, що у випадку ідеального газу при ізотермічному процесі тиск і об’єм пов'язані співвідношенням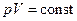 , (21.17)
, (21.17)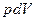 :
: . (21.18)
. (21.18) . Тому для адіабатичного процесу рівняння (21.18) спрощується:
. Тому для адіабатичного процесу рівняння (21.18) спрощується: (21.19)
(21.19) . (21.20)
. (21.20) і додамо його до (21.20), результатом буде
і додамо його до (21.20), результатом буде , (21.21)
, (21.21) (див. формулу 21.15). Поділимо (21.21) на добуток
(див. формулу 21.15). Поділимо (21.21) на добуток  :
: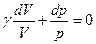 . (21.22)
. (21.22) , звідки
, звідки (21.23)
(21.23) і
і  . Його називають рівнянням Пуассона.
. Його називають рівнянням Пуассона. і замінимо
і замінимо 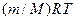 , прийдемо до рівняння адіабати ідеального газу в змінних
, прийдемо до рівняння адіабати ідеального газу в змінних  і
і 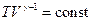 (21.24)
(21.24) ,
,  і
і  ми включили у константу, відповідно, сталі у формулах (21.23) і (21.24) мають різні значення).
ми включили у константу, відповідно, сталі у формулах (21.23) і (21.24) мають різні значення). Обчислимо похідну
Обчислимо похідну  для ізотерми та адіабати в одній і тій же точці (
для ізотерми та адіабати в одній і тій же точці ( , звідки
, звідки (для ізотерми).
(для ізотерми). , звідки
, звідки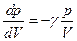 (для адіабати).
(для адіабати). разів більше, ніж у ізотерми – адіабата йде крутіше, ніж ізотерма (рисунок 21.1).
разів більше, ніж у ізотерми – адіабата йде крутіше, ніж ізотерма (рисунок 21.1). газу, згідно вашого варіанту з таблиці 21.1. Для цього натискайте стрілочки «вгору»-«вниз» біля поля температури збільшуючи і зменшуючи значення температури відповідно, або введіть число в поле, і підтвердіть вибір натисканням кнопки «Enter» Після цього крива теоретичної адіабати зміститься таким чином, щоб проходити через обрану точку. Початкове значення об’єму
газу, згідно вашого варіанту з таблиці 21.1. Для цього натискайте стрілочки «вгору»-«вниз» біля поля температури збільшуючи і зменшуючи значення температури відповідно, або введіть число в поле, і підтвердіть вибір натисканням кнопки «Enter» Після цього крива теоретичної адіабати зміститься таким чином, щоб проходити через обрану точку. Початкове значення об’єму 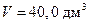 , відповідне початкове значення тиску буде пораховане і виведене на монітор.
, відповідне початкове значення тиску буде пораховане і виведене на монітор. 4. Після автоматичної зупинки процесу запустіть його знову і періодично зупиняйте його, записуючи при цьому значення об’єму, температури і тиску в таблицю 21.2 (маєте отримати 10-12 значень).
4. Після автоматичної зупинки процесу запустіть його знову і періодично зупиняйте його, записуючи при цьому значення об’єму, температури і тиску в таблицю 21.2 (маєте отримати 10-12 значень). , узявши його з таблиці 1, і повторіть виміри п.3, записуючи результати в таблицю 21.3.
, узявши його з таблиці 1, і повторіть виміри п.3, записуючи результати в таблицю 21.3. від експериментальних значень об’єму і тиску і заповніть відповідні графи таблиць 21.2,3.
від експериментальних значень об’єму і тиску і заповніть відповідні графи таблиць 21.2,3. .
. молекули газу, досліджуваного в даній комп'ютерній моделі, використовуючи формулу (21.15).
молекули газу, досліджуваного в даній комп'ютерній моделі, використовуючи формулу (21.15). у п.4.
у п.4.


