
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изменение окислительно-восстановительных свойств элементов и их соединений в периодах и группах
Окислительно-восстановительные свойства нейтральных атомов. Эти свойства определяются значениями энергии ионизации и сродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, принимающий электрон. В периоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает. В подгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается. Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями в изменении сродства к электрону. д) Кислотно-основные свойства соединений. Свойства оксидов и гидроксидов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным:
Сверху вниз в подгруппе при одинаковости заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидроксидов ослабевают, а основные – усиливаются:
Аналогичный пример можно привести для кислородсодержащих кислот элементов VI группы: сила кислот убывает в ряду H2SO4, H2SeO4, H2TeO4. ХИМИЧЕСКАЯ СВЯЗЬ Метод валентных схем и метод молекулярных орбиталей Силы, связывающие атомы в молекулы Силы, связывающие электроны и атомные ядра в атомах имеют электромагнитную природу. Силы, связывающие атомы в молекулы обусловлены силами Ван-дер-Ваальса, также имеют электромагнитную природу. Они возникают в результате деформации электромагнитного поля атомов при связывании их в молекулы.! Молекулярные орбитали и энергетические диаграммы молекулярных орбиталей Порядок заполнения молекулярных орбиталей электронами Заполнение молекулярных орбиталей подчиняется тем же правилам, что и заполнение атомных: принципу энергетической выгодности, принципу Паули, правилу Хунда, принципу заполнения электронных структур Aufbau. В общепринятом приближении молекулярная орбиталь рассматривается как линейная комбинация атомных орбиталей
Порядок связи Порядок связи в теории молекулярных орбиталей определяется выражением
где Ковалентная химическая связь и ее свойства Характерна для соединений неметаллов. Молекулы с ковалентной связью могут образовывать атомы одного и того же элемента. Одну из первых методик для описания ковалентных связей предложил Г.Льюис (1923 г публикация). СВОЙСТВА Типы химической связи Известно, что атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом образуются различного типа химические связи: ионная, ковалентная (неполярная и полярная), металлическая и водородная. Одно из наиболее существенных свойств атомов элементов, определяющих, какая связь образуется между ними – ионная или ковалентная, - это электроотрицательность, т.е. способность атомов в соединении притягивать к себе электроны. Тип химической связи зависит от того, насколько велика разность значений электроотрицательностей соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь, тем химическая связь полярнее. Провести резкую границу между типами химических связей нельзя. В большинстве соединений тип химической связи оказывается промежуточным; например, сильнополярная ковалентная химическая связь близка к ионной связи. В зависимости от того, к какому из предельных случаев ближе по своему характеру химическая связь, ее относят либо к ионной, либо к ковалентной полярной связи.
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 3204; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.32.116 (0.006 с.) |
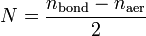
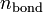 и
и  — суммарные количества электронов на связывающих и разрыхляющих орбиталях соответственно.
— суммарные количества электронов на связывающих и разрыхляющих орбиталях соответственно.


