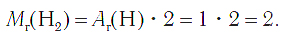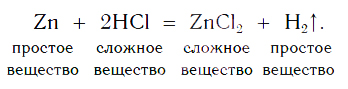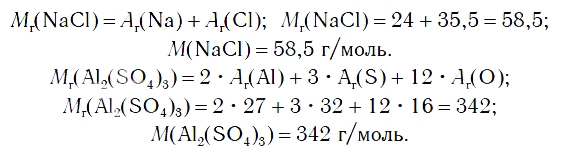Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Водород как химический элементСтр 1 из 4Следующая ⇒
Водород как химический элемент Атом водорода самый легкий, самый простой по строению и один из самых маленьких по размерам. Относительная атомная масса водорода равна: Сравните ее с относительной атомной массой кислорода и убедитесь, что атомы водорода во много раз легче. Атомы водорода соединяются с атомами других химических элементов, образуя сложные вещества. Как химический элемент водород входит в состав воды, кислот, природного газа, нефти, глюкозы и многих других веществ. В растительных и животных организмах, включая и человеческий, химический элемент водород содержится главным образом в составе воды и самых разнообразных органических веществ. Водород как простое вещество Молекулы водорода образованы двумя атомами химического элемента водорода. Формула его Н2. Относительная молекулярная масса простого вещества водорода равна:
Следовательно, молярная масса водорода равна:
Молярный объем водорода, как кислорода и других газов при нормальных условиях, равен:
В виде простого вещества водород встречается на Земле лишь в небольшом количестве в вулканических и некоторых других природных газах. Молекулы водорода Н2 обнаружены в верхних слоях земной атмосферы. В Солнечной системе простое вещество водород входит в состав атмосферы планет — Юпитера, Сатурна, Урана. На заметку: Недавние исследования Юпитера, самой большой планеты Солнечной системы, позволили ученым высказать предположение, что под водородной атмосферой этой планеты находится океан жидкого водорода. Глубина этого океана — десятки тысяч километров. Ядро планеты составляет оболочка, состоящая из твердого водорода. История открытия водорода Еще в XVI в. Парацельсом было замечено, что при действии кислот на железо и другие металлы выделяется газ. Первоначально его назвали «горючим воздухом». Спустя примерно 100 лет горение водорода на воздухе описал Р. Бойль и этот газ научились собирать. Во второй половине XVIII в. английский ученый Г. Кавендиш подробно исследовал свойства «горючего воздуха». Он установил, что этот газ при сгорании на воздухе образует воду. Г. Кавендиша считают первооткрывателем водорода (1766).
Вывод о том, что «горючий воздух» представляет собой простое вещество, был сделан в 1784 г. французским химиком А. Лавуазье. Он и дал этому веществу латинское название, которое происходило от греческих слов «хюдор» — вода и «геннао» — рождаю. В те годы под элементами подразумевали простые вещества, которые нельзя далее разложить на составные части. Поэтому у химического элемента водорода такое же название, как и у простого вещества Н2.
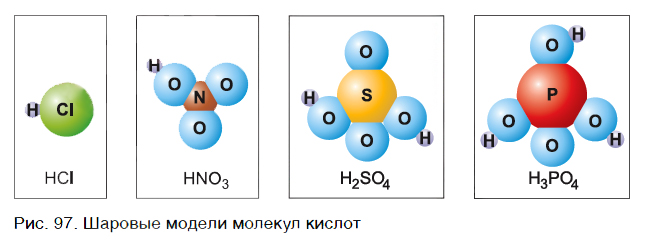
Состав кислот В большинстве случаев в состав молекул кислот входят только атомы неметаллов. На рисунке 97 представлены шаровые модели молекул некоторых кислот и их формулы. Что общего у этих молекул? Ответ прост — в них входят атомы водорода.
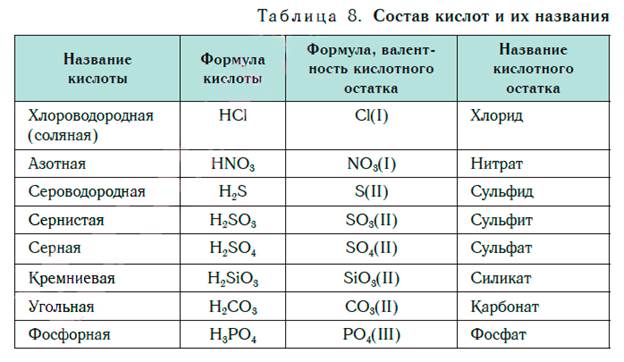
Обратим внимание, что в состав молекулы хлороводорода, кроме атома водорода Н, входит атом хлора Cl, молекулы азотной кислоты — группа атомов NO3, молекулы серной кислоты — SO4, молекулы фосфорной кислоты — PO4. Атом Cl, группы атомов NO3, SO4, PO4, а также другие атомы и группы атомов в составе кислот называют кислотными остатками. Кислоты — сложные вещества, в состав которых входят атомы водорода, способные замещаться атомами металлов, и кислотные остатки. Кислотные остатки в молекулах кислот соединены с атомами водорода в соответствии со своей валентностью. Как можно ее определить? Водород всегда одновалентен. Значит, если кислотный остаток в молекуле кислоты соединен с одним атомом водорода, то его валентность равна единице, если с двумя атомами — двум, а с тремя — трем. При написании формул кислот сначала пишут атомы водорода, а потом кислотные остатки. В таблице 8 представлены названия и формулы кислот, с которыми вы будете встречаться при изучении основ химии. Здесь же даны формулы кислотных остатков, которые входят в состав этих кислот, их валентность и названия.
При обычных условиях кислоты существуют в жидком и твердом агрегатных состояниях. Так, фосфорная кислота H3PO4 при комнатной температуре — твердое вещество. При этих же условиях серная кислота H2SO4 — это не имеющая запаха вязкая жидкость. Она почти в 2 раза тяжелее воды. Хлороводородная кислота HCl — раствор газа хлороводорода в воде. Она имеет еще и историческое название «соляная кислота». Раствор этой кислоты имеет характерный запах.
В большинстве случаев кислоты растворяются в воде. Исключение — кремниевая кислота H2SiO3. Водные растворы хлороводородной, серной и фосфорной кислот не имеют окраски. Безводная азотная кислота при хранении желтеет. Поскольку в состав всех кислот входят атомы водорода, то кислоты обладают общими свойствами: 1) изменяют окраску некоторых органических веществ; 2) имеют кислый вкус (пробовать кислоты на вкус, как и любые другие вещества, запрещается — можно получить ожог полости рта!); 3) оказывают разъедающее действие на кожу человека, ткани, бумагу, древесину и другие материалы. Есть вещества, которые, как и кислоты, содержат атомы водорода, но кислотными свойствами не обладают, например метан CH4, аммиак NH3, вода H2O и др. Следовательно, не все вещества, содержащие атомы водорода, относят к кислотам. Понятие об индикаторах Некоторые органические вещества изменяют свою окраску в присутствии кислот и ряда других веществ. Такие вещества называют индикаторами, что в переводе с латинского означает «указатель». Индикаторы — это органические вещества, которые изменяют свою окраску в присутствии кислот и ряда других веществ. На уроках химии для обнаружения в растворах кислот используют индикаторы лакмус, метиловый оранжевый (метилоранж), а также универсальный индикатор. Это полоска фильтровальной бумаги, пропитанная смесью индикаторов. Окраска индикаторов в воде показана на рисунке 98. Индикаторы изменяют свой цвет, если в растворе есть кислоты (рис. 99).
На заметку: В растворах кислот изменяют цвет сок краснокочанной капусты, вишни, черноплодной рябины, цветки фиалки и др. Краткие выводы урока:
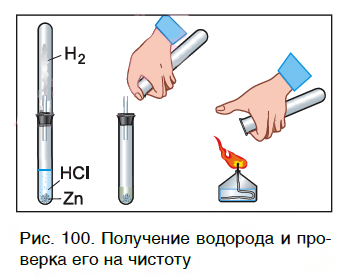
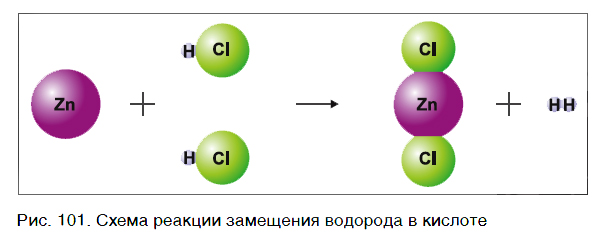
Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа. В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок. Это свидетельствует о наличии в пробирке водорода.
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2. Теперь мы можем записать уравнение реакции цинка с кислотой:
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода,
Вытеснительный ряд металлов При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет. По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
Его называют рядом активности или вытеснительным рядом металлов. Чем левее расположен металл в вытеснительном ряду до водорода (Н 2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют. Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей. Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий. Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро. Краткие выводы урока:
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли. Cостав солей Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков. Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
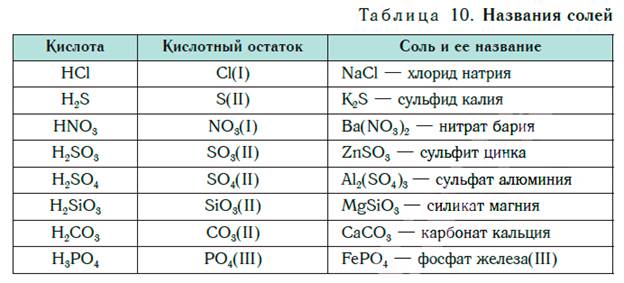
Названия солей Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия. Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия». Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей. Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl. По химической формуле соли можно вычислить ее относительную формульную массу M r, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др. Краткие выводы урока:
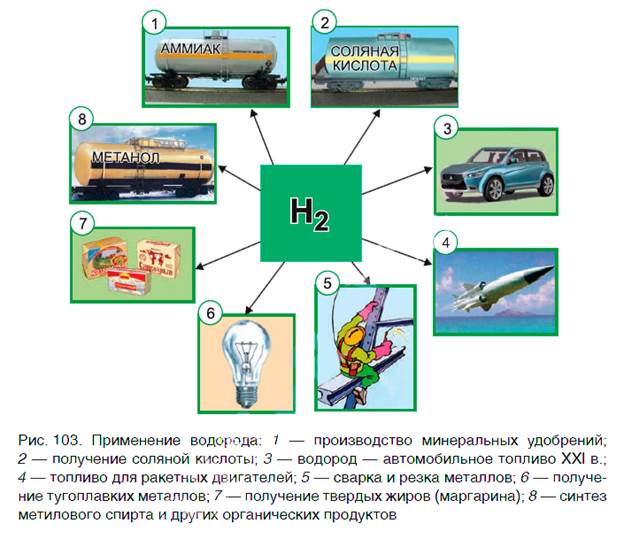
Применение водорода Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103. Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира. В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 оС. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется. Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом. Краткие выводы урока:
Наиболее распространенным оксидом на Земле является оксид водорода H2O, или вода. Без воды, как и без кислорода, невозможна жизнь человека, животных и растений. Вода — единственное вещество, существующее на Земле одновременно в трех агрегатных состояниях: жидком, твердом и газообразном. Она является основным компонентом морей и океанов, ледников и айсбергов, облаков и тумана. Около 70 % поверхности Земли покрыто океанами, морями, реками и озерами — природными хранилищами воды. Из космоса толстый слой воды имеет голубой цвет (рис. 104), вот почему нашу планету называют голубой. Вода входит в состав всех живых организмов, а также очень многих минералов.
Содержание
Водород как химический элемент Атом водорода самый легкий, самый простой по строению и один из самых маленьких по размерам. Относительная атомная масса водорода равна: Сравните ее с относительной атомной массой кислорода и убедитесь, что атомы водорода во много раз легче. Атомы водорода соединяются с атомами других химических элементов, образуя сложные вещества. Как химический элемент водород входит в состав воды, кислот, природного газа, нефти, глюкозы и многих других веществ. В растительных и животных организмах, включая и человеческий, химический элемент водород содержится главным образом в составе воды и самых разнообразных органических веществ.
|
|||||||||
|
Последнее изменение этой страницы: 2022-01-22; просмотров: 106; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.214.215 (0.036 с.) |