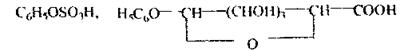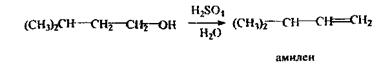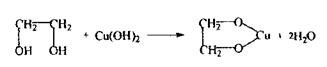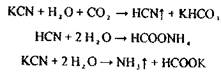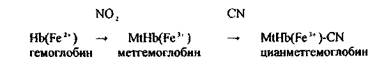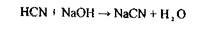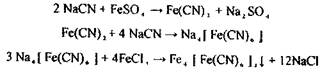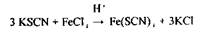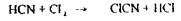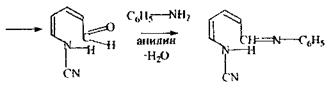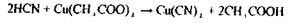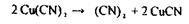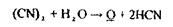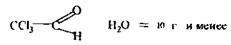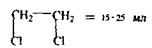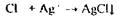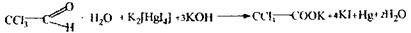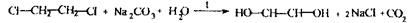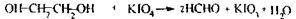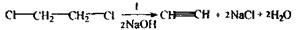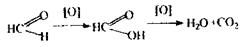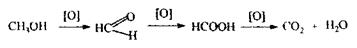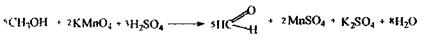Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Загальна характеристика «летких отрут»Стр 1 из 3Следующая ⇒
План лекції
1. Загальна характеристика «летких отрут». 2. Методи ізолювання речовин з біологічного матеріалу. 3. Загальна схема аналізу дистилятів хімічними методами.
Спостерігається червоне забарвлення розчину.
Реакціями, що підтверджують наявність ацетону, є реакції з альдегідами, наприклад, з фурфуролом - реакція неспецифічна. Спостерігається червоне забарвлення розчину. Залишок другого дистиляту змішують із третім дистилятом і знову проводять аналіз на галогенпохидні і формальдегід. З частиною третього дистиляту, що залишилася, виконують аналіз на фенол і ізоаміловий спирт. Летальні дози для фенолу - 8-15 г. Фенол добре всмоктується в організмі при попаданні через рот, дихальні органи. При токсичних дозах спостерігається печія, біль у шлунку, блювота, пронос, сеча чорного кольору. Відзначається жирове переродження печінки, нирок. Метаболізм фенолу:
З організму фенол виділяється із сечею у вигляді ефірів із сульфатною і глюкуроновою кислотами:
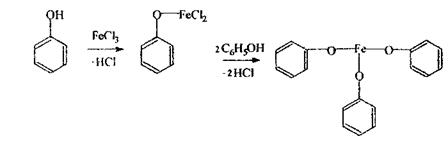
Темно-зелений колір сечі свідчить про окислювання фенолу за схемою:
Особливістю ізолювання фенолу є підлужнювання дистилляту розчином натрію гідрокарбонату до рН 8-9 для зв'язування слабких кислот (оцтової, саліцилової, молочної), що реагують з FеС13.Фенол екстрагують ефіром, ефірний витяг упарюють і реакції виконують із сухим залишком. При спрямованому аналізі на фенол, біологічний об'єкт підкислюють більш сильною СН3СООН, яку зв'язують потім лугом і фенол екстрагують ефіром.
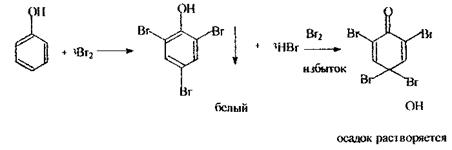
Аналіз фенолу починають проведенням реакції з бромною водою - найбільш чутливою, попередньою, але неспецифічною (анілін, саліцилова кислота, ароматичні аміни й ін.)
Даною реакцією виявляють фенол, який утворюється при гнитті білка. Судово-хімічне значення має негативний результат реакції.
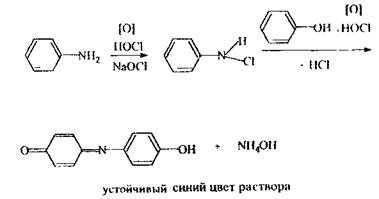
Реакція з хлоридом окісного заліза - специфічна для фенольного гідроксилу, спостерігається синє забарвлення розчину. Індофенольна реакція - неспецифічна, підтверджуюча.
Реакція Лібермана - реакція утворення індофенолу, неспецифічна, підтверджуюча, спостерігається синє забарвлення, що переходить у червоне, а потім у зелене забарвлення.
Реакція з реактивом Міллона (суміш нітратів одно- і двовалентного меркурію, що містить азотисту кислоту), неспецифічна, підтверджуюча, спостерігається червоне або оранжеве забарвлення.
Ізоаміловий спирт
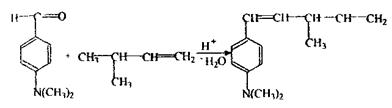
С5Н11ОН - головна складова частина сивушних олій і летальна доза складає 10-15 г. До складу сивушних олій також входять вищі спирти (бутиловий, аміловий), альдегіди, ефіри, кетони. Використовується ізоаміловий спирт в медицині, при виробництві бездимного пороху. Токсична дія ізоамілового спирту - наркотик; більш отрутний, ніж етанол, тому що повільно всмоктується, метаболізує і виводиться, викликаючи більш сильне і тривале сп'яніння з неврологічними і психічними порушеннями. Метаболізм: частина введеної дози метаболізує по шляху окислювання до ізовалер’янового альдегіду і ізовалер’янової кислоти, а частина - виводиться в незмінному вигляді нирками та легенями. Особливості ізолювання: спирт екстрагують ефіром (хлороформом) з дистиляту, а після того відганяють ефір і виконують аналіз. При аналізі вина, 40-50 мл його розводять водою до вмісту етанолу 10-15 % (спирт у такій кількості не ізолюється ефіром або хлороформом), а потім 15 мл СНС13 ізолюють ізоаміловий спирт. Аналіз ізоамілового спирту починають з реакції утворення ізоамілацетату, попередньої, специфічної:
Відчувається запах грушевої есенції, що підсилюється при розведенні водою.
Реакція окислення ізамілового спирту — підтверджувальна, специфічна. Реакція з альдегідами, підтверджуюча, неспецифічна:
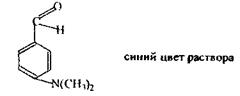
Реакція з п-диметилбензальдегідом
Реакція з саліциловим альдегідом.
Механізм реакції точно не описаний.
Один з можливих механізмів:
Ці реакції дають вищі спирти, не дають СН3 ОН і С2Н5ОН.
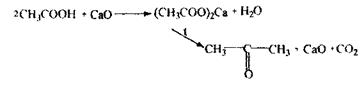
Оцтова кислота На оцтову кислоту виконують цілеспрямований аналіз, летальні дози 200 мл оцту, 10-20 г оцтової есенції. Токсична дія оцтової кислоти - опік стравоходу, уремія, гемолітична анемія. Метаболізм:
Особливості ізолювання: Аналіз спрямований, тому біологічний матеріал підкислюють розчином Н 2 SО4 або Н3 РО4. Оцтова кислота летка і її збирають у 0,1н NаОН.
Аналіз на оцтову кислоту починають з реакції з хлоридом окісного заліза, неспецифічної, чутливої, попередньої.
Реакція утворення складного ефіру, відчувається запах оцтово-етилового ефіру, реакція підтверджуюча, специфічна.
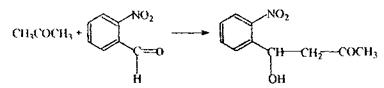
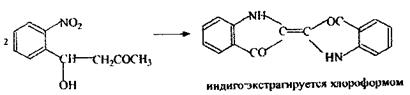
Реакція утворення індіго, підтверджуюча, неспецифічна.
Ацетон при взаємодії з о-нітробензальдегідом в лужному середовищі утворить індіго, що має синє забарвлення.
Етиленгліколь Двохатомний спирт, безбарвна масляниста рідина, змішується з водою у всіх співвідношеннях.
Етиленгліколь використовується в техніці як антифриз; у хімічній промисловості - як розчинник; для проведення органічного синтезу. Поводження в організмі - шляхи надходження через рот; шкіру; тому що спирт мало леткий, то його надходження через органи дихання обмежене. Метаболізм складний, який включає багатоетапне окислення:
Виведення етиленгліколю і його метаболітів - із сечею. Токсичність етиленгліколю полягає в тому, що він є судинною та протиплазматичною отрутою, яка викликає дегенерацію судин і пошкодження нирок за рахунок відкладення в них оксалатів.
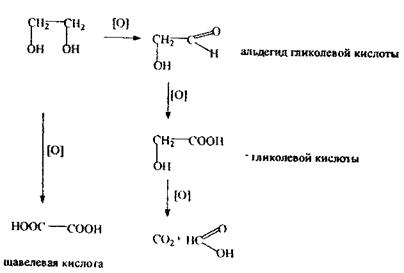
Особливість спрямованого ізолювання з біологічного матеріалу - використання бензолу як селективного переносника етиленгліколю при перегонці з водяною парою. Збирають дистилят об’ємом не менш 500 мл. Дистилят розділяється на 2 шари: верхній - бензол, нижній- етиленгліколь з водою. Аналіз етиленгліколю починається з попередньої реакції окислення етиленгліколю до формальдегіду, яка чутлива, неспецифічна.
Формальдегід виявляють при проведенні реакції з фуксинсульфатною кислотою по появі бузкового забарвлення розчину. Реакція із сульфатом купруму - підтверджуюча, неспецифічна Спостерігається синє забарвлення розчину.
Реакція окислювання етиленгліколю до щавлевої кислоти - підтверджуюча, специфічна Спостерігається утворення характерних за формою кристалів оксалату кальцію.
Тетраетилсвинець (ТЕС)
Тетраетилсвинець -(С2Н3)4РЬ - прозора безбарвна рідина, майже не розчиняється у воді, легко розчинна в бензині, ефірі, хлороформі, спирті, у жирах, маслах. Легко розкладається під впливом нагрівання, сонячних променів до неорганічних солей плюмбуму. Використовується як антидетонатор. Тетраетилсвинець дуже токсичний, надходить через рот, органи дихання, шкіру, поражає нервову систему, викликає головний біль, безсоння, розлад зору, судороги. Особливість спрямованого ізолювання - після перегонки з водяною парою тетраетилсвинець збирають у приймач зі спиртовим розчином йоду. (С2Н3)Рb + J2 →РbJ2 + 2С4Н10 Потім рідину випаровують до сухою залишку, який розчиняють в нітратній кислоті РbJ2+ 2НNО3 → Рb (NO3)2 + 2HJ Розчин знову випаровують і сухий залишок розчиняють у воді й аналізують на Рb2+ реакціями утворення дитизонату плюмбуму РbSО4, РbS, РbСгО4, РbJ2 . При аналізі харчових продуктів, одягу, рослинної сировини тетраетилсвинець екстрагують органічними розчинниками.
І ВИЗНАЧЕННЯ ЛЕТКИХ ОТРУТ
План лекції №5 1. Зміст методу газо-рідинної хроматографії. 2. Основні вузли газового хроматографа 3. Якісний і кількісний аналіз летких отрут методом газо-рідинної хроматографії.
Балон з газом-носієм. Колонка. Детектор. Підсилювач. Самописець. Газ-носій повинен надходити в колонку з постійною швидкістю, що забезпечує постійний час втримування аналізованої речовини. Газом-носієм використовують Н2,N2, Не2 Характеристика газу-носія: • інертний, • легкодоступний, • чистий, • доступний, • підходити для виду детектора. Колонка - це головна складова частина хроматографа, чим більша її довжина, тим краще йде розділення суміші, чим менший її діаметр, тим вища її ефективність. У газо-рідинній хроматографії використовуються колонки: • За формою: прямі - найефективніші, спіралевидні, і U-подібні. • За довжиною: 0,5-20 м. • За діаметром: 2-6 мм. • Виготовляються колонки зі сталі, скла. Сорбент-носій, яким заповнюють колонку (сферохром, силікагель, окис алюмінію, активоване вугілля) повинен бути: • інертним, • мати велику поверхню, • мати однорідні за формою і рівномірні за розміром частини. Рідка фаза повинна бути схожа за хімічними властивостями на речовини в суміші. Не існує безпомилкового методу вибору найкращої рідкої фази для даних сумішей, її знаходять у ході аналізу. Приклад, вуглеводні краще розділяти на вуглеводнях, парафіни на полярні сполуки - на полярній рідкій фазі. В даний час використовують колонки з невеликою кількістю рідкої фази (від 2-10 %), що забезпечує високу швидкість аналізу. Приклад, речовини з низькою летючістю краще розділяти в невеликій кількості рідкої фази - 4% і менше, для сполук з високою летючістю необхідно використовувати 20-40 % рідкої фази, так як розчинність їх мала. Детектор (що виявляє), його завдання полягає в тому, щоб знайти речовини на виході з колонки в газі-носію і перевести хімічний аналіз в сигнал електричний, котрий виражається в появі стрибка різниці потенціалів, що синхронно записує самописець у вигляді піків на стрічці В результаті аналізу одержують хроматограму - графічне відображення процесу розділення суміші речовин. Розрізняють кілька видів детекторів: 1. За теплопровідністю, 2 Іонізаційні: полум’яно-іонізаційний, термоіонізаціний, фосфорний і ін. Детектор по теплопровідності - робота його заснована на тому, що нагріте тіло втрачає тепло зі швидкістю, яка залежить від складу газу. Тепловіддача нитки детектора буде мінятися в залежності від складу газу, так як різні за молекулярною масою молекули речовин рухаються з різною швидкістю, після удару об гарячу нитку їхня швидкість буде по-різному збільшуватись за рахунок відібраного тепла.
Чим менша молекулярна маса речовини, тим більша швидкість і тем більшою буде тепловіддача нитки в цьому газі. Зміна температури нитки детектора супроводжується зміною опору нитки і появою стрибка різниці потенціалів. Чутливість детектора - 2-5 • 10-6 г.
Полум'яно-іонізаційні детектори: Робота заснована на зміні різниці потенціалів в мережі залежно від вмісту заряджених частинок. Молекули речовини іонізуються полум'ям і змінюється струм, з'являється стрибок різниці потенціалів, що відображається в вигляді піка. Іонізація частинок заснована на: • Термічному розкладанні молекул (водневий пальник - 1200° С), • Окислюванні атомів карбону Чутливість 10 9 - 10∙10 12 г.
Виявлення спиртів Спирти С1-С5 виявляють за часом утримання їхніх складних ефірів з азотистою кислотою, так як вони більш леткі. С2Н5ОН + NaNO2 + CCl3COOH → C2H5ONO + CCl3 COONa + H2O
Час утримування - це час від моменту введення речовини в хроматограф до появи максимуму піка. Умови хроматографічного аналізу: • Газ-носій - азот, • Сорбент-носій - сферохром, • Рідка фаза - розчин вініліну в хлороформі (20 %) Вінілін - полібутиловий спирт:
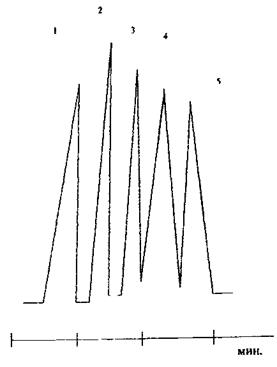
Ідентифікація проводиться при співставленні отриманого піка зі стандартною сумішшю спиртів С1-С5 (від метанолу до амілового спирту) Спирти виходять на хроматограмі по мірі збільшення молекулярної ваги.
Вміст речовини оцінюється за величиною піків за наступними параметрами: • За висотою піка - це найшвидший і зручний спосіб розрахунку, • За площею піка, • За вагою піків - методика точна, але тривала, так як має значення товщина паперу і його вологість; зручна, якщо піки не рівносторонні. Розрахунок вмісту здійснюють за допомогою стандарту (пропіловий або ізопропіловий спирт). Стандарт повинен бути: • За хімічними властивостями, близькими речовині, • З'являтися у вигляді окремого піка, • Знаходитися поблизу від речовини, • За вмістом близький вмісту речовини. При розрахунку використовують калібровальний графік, побудований з використанням розчинів з відомим вмістом. Ціль введення стандарту - збільшити точність аналізу, можливість зменшити помилку визначення. Всі леткі отрути аналізуються за методом ГРХ - газо-рідинної хроматофафії. Приклад: умови хроматографічного аналізу галоїдопохідних аліфатичного ряду: • Сорбент – сферохром. • Рідка фаза - вазелінова олія, парафін. • Детектор - полум'яно-іонізаційний.
Схема хроматографа
Схема поділу суміші спиртів С1 – С5 (у вигляді алкілнітритів)
1 - метанол 2 - етанол - 3 - пропанол 4 - бутанол 5 - ізоаміловий спирт
План лекції
1. Загальна характеристика «летких отрут». 2. Методи ізолювання речовин з біологічного матеріалу. 3. Загальна схема аналізу дистилятів хімічними методами.
Загальна характеристика «летких отрут»
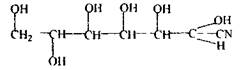
«Леткі отрути» - це токсичні речовини, які ізолюються дистиляцією або перегонкою з водяною парою: синильна кислота; оцтова кислота; галогенпохідні аліфатичного ряду (хлороформ, чотирихлористий карбон, дихлоретан, хлоралгідрат); альдегіди і кетони (формальдегід, ацетон); спирти (метиловий, етиловий, ізоаміловий, етиленгліколь); складні ефіри (оцтово-етиловий, оцтово-аміловий ефір); ароматичні вуглеводні і їх похідні (бензол, толуол, ксилол, анілін); феноли і фенолокислоти (фенол, саліцилова кислота), плюмбум етилований; сульфурокарбон, фосфор і речовини, отримані після його окислювання (фосфорні кислоти) і відновлення (фосфористий гідроген). Летальні дози для деяких «летких отрут»: НСN- 0,05-0,1 г; СН3OH-25-100 г (7-8 г-сліпота); СНС13 - 50-70 г, СН3СООН-15г. Зазначені речовини є високо токсичними, вони доступні, так як. широко використовуються в промисловості, сільському господарстві, медицині. Наприклад, у медицині застосовуються хлороформ, етанол, фенол, ефір; у сільському господарстві - циклони В і С (для боротьби зі шкідниками); на заводах і фабриках - бензол, ацетон і інші органічні розчинники. Загальні властивості «летких отрут» - здатність переганятися з водяною парою незалежно від змішуваності з водою. Цей метод дозволяє створити більш м'які умови для виділення зазначених речовин з біологічного матеріалу, тому що деякі речовини можуть осмоляться, розкладатися при високих температурах. В основі цього методу лежить залежність тиску насиченої пари суміші від температури. Рідина починає кипіти і буде переганятися, якщо тиск пари над рідиною буде дорівнювати або більшим за атмосферний тиск. Σ Р1 + Р2... = Рп>Ратм, де ΣР1 + Р2... - сума парціальних тисків парів води і рідини; Рп - тиск парів над сумішшю. Отже, суміш буде переганятися при температурі нижчій, ніж самі речовини: tкип С6Н6 - 80,2° С tкип Н2О - 100°С Суміш рівних об’ємів бензолу і води кипить при 69,2° С.
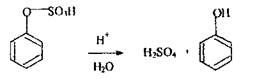
2. Методи ізолювання речовин з біологічного матеріалу. У судово-хімічних лабораторіях ізолювання «летких отрут» з біологічного матеріалу здійснюють методом перегонки (дистиляції) з водяною парою за методикою: 100г біологічного матеріалу подрібнюють, змішують з дистильованою водою (Vсуміші = 1/3 Vколби) і поміщають у колбу, яку ставлять у холодну водяну баню. Потім нагрівають пароутворювач до появи водяної пари, досліджувану суміш підкислюють насиченим водним розчином щавлевої або винної кислоти до рН 2-2,5 і негайно з'єднують усі частини: пароутаорювач, колбу, холодильник і приймач, потім нагрівають водяну баню. Вибір рН обумовлений тим, що рН - 2-2,5 забезпечує найбільш повне руйнування зв'язку білка і речовин. Вибір кислот обумовлений тим, що мінеральні кислоти можуть розкладати «леткі отрути», наприклад, синильну кислоту: НСN + 2Н2О + Н+ ® НСООН + NH4 + або викликати утворення отруйних речовин при дослідженні біологічного матеріалу, наприклад, в результаті гниття білка в організмі утвориться сульфатнокислий ефір фенолу:
Слабкі органічні кислоти ефір не руйнують, переганяється фенол, що надходить в організм ззовні з токсичною метою. Прикладом використання мінеральних кислот в якості підкислюючого агенту при ізолюванні «летких отрут» є дистиляція оцтової кислоти, для чого в біологічний матеріал вводять Н2 SО4 або H3РО4, тому що кислоти зcувають рівновагу в розчині вбік утворення молекулярної форми оцтової кислоти, яка повністю переганяється з водяною парою.
Збір дистилятів роблять у приймач. Перший дистилят, що містить найбільш леткі отрути, а саме, НСN, збирають у розчин лугу -2 % розчином NаОН 2 мл; V1 дистиляту = 5 мл. Потім збирають ще 2 дистиляти: V2 = V3= 25мл Якщо отримано позитивний результат при дослідженні на «летку отруту», то дистиляцію проводять доти, поки дистилят не перестане давати якісну реакцію. Зібрані дистиляти досліджують потім якісно і кількісно. Ряд речовин основного характеру переганяють з підлужненого біологічного матеріалу: анілін, пірідин, нікотин, анабазін і інші. У цьому випадку після перегонки речовин з підкисленого біологічного матеріалу, його підлужнюють 5 % розчином NaОН до рН 8-9 і знову переганяють, збираючи 2-4 дистиляту по 10-15 мл в 0,1 Мрозчин НС1. Усі «леткі отрути» поділяються за здатністю змішуватися з водою:. 1. Речовини, що не змішуються або погано змішуються з водою (бензол, хлороформ) дають після перегонки два чітких шари: вода і речовина, що легко розділити. 2 Речовини, що дають з водою суміші, у яких склад пари і рідини однаковий (фенол, етанол) - азеотропні суміші - у дистиляті не розділяються. Для розділення азеотропних сумішей використовують перегонку при пониженні або підвищені тиску (азеотропна суміш етанолу з водою 96 % C2Н5ОН + 4% Н2О - переганяється при атмосферному тиску при 78о С. При пониженні тиску до 100мм при дистиляції суміш має склад -99,62 % С2Н5ОН + 0,4 % Н2О і переганяється при 34о С. Якщо після перегонки з водяною парою вміст отрут у дистилятах малий або попадають речовини, що утворилися після гниття біологічного матеріалу, то для очищення дистиляти піддають фракційній перегонці. Метод сухоповітряного відгону застосовується для аналізу проб крові, сечі, невеликих наважок гомогенізованих органів. Метод сухоповітряного відгону проводять у закритих камерах або бюксах, на дно яких поміщають аналізовану пробу і ставлять тигель з поглинальним розчином. Відбувається зникнення отрути в присутності висолювача або без нього - при кімнатній температурі або при нагріванні (37-50° С) у поглинальний розчин, з яким надалі проводять якісні реакції. При проведенні лабораторного експрес-аналізу крові, сечі, промивних вод шлунку живих осіб при гострих інтоксикаціях використовується метод парофазного аналізу, що полягає в аналізі пароподібної фази за допомогою методу газової хроматографії, попередньо перевівши отрути в пароподібний стан, а далі роблять поділ і детектування їх.
3. Загальна схема аналізу дистилятів хімічним методом. Аналіз починають з першого дистиляту на наявність синильної кислоти. Фізичні властивості - це рідина без кольору, запаху гіркого мигдалю, летуча, t кипіння - 25,6° С. Дуже слабка кислота Кд = 4,8 · 1010, солі її у воді нестійкі:
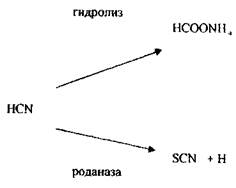
Синильна кислота дуже токсична Летальні дози синильної кислоти і її солей: НСN = 0,05-0,1 г, КСN = 0,15-0,25 г. Синильна кислота уражає дихання, тобто блокує дихальний фермент - цитохромоксидазу, при цьому кисень від гемоглобіну не надходить в тканини. HCN + білок – R—Fe3+ → білок – R-Fe3+ - CN + H цитохромоксидаза стійкий комплекс Метаболізм синильної кислоти протікає в двох основних напрямках - гідроліз з утворенням форміату амонію і перетворення ціанід- іону в роданід-іон під дією ферменту роданази.
Антидоти при отруєнні синильною кислотою: I Сірковмісні речовини - тіосульфати натрію, калію. роданаза HCN + S2O32- + O → SCN + SO42-
2 Речовини, що утворюють метгемоглобін - солі та ефіри азотистої кислоти NаNО2, КNО2, С5Н11-О-NО (аміловий ефір), метиленовий синій.
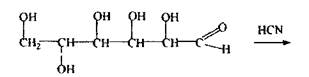
Але СN--іон може відщеплюватись, тому необхідно вводити хворому одночасно сірковмісні речовини і вуглеводи. 3 Вуглеводи (глюкоза) - зв'язують синильну кислоту і її солі з утворенням ціангідрину глюкози.
глюкоза
ціангідрін глюкози Особливості ізолювання синильної кислоти з біоматеріалу: Враховуючи, що синильна кислота легко летка і мало дисоціює у воді, її зв'язують у сіль:
Аналіз дистиляту на синильну кислоту починають з попередньої, високочутливої і специфічної реакція утворення берлінської блакиті:
Особливості проведення реакції - у лужному середовищі можливі побічні реакції утворення - Fе(ОН)2 ↓, Fе(OН)3 ↓, для їхнього розчинення вводять НС1: Fе(ОН)3 + 3НС1 —> FеС13 +3Н2О, однак надлишок НС1 - сповільнює випадання осаду. Висновок про наявність отрути дають через 24-48 годин, тому що якщо є сліди HCN і якщо є білкові речовини, то осад утворюється повільно. Для прискорення його випадання вводять ВаС12 і на осаді ВаSО4 співосаждується осад берлінської блакиті. У судово-слідчі органи направляється осад берлінської блакиті. Чутливість реакції 20 мкг у 1 мл розчину. Для підтвердження наявності синильної кислоти в дистиляті проводяться реакції забарвлення:
Реакція утворення роданіду заліза - високочутлива (10 мкг у 1 мл), але неспецифічна. кроваво-червоний кольор розчину
Реакція утворення поліметину високочутлива (0,2 мкг у 1 мл розчину), неспецифічна.
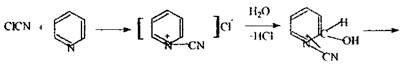
хлорциан
піридин ціан-піридинія хлорид перегрупіровка в молекулі ціан-проізводне глутаконового альдегіду Реакція утворення бензидинової сині -чуттєва, неспецифічна:
діциан
бензидинова синь Папір, змочений розчином солі міді і бензидином, синіє при наявності синильної кислоти або її солей.
Аналіз другого дистиляту починають з дослідження отрутних галогенопохідних аліфатичного ряду, летальні дози для яких такі: Хлороформ – СНСl3 = 50-70 г Чотирихлористий карбон - СС14 = 20-50 мл Хлоралгідрат
Дихлоретан
По токсичній дії: • Хлороформ і хлоралгідрат _є наркотиками. Вони спочатку збуджують, а потім паралізують нервову систему. • Чотирихлористий карбон діє на організм подібно хлороформу, але повільніше і викликає значні порушення в органах, у печінці, нирках спостерігається жирове переродження. • Дихлоретан по наркотичній дії є найсильнішим з отрутних галоїдпохідних. • Поразка цими речовинами супроводжується блювотою, проносом, здуттям живота, збільшенням і болючістю печінки, анурією. Метаболізм вивчений недостатньо, кінцевим результатом метаболітчних процесів є диоксид карбону і хлористоводнева кислота:
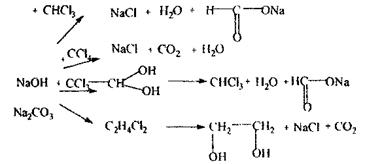
Особливістю ізолювання галогенпохідних отрут аліфатичного ряду є здатність переганятися вже в перші порції дистиляту. При значних кількостях отрут (> 1г) у дистиляті спостерігаються краплі рідини, які не змішуються з водою. Аналіз починають іззагальної (неспецифічної) і низькочутливої реакції відщеплення органічно зв'язаного хлору, що дають усі галоїдопохідні.
Спостерігається білий осад або біле помутніння в розчині. Якщо не спостерігається помутніння або осад, то проводиться реакція Фуджівара,яка базується на утворенні поліметину – чутлива, неспецифічна.
Реакція утворення ізонітрилу - високочутлива, неспецифічна, з досліджуваних галогенпохідних тільки дихлоретан не дає даної реакції.
З'являється неприємний запах. При позитивному результаті виконується повний аналіз на галогенпохідні отрути. Реакція з резорцином у лужному середовищі - чутлива; неспецифічна - її можуть давати альдегіди, мурашина кислота. Механізм недостатньо встановлений.
Енольна кето-форма Спостерігається рожеве забарвлення розчину.
Реакція відновлення гідрокису купруму - низькочутлива і неспецифічна (альдегіди), чотирихлористий карбон і дихлоретан не дають зазначеної реакції.
Реакція з реактивом Несслера - характерна для хлоралгідрату.
Спостерігається оранжевий осад, який з часом стає зеленим. На наявність дихлоретану виконується цілеспрямований аналіз: Реакція відщеплення атомів хлору:
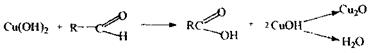
Спостерігається білий осад хлориду аргентуму після додавання нітрату аргентуму в нітратнокислому середовищі. Реакція утворення етиленгліколю і виявлення його після переведення у формальдегід:
Реакція утворення ацетиленіду купруму:
Спостерігається рожеве або вишнево-червоне забарвлення розчину. Потім другий дистилят досліджується на наявність формальдегіду, летальна доза якого складає 15-25 мл. Формальдегід поражає дихання, викликаючи при вдиханні різкий кашель, сльозотечу. Попадання формальдегіду через рот супроводжується нудотою, судорогами, втратою свідомості, поражає нирки, паралізує дихання. Метаболізм формальдегіду протікає за таким механізмом:
Аналіз формальдегіду починають із проведення високочутливих реакцій:
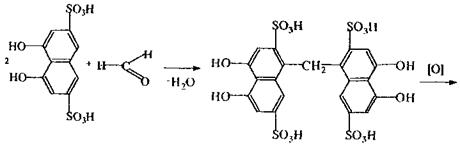
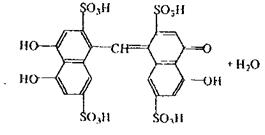
Реакція з хромотропною кислотою, в результаті якої спостерігається фіолетове або червоно-фіолетове забарвлення розчину. Реакція неспецифічна, тому що її дають речовини, що при гідролізі, дегідратації або окислюванні утворюють формальдегід.
Реакція кодеїну та сульфатною кислотою, в результаті якої спостерігається синьо-фіолетове або червоно-фіолетове забарвлення.
кодеїн морфін
Реакція з фуксинсірчистою кислотою - реакція неспецифічна, тому що її дають альдегіди (фурфурол, ацетальдегід і інші) і навіть окислювачі
повітря (хлор, кисень, окиси нітрогену). Синій колір з'являється в розчині не відразу, а через 10-15 хв. Однак, якщо колір з'явився через півгодини, то це не є позитивним результатом на альдегід. Слід зазначити, що за певних умов ця реакція може бути специфічна для формальдегіду, тому що йде при сильно кислому середовищі рН = 0,7 тільки з формальдегідом; а при рН - 2,7 - дають багато альдегідів. Реакції з резорцином; відновлення іонів аргентуму; з реактивом Фелінга- менш чутливі і неспецифічні, але вони виконуються обов’язково, якщо позитивний результат високочутливих реакцій. При відсутності позитивного результату на формальдегід виконують реакції на метиловий і етиловий спирти, а потім на кетони - ацетон. З аліфатичних спиртів найбільше токсикологічне значення мають метиловий, етиловий і ізоаміловий спирти. Спирти використовуються в медицині, на хімічних заводах, у харчовій промисловості. Денатурат (.технічний спирт) включає 2,5 % ацетоністого спирту (75 % метанолу і 0,5 % піридинових основ). Летальна доза метилового спирту 40-100 мл, при прийомі 7-8 мл метанолу в хворого наступає сліпота. Токсична дія метилового спирту полягає в пораженні нервової системи, судинної системи, зорового нерву, сітківки ока. Метанол діє на гемоглобін і блокує перенесення кисню, що викликає настання гіпоксії. Метанол кумулюється. Токсичність метанолу зумовлена продуктами метаболізму - формальдегідом і мурашиною кислотою:
• Формальдегід по ражає зоровий нерв. • Мурашина кислота приводить до сильного ацидозу. Антидотом при поразці метиловим спиртом є етиловий спирт, що легше розкладається ферментом алкогольдегідрогеназою, а метанол виводиться нирками, легенями в менш токсичному, нативному стані. Особливості ізолювання: метанол леткий і для зменшення втрат його збирають у збірник, охолоджений льодом або холодною водою. При дослідженні вин попередньо зв'язують леткі кислоти карбонатом натрію, а потім відганяють метанол. При аналізі дешевих одеколонів попередньо очищують одеколон від ефірних олій, екстрагуючи олії ефіром, а потім зв'язують леткі кислоти й відганяють метанол.
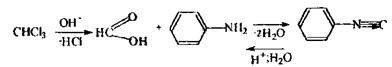
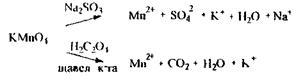
Аналіз метилового спирту починають з попередньої реакції - окислення метанолу до формальдегіду:
Для зв'язування окислювача додають щавлеву кислоту або сульфіт натрію.
Формальдегід виявляють по реакції з розчином кодеїну в сульфатнокислому середовищі або з фуксинсірнистою кислотою.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 578; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.196.217 (0.217 с.) |