
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхневий натяг води в залежності від температури
Таблиця 3 Густина води в залежності від температури
Таблиця 4 Густина розчинів NaCl при 293 К
ВИЗНАЧЕННЯ ПЛОЩІ ТА ДОВЖИНИ МОЛЕКУЛИ ПОВЕРХНЕВО-АКТИВНОЇ РЕЧОВИНИ Для виконання роботи потрібно визначити поверхневий натяг декіль- Для визначення величини адсорбції находять різницю величини по-
де Г – величина адсорбції, моль/м2; с(х) – молярна концентрація поверхнево-активної речовини, моль/м3; R – газова стала, дорівнює 8,31 Дж/моль.К; Т – абсолютна температура, К; σ – поверхневий натяг, Дж/м2. В цьому випадку в якості с(х) беруть середнє арифметичне Одержані дані заносять в таку таблицю:
Розрахувати площу (S) і довжину (l) молекули поверхнево-активної речовини:
де N – постійна Авогадро, дорівнює 6,02×1023 моль–1; Гmax – величина граничної адсорбції, моль/м2; М(Х) – молярна маса ПАР, кг/моль; ρ – густина ПАР, кг/м3.
АДСОРБЦІЯ ОЦТОВОЇ КИСЛОТИ НА АКТИВОВАНОМУ ВУГІЛЛІ
Ізотерми адсорбції ряду речовин із розчину на поверхні твердого тіла в області середніх концентрацій задовільно описуються емпіричним рів-
де Х – кількість адсорбтиву, ммоль; m – маса адсорбенту, кг;
К і с – рівноважна молярна концентрація адсорбативу, моль/м3. Величина адсорбції
Якщо прологарифмуємо рівняння (1), то воно набуде вигляду:
Одержане рівняння є рівнянням прямої лінії.
Методика експерименту У чотири колбочки вносять по 1 г активованого вугілля і наливають із бю-
Користуючись даними таблиці, будують ізотерму адсорбції оцтової кислоти, при цьому на осі абсцис відкладають рівноважну молярну концентрацію с, а на осі ординат – значення
ДОСЛІДЖЕННЯ АДСОРБЦІЇ ЗАБАРВЛЕНИХ РЕЧОВИН ІЗ РОЗЧИНІВ У ряд пробірок помістити по 1 мл розчину з масовою часткою 0,02% метиленової сині,
Результати роботи занести в таблицю:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 460; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.178.133 (0.007 с.) |
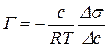 ,
,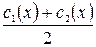 . Потім розраховують сср.(х) і будують графік залежності
. Потім розраховують сср.(х) і будують графік залежності 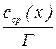 (вісь ординат) від сср.(х) (вісь абсцис). Проводять пряму, за тангенсом кута якої знаходять Г.
(вісь ординат) від сср.(х) (вісь абсцис). Проводять пряму, за тангенсом кута якої знаходять Г.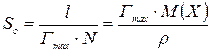 ,
, , (1)
, (1) – величини адсорбції, кмоль/кг;
– величини адсорбції, кмоль/кг;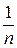 – емпіричні константи, залежні від природи адсорбенту і адсорбативу;
– емпіричні константи, залежні від природи адсорбенту і адсорбативу;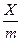 або а розраховується за формулою:
або а розраховується за формулою: . (2)
. (2) . (3)
. (3) Для визначення К і
Для визначення К і 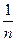 находять логарифми значень с і
находять логарифми значень с і 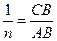 .
.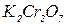 ,
, 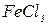 , золю
, золю 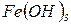 , конго червоного, водного розчину фуксину і 1 мл спиртового розчину фуксину. Потім додати в усі пробірки по 0,2 г активованого вугілля, перемішувати про-
, конго червоного, водного розчину фуксину і 1 мл спиртового розчину фуксину. Потім додати в усі пробірки по 0,2 г активованого вугілля, перемішувати про-


