Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности обмена углеводов
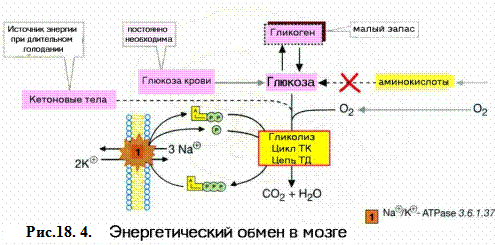
Глюкоза - главный энергетический субстрат нервной клетки. Запасы гликогена в мозге незначительны (0.1% от массы мозга). Гликоген сосредоточен, главным образом, в астроглии. Высокая потребность в энергии при низких запасах гликогена ставит нервные клетки в прямую зависимость от доставки глюкозы из крови. Из 8.9 мг глюкозы, окисленной в мозге, в сосудистое русло возвращается 1.2 мг лактата и 0.1 мг пировиноградной кислоты. Это свидетельствует о том, что основным способом окисления глюкозы является аэробное окисление. Активность гексокиназы в мозге почти в 20 раз превышает таковую в других тканях. Этот фермент прочно связан с митохондриями и в сравнении с гексокиназами мышц и печени имеет более высокое сродство к глюкозе. Подобно другим тканям, в мозге фосфофруктокиназа является основным ключевым ферментом, активность которого определяет скорость потребления глюкозы. Активаторами фермента являются фруктозо-6-фосфат, АДФ, АМФ, а ингибиторами - продукты реакции, АТФ и лимонная кислота. Перечисленные вещества позволяют осуществлять регуляцию расходования глюкозы в соответствии с метаболическими потребностями клетки. Ферменты гликолиза расположены не только в теле нейрона, но находятся и в нервных окончаниях, где обеспечивают энергией работу синапсов. Во время роста и развития мозга довольно значительная доля глюкозы окисляется по пентозофосфатному пути. НАДФН+, образуемый в этом процессе, используется в реакциях синтеза холестерола, жирных кислот и в механизмах антиоксидантной защиты. Потребность в глюкозе довольно высокая. В спокойном состоянии мозг потребляет около 5 мг глюкозы в мин на 100 г массы мозга. В обычных условиях эта потребность удовлетворяется, однако гипогликемия вызывает нарушения функции клеток мозга. Это выражается в потере сознания и судорогах. При голодании в первые часы происходит мобилизация глюкозы из депо, затем уровень глюкозы в крови поддерживается благодаря глюконеогенезу. В более поздние сроки (1 неделя) голодания в качестве источника энергии нервные клетки могут использовать кетоновые тела. Инсулин не оказывает прямого влияния на потребление глюкозы клетками мозга.
Особенности обмена белков и аминокислот Поступление аминокислот из крови в клетки мозга зависит от особенностей клеток и от гемато-энцефалического барьера. Способность клеток нервной ткани к накоплению аминокислот ограничена. В мозге имеется несколько самостоятельных зависимых от ионов натрия транспортных систем для отдельных групп аминокислот: две системы для транспорта нейтральных аминокислот и отдельные системы для транспорта кислых и основных аминокислот. Преобладающими аминокислотами в клетках нервной ткани (75% от всех аминокислот) являются глутаминовая и аспарагиновая кислоты и их производные (N-ацетиласпарагиновая, глутамин, глутатион) и ГАМК. В более высокой концентрации в мозге, по сравнению с другими клетками, находятся таурин (для него даже есть специальная система транспорта), цистатионин. Некоторые аминокислоты мозга выполняют функции нейромедиаторов (глицин, глутаминовая кислота) или используются для их синтеза (тирозин - для дофамина и норадреналина, триптофан - для серотонина, глутаминовая кислота - для ГАМК).
Некоторые реакции обмена аминокислот в мозге с участием дикарбоновых аминокислот показаны на рис.18.5. Как известно, ГАМК образуется путем декарбоксилирования глутаминовой кислоты. В головном и спинном мозге она находится в больших концентрациях. ГАМК может подвергаться переаминированию с a-кетоглутаратом с образованием янтарного полуальдегида и глутаминовой кислоты. Первый окисляется до сукцината, который включается в цикл трикарбоновых кислот. Это так называемый “шунт ГАМК“. Через него проходит до 20% -кетоглутаровой кислоты мозга. Глутаминовая кислота занимает центральное место в обмене аминокислот мозга.
Рис. 18.5. Обмен аминокислот в мозге
В мозге открыта активность почти всех ферментов синтеза мочевины (кроме карбомоилфосфат синтетазы). Поэтому образование мочевины в мозге не происходит. Нарушение поступления и обмена аминокислот вызывает значительные изменения функций. Особенности образования аммиака Аммиак образуется в мозге, главным образом, при участии аденилатдезаминазы (рис. 18.6). Атом азота аминокислоты через систему глутамат - аспартат попадает в аденилат (АМФ), который и дезаминируется. Аммиак оказывает токсическое действие на функции нейронов. Это связано с особенностями механизмов его обезвреживания в нервной ткани. Основное место в обезвреживании аммиака занимают реакции образования глютамина. В этом процессе принимают участие глутаматдегидрогеназа и глутаминсинтетаза. В качестве исходного субстрата для образования глутамина используется важный промежуточный продукт цикла трикарбоновых кислот - -кетоглутаровая кислота. Считается, что при увеличении концентрации аммиака в крови значительная часть этой кислоты используется для связывания аммиака. В результате происходит “утечка” субстратов из цикла трикарбоновых кислот. Это, в свою очередь, нарушает процессы окисления и ухудшает энергообеспеченность нервных клеток.
Рис.18.6. Схема образования аммиака в клетках мозга
Нервная ткань характеризуется высоким содержанием РНК и довольно большой скоростью образования этих молекул. В ткани мозга содержится полный набор ферментов синтеза de novo пуриновых нуклеотидов, а синтез de novo пиримидиновых нуклеотидов невозможен из-за отсутствия карбомоилфосфатсинтетазы. Зато нуклеозиды легко проходят гемато-энцефалический барьер и могут повторно включаться в синтез нуклеотидов. Недостаток одного из ферментов, катализирующих повторное использование нуклеозидов, приводит к тяжелому нарушению функций мозга (синдром Леш-Нихана). Особенности обмена липидов Нервная ткань отличается высокой интенсивностью обмена липидов в период развития организма и относительной стабильностью обмена у взрослого. Как уже указывалось, скорость обновления липидов мозга довольно низкая. Длительное голодание несущественно влияет на липидный обмен нервной ткани. В молодом возрасте нервные клетки способны синтезировать холестерол, однако в последующем идет постепенное снижение активности гидроксиметилглутарилредуктазы, замедление и прекращение синтеза холестерола. Активное образование сложных липидов идет в период миелинизации. Врожденные нарушения обмена сложных липидов сопровождаются тяжелыми нарушениями функций мозга (см. главу "Обмен липидов"). Метаболические взаимоотношения нейронов и глиальных клеток Как уже упоминалось, нервная ткань представляет сложно организованную систему клеток, причем значительную долю в ней занимают клетки нейроглии. Свыше 50% от общего числа клеток мозга приходится на долю астроцитов, что составляет около 30% всего объема мозга. Внеклеточное пространство мозга сравнительно небольшое и составляет примерно 10% общего объема мозга. Поэтому незначительные изменения объема клеток и прежде всего астроглии, влекут за собой значительные изменения количества компонентов внеклеточного пространства, что может оказывать существенное влияние на функции нервных клеток. Становится очевидным, что на транспортные свойства мембран нейроглии ложится ответственность по регуляции состава и обмена внеклеточной жидкости нервной ткани. Кроме того, учитывая особенности анатомических взаимоотношений между нейроглией и нейронами, нейроглиальные клетки оказывают существенное влияние на процессы транспорта метаболитов из крови к нейронам и обратно. К этому следует добавить, что основные запасы гликогена также сосредоточены в нейроглии, что еще больше подчеркивает ее важность в трофике нейронов.
Между нейронами и астроцитами происходит активный обмен информацией, поскольку нейроглиальные клетки способны синтезировать и секретировать разнообразные факторы роста и медиаторы, причем нейроглия разных отделов мозга секретирует разные соединения. Например, энкефалины образуются нейроглией мозжечка, коры мозга, гипоталамуса в ответ на стимуляцию их -рецепторов, а соматостатин образуется в нейроглии мозжечка, но не коры или полосатого тела. Астроциты могут синтезировать фактор роста нервов, инсулино-подобные факторы роста. Кроме того, мембраны астроцитов имеют рецепторы, позволяющие им реагировать на медиаторы нейронов. Среди такого рода рецепторов можно назвать, кроме упомянутых выше - адренорецепторов, также рецепторы к аминокислотам, в частности, ионо- и метаботропные глутаминовые рецепторы. Известно, что, в отличие от ацетилхолина, избыток которого разрушается специфическим ферментом ацетилхолинэстеразой, глутаминовая кислота не имеет такого рода ферментов, и ее уровень в синаптической щели поддерживается благодаря специальным транспортным системам в мембране астроцитов. Описаны три транспортные системы для ГЛУ в астроцитах: Na+-зависимое поглощение, CI--зависимый и Са2+-зависимый транспортные механизмы. В области синаптической передачи с использованием глутаминовой кислоты медиатор взаимодействует не только с пре- и постсинаптическими мембранами, но и с мембранами отростков астроглиальных клеток, окружающих эту синаптическую область, на которых и расположены рецепторы к ГЛУ. Активирование ионотропных ГЛУ- рецепторов открывает ионные каналы, что вызывает перенос ионов натрия внутрь клеток и обратный транспорт ионов калия. Это ведет к повышению количества ионов калия вне клеток и, в свою очередь, может привести к деполяризации пресинаптических терминалей и, в некоторых условиях, к дальнейшему высвобождению ГЛУ. В последующем повышенный уровень внеклеточного калия может оказать влияние на постсинаптическую передачу путем деполяризации нейронов и астроцитов. Опосредованная калием деполяризация постсинаптических мембран повышает нейрональную возбудимость. Внеклеточный калий, высвобождаемый при деполяризации нейронов, накапливается в клетках астроглии. Изменение уровня внеклеточного калия, высвобождаемого из нейронов, поглощение калия астроцитами и, таким образом, перераспределение ионов лежат в основе одного из путей, по которому астроглия и нейроны могут общаться между собой. Следует помнить о том, что астроциты обладают зависимым от калия и независимым от кальция механизмом высвобождения ГЛУ. Последний, в свою очередь, может оказать влияние на нейрональные ГЛУ рецепторы, образуя основу для контроля возбудимости нейронов.
Стимуляция метаботропных ГЛУ-рецепторов астроцитов ведет к активированию инозитольной системы внутриклеточных посредников, в результате чего повышается уровень внутриклеточного кальция. Это вызывает изменение активности многих Ca-зависимых регуляторных систем клетки. Астроглиальная активация ГЛУ рецепторов инициирует опосредованную кальцием передачу сигналов по щелевым контактам. Эта сигнальная система позволяет использовать внутриклеточные медиаторы для передачи сообщений, которые проводятся через глиальные клетки. С влиянием ионов кальция связывают также и изменения объема астроцитов. Важное место в этом процессе отводится карбоангидразе, активность которой в 150-200 раз превышает таковую в нейронах. Под влиянием этого фермента происходит образование угольной кислоты, которая диссоциирует, и продукты диссоциации выводятся из клетки при участии Na+ /H+ и Cl- /HCO3- переносчиков. Такой обмен приводит к накоплению NaCl, повышению осмолярности внутри клеток и набуханию астроцитов. Набухание приводит к уменьшению объема внеклеточного пространства. Изменения объема клеток, зависимые от действия регуляторов и последовавшее за этим изменение внеклеточного пространства может регулировать локальные концентрации нейромедиаторов, метаболитов и факторов роста в отдельных областях мозга. Предполагается, что система нейрон - астроглия может регулировать и микроциркуляцию в мозге. Анатомия астроглиальных клеток такова, что одна клетка может контактировать с несколькими синаптическими областями, с другими астроцитами и поддерживать контакты с капиллярами. Кандидатом в исполнители такой кооперации может быть оксид азота. ГЛУ стимулирует образование астроцитами NO, который способен увеличивать скорость кровотока. Метаболические основы электрогенеза. В этом подразделе мы будем исходить из того, что читатель уже имеет представление об основах нейрофизиологии и нейроанатомии. Поэтому мы обсудим группу заболеваний, в механизме развития которых отчетливо просматриваются биохимические аспекты: миастению гравис, инсульт, заболевания, развившиеся вследствие мутаций в митохондриальной ДНК, синдром ломкой Х-хромосомы и другую патологию, обусловленную повтором триплетов в ДНК, болезнь Паркинсона, болезнь Альцгеймера и шизофрению. Все названные нервно-психические расстройства характеризуются хроническим течением и нарушением интеллектуальных функций, приводящим к деградации личности. Примечательные данные приводит Национальный фонд исследования мозга (США). Только в этой стране прямые затраты на заболевания, связанные с расстройством функций мозга (психиатрические, неврологические, алкоголизм и др.), составляют более 401 млрд долларов в год или 1/7 всех расходов на здравоохранение США.
|
||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 669; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.143.181 (0.015 с.) |