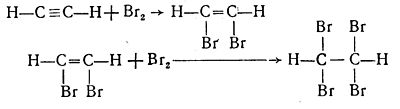Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Інструкція для виконання лабораторної роботи № 4
Тема: Добування ацетилену із карбіду кальцію і вивчення його властивостей 1 Мета: 1.1Ознацомитися з лабораторним методом одержання ацетилену-представника ненасичених вуглеводнів. 1.2Вивчити властивості ацетилену. 1.3Закріпити теоретичні знання на практиці. 2 Матеріально-технічне та навчально-методичне забезпечення: 2.1 Інструкція для виконання лабораторної роботи № 4 2.2 Прилад для добування ацетилену. 2.3 Кальцій карбід (у кусочках), насичений розчин бромної води, 1%-ний розчин калій перманганату, мило. (Дослід проводять під витяжною шафою.) 3 Теоретичні відомості: Ацетиле́н — найпростіший і найважливіший представник ненасичених вуглеводнів з одним потрійним зв'язком (алкінів). Ацетилен — при нормальних умовах — безбарвний газ без запаху, малорозчинний в воді, легший за повітря. При сильному охолодженні переходить відразу в білу кристалічну речовину, минаючи рідкий стан. При —83,6°С випаровується (сублімує), не плавлячись. При стисненні розкладається з вибухом, зберігають в балонах, заповнених активованим вугіллям, що просочене ацетоном, в якому ацетилен розчиняється під тиском в великих кількостях. Вибухонебезпечний. C2Н2 виявлений на Урані і Нептуні. Молекулярна формула C2Н2. У хімічному відношенні ацетилен активніший, ніж етилен. Висока хімічна активність ацетилену обумовлюється наявністю в його молекулі потрійного зв'язку. Для ацетилену, як і етилену, характерні реакції окиснення, приєднання і полімеризації. Так, ацетилен легко знебарвлює бромну воду, приєднуючи при цьому бром за місцем розриву спочатку одного, а потім і другого зв'язку з утворенням відповідно диброметилену С2Н2Br2, а потім тетраброметану С2Н2Br4
У присутності порошку нікелю як каталізатора ацетилен легко вступає і в реакцію гідрогенізації. При цьому, як і в попередньому випадку, реакція відбувається у дві стадії. Спочатку утворюється етилен, а потім етан:
При взаємодії з хлороводнем у присутності каталізатора ацетилен утворює хлорвініл СН2=CHCl:
Ця реакція має велике практичне значення, оскільки хлорвініл широко використовується для одержання полімерних матеріалів. Ацетилен вступає також у реакцію гідратації з утворенням ацетальдегіду і реакції полімеризації з утворенням бензолу. На повітрі ацетилен горить чадним полум'ям, а в атмосфері кисню — сліпучо-яскравим полум'ям з виділенням значної кількості тепла. З повітрям ацетилен утворює вибухову суміш.
Застосування: головною галуззю застосування ацетилену є хімічна промисловість. Ацетилен служить вихідною сировиною для синтезу таких важливих хімічних продуктів, як пластмаси, бензол, ацетатна кислота і ін. У техніці значні кількості ацетилену використовуються при автогенному зварюванні і різанні металів. 4 Хід роботи: 4.1 Одержання ацетилену. Ацетилен добувають у такому самому приладі, що й етилен. У пробірку поміщають 2-3 кусочки кальцій карбіду і закріплюють її в штативі вертикально. Наливають розчин сульфатної кислоти (1:3) об’ємом до 3 мл. Ацетилен, що при цьому виділяється, використовують для вивчення його хімічних властивостей. Записати рівняння реакції. 4.2 Взаємодія ацетилену з бромною водою. У пробірку вносять 1 мл бромної води і через неї пропускають ацетилен. Що спостерігають? Оскільки бром приєднується за місцем потрійного зв’язку ацетилену з утворенням тетраброметану. Реакція приєднання брому відбувається у дві стадії. Які продукти утворюються, записати рівняння реакцій. 4.3 Взаємодія ацетилену з водним розчинам калій перманганату. У пробірку вносять 1 мл 1%-ного розчину калій перманганату і через нього пропускають ацетилен. Що спостерігають? Під час окиснення ацетилену також розривається потрійний зв'язок. 4.4 Горіння ацетилену. Кінець газовідвідної трубки, з якої виділяється ацетилен, опускають у фарфорову чашку, наповнену мильною водою (1 г мила, 30-40 мл води). До мильних бульбашок, які при цьому утворюються, підносять запалену скалку. Спостерігають, як ацетилен горить кіптявим полум'ям, про що це свідчить? 5 Висновки: 6 Контрольні питання: 6.1 Напишіть рівняння реакції горіння ацетилену і розставте коефіцієнти. Обчислити масові частки карбону (у процентах) у та порівняйте їх. 6.2 Скільки літрів повітря потрібно для повного згоряння 1л метану, етилену і ацетилену? 6.3 Чим відрізняються за складом ацетиленові вуглеводні? 6.4 Яка найхарактерніша хімічна властивість ненасичених вуглеводнів?
Література: 1 Потапов В.М., Татаринчик С.Н. Органическая химия, учебник для учащихся химических и химико-технологических специальностей техникумов. -Москва: «Химия», 1989. 2 Буринська Н.М., Величко Л.П. Хімія. Підручник 10 клас для загальноосвітніх навчальних закладів.- Київ: «Перун», 2002.
|
||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 483; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.147.190 (0.007 с.) |