Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
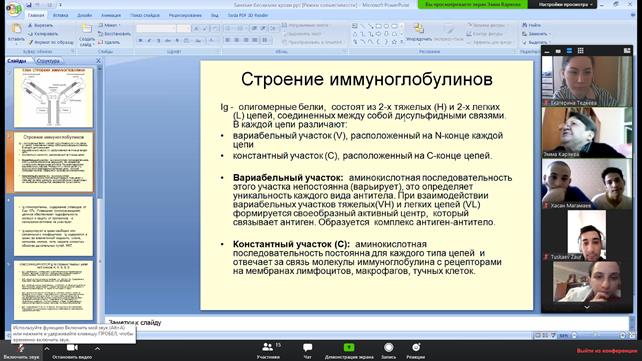
Гамма-глобулины - защитные белки
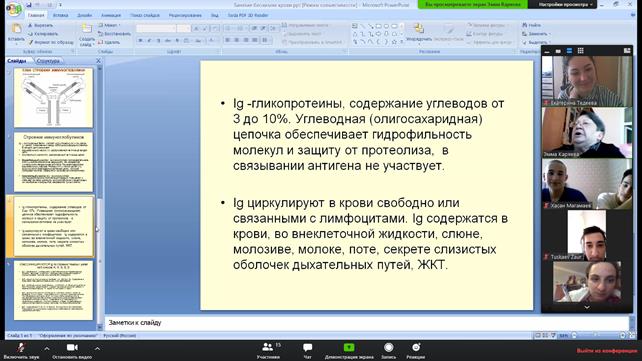
Данная фракция белков содержит иммуноглобулины G, A, M, Е, D. Иммуноглобулины часто упрощенно называют антителами. Иммуноглобулины G – основные иммуноглобулины сыворотки, осуществляют гуморальную защиту организма от бактерий и вирусов и их растворимых токсинов (антигенов). Активно транспортируются через плаценту. У детей должная концентрация достигается только к 1,5-2 годам. Иммуноглобулины А осуществляют местный иммунитет на слизистых поверхностях дыхательных путей (носовой и бронхиальный секрет) и кишечного тракта. Они присутствуют в женском молозиве, слезе, слюне. После рождения количество секреторного IgA (на слизистых) достигает уровня взрослых уже на 2-3 неделе жизни, сывороточного IgA – только к 14-15 годам. Иммуноглобулины М появляются в процессе формирования иммунного ответа, являясь первичными антителами. Вскоре после рождения их уровень нарастает, достигает максимума к 9 месяцу жизни, после чего снижается и восстанавливается только к 20-30 годам. Иммуноглобулины Е вырабатываются плазматическими клетками и участвуют в аллергических реакциях организма. Иммуноглобулины D не имеют четкой сформированной функции. Предполагается, что они регулируют активность других иммуноглобулинов м участвуют в антиген-зависимой дифференцировке лимфоцитов.
Синтез иммуноглобулинов значительно отличается от синтеза других белков. Каждая из L-цепей кодируется группой из 3-х различных генов, а Н-цепь - четырьмя генами. Таким образом обеспечивается огромное разнообразие структуры антител, их специфичность к различным антигенам. В организме человека потенциально возможен синтез приблизительно 1 миллиона различных антител. Небелковый органический состав плазмы крови, остаточный азот. Азотемия: продукционная и ретенционная. МИНЕРАЛЬНЫЕ ВЕЩЕСТВА. Все минеральные вещества в зависимости от их концентрации подразделяются на макро- и микроэлементы. Макроэлементы. К ним относят те минеральные вещества, содержание которых превышает 50 мг/кг массы тела. Прежде всего, это «классические электролиты» - натрий и калий, а также кальций, магний, фосфат, хлорид, сульфат. Микроэлементы. Содержание этих «следовых» элементов - менее 50 мг/кг массы тела. К микроэлементам относят также железо, хотя его концентрация превышает указанную величину.
По своему биологическому значению минеральные вещества можно разделить на незаменимые, не являющиеся незаменимыми, токсичные. Функции минеральных веществ: 1) поддержка электролитного баланса; 2) поддержка определенного осмотического давления; 3) создание определенных условий растворимости; 4) участие в механизмах возбудимости; 5) влияние на обменные процессы путем активирования или ингибирования ферментов; 6) минерализация костей скелета и зубов. Среди макроэлементов особого внимания заслуживает исследование содержания натрия и калия в плазме крови.
НАТРИЙ. Натрий — основной внеклеточный катион, это основной осмотически активный ион. В плазме крови его концентрация колеблется от 132 до 150 ммоль/л. Гипонатриемия — уменьшение концентрации натрия ниже 134 ммоль/л — обусловливает симптомокомплекс, характеризующийся появлением апатии, потерей аппетита, тошнотой, рвотой, нарушением рефлексов, тахикардией, анурией, гипотензией, психозами. Различают абсолютную и относительную гипонатриемию: Абсолютная, или синдром солевой недостаточности, возникает при уменьшении поступления натрия в организм и потере натрия через желудочно-кишечный тракт, с мочой, кровью, большим количеством удаляемой асцитической или отечной жидкости; гипернатриурия наблюдается у больных, страдающих первичным и вторичным гипокортицизмом, гипоальдостеронизмом, нефропатиями с потерей солей. Она может быть результатом депонирования натрия в так называемом «третьем пространстве» (при массивном выпоте в плевру, быстром развитии асцита, отеков). К снижению содержания натрия приводят и связанный с глубокими метаболическими нарушениями синдром «усталости клеток» при котором истощается мембранный натриевый насос и ионы натрия по градиенту концентрации направляются внутрь клетки. Относительная гипонатриемия формируется при введении в организм жидкостей, не содержащих электролиты, что способствует разведению. К относительной гипонатриемии приводит и синдром неадекватной секреции антидиуретического гормона.
Гипернатриемия — увеличение концентрации ионов натрия выше 169 ммоль/л — сопровождается тяжелым общим состоянием больных, повышением температуры тела, тахикардией. Абсолютная гипернатриемия может быть обусловлена задержкой ионов электролита в плазме крови у больных с повышенной функцией коры надпочечников (при гиперальдостеронизме, синдроме и болезни Иценко-Кушинга), усилением выделения натрия из тканей в плазму в процессе активации метаболизма у лиц, страдающих гнойно-септическими заболеваниями, судорогами, лихорадкой; при избыточной терапии солевыми растворами. Относительная гипернатриемия вызывается повышенной потерей воды через кожу (профузный пот), легкие (длительная гипервентиляция), желудочно-кишечный тракт (тяжелая рвота), почки (полиурические состояния). КАЛИЙ. Калий — основной внутриклеточный катион, концентрация его в плазме крови колеблется от 3,8 до 5,4 ммоль/л. Гипокалиемия — уменьшение концентрации калия в плазме крови ниже 3,5 ммоль/л - приводит к тяжелым нарушениям в организме человека. Основные клинические симптомы гипокалиемии: общая мышечная слабость, легкое утомление, тахикардия, экстрасистолия. Гипокалиемия отмечается при недостаточном приеме калия с пищей, хроническом голодании, длительном, в больших количествах введении растворов с недостаточным содержанием этого иона; усиленном выделении калия с мочой — под влиянием диуретиков, при канальцевом ацидозе, недостаточности функции почечных канальцев и т.д. Гиперкалиемия — увеличение концентрации калия в плазме крови выше 5,6 ммоль/л. Сопровождается ощущением «ползания мурашек», исчезновением сухожильных рефлексов, «одеревенением» конечностей, параличом дыхательным мышц, сердечными симптомами: тахи- и брадикардией, часто аритмиями.
КАЛЬЦИЙ. Кальцию принадлежит весьма важная роль в осуществлении процессов жизнедеятельности. Он влияет на проницаемость биологических мембран, возбудимость нервов и мышц, участвует в нервно-мышечной передаче, сокращении и расслаблении мускулатуры, формировании кости и хряща, воздействует на обмен веществ в клетках, секрецию гормонов, секреторную деятельность желудка, является важным фактором свертывания крови. Уровень кальция в плазме крови зависит от: 1. количества кальция поступающего в организм; 2. величины экскреции; 3. состояния процессов обмена кальция между кровью и костной тканью. В норме концентрация общего кальция в плазме колеблется в пределах: 2,25-2,75 ммоль/л (эритроциты содержат — около 0,5 ммоль/л Са2+, лейкоциты — около 2,5 ммоль/л). Большая часть кальция (44-46%) связана с белками плазмы, преимущественно с альбумином. Содержащийся в сыворотке крови кальций по своему составу неоднороден: 1. связанный с белками (преимущественно альбумином): коллоидальный, недиффундирующий, составляющий около 0,9 ммоль/л; 2. диализирующийся кальций — 1,6 ммоль/л. В его состав входит ионизированный и связанный с гидрокарбонатом, цитратом и другими анионами; Наибольшее физиологическое значение имеет ионизированный кальций, составляющий 50% всего количества кальция крови. Гиперкальциемия бывает физиологической и патологической. Физиологическая гиперкальциемия имеет место у новорожденных (после 4-го дня жизни), у недоношенных, а также у некоторых лиц после принятия пищи.
В патологических условиях гиперкальциемия наблюдается при гиперпаратиреоидизме (до 7,25 ммоль/л) вследствие мобилизации ионов кальция и фосфата из костей; стимулировании реабсорбции кальция и торможении обратного всасывания фосфат- ионов клетками канальцевого эпителия почек. Гипокальциемия отмечается гораздо чаще, чем гиперкальциемия. Особенно большое значение имеет в детском возрасте гипокальциемия при спазмофилии (тетании). При явной спазмофилии уровень кальция в крови падает до 1,5 ммоль/л и ниже. При скрытой форме заболевания он варьирует в пределах 1,5-2,0 ммоль/л. Гипокальциемией сопровождаются и некоторые заболевания почек, особенно хронические. Она возникает при хронической почечной недостаточности, поражении проксимальных и дистальных канальцев почек, циррозе печени, цистинозе, лепре, остеомаляции.
МАГНИЙ. Магний — электролит, метаболизм которого тесно связан с обменом кальция. Общее содержание магния в организме взрослого человека 20-30 г, 1/3 из которого сосредоточена в костях, зубах, 1/5 — в мышцах. Магний поступает в организм человека с растительной пищей, мясными продуктами. Много его в бананах, апельсинах, шоколаде, миндале. Подобно калию магний является внутриклеточным катионом. Среди заболеваний, сопровождающихся снижением уровня магния в крови различают: желудочно-кишечные (потребление пищи с низким уровнем белка, длительная диарея, синдром нарушенного всасывания магния в кишечнике, опухоли кишечника); сердечно-сосудистые; почечные; эндокринные расстройства. Клиническая симптоматика гипомагниемии (проявляется при концентрации магния 0,5 ммоль/л и менее) — мышечные подергивания, судороги, конвульсии и психические расстройства. Гипермагниемия обусловливает сонливость, которая снимается введением ионов кальция. При повышенном (более 1,2 ммоль/л) содержании ионов магния в крови могут наступить угнетение дыхательного центра, кома, нарушение проводимости миокарда, блокада и остановка сердца. Гипермагниемия наблюдается при острой и хронической почечной недостаточности, анурии, уремии, гипотиреозе.
ХЛОР. Хлорид-ион — главный внеклеточный анион. Хлор находится в организме в ионизированной форме: в виде анионов солей натрия, калия, кальция, магния. Хлориды выводятся из организма в основном (почти на 90%) с мочой, а также с потом и калом. Гипохлоремия развивается при уменьшении концентрации ионов хлора в плазме ниже 95 ммоль/л. Она встречается при формах обезвоживания, связанных с избыточным потоотделением, часто повторяющимися поносами, длительной рвотой.
Гиперхлоремия (относительная и абсолютная) возникает при концентрации хлорид-ионов в плазме свыше 105 ммоль/л и тесно связана с гипернатриемией. Она возникает при обезвоживании, вызванном недостаточным поступлением жидкости, нарушением функций почек.
ФОСФОР. Неорганический фосфор плазмы (сыворотки) крови состоит из компонентов кислоторастворимой фракции фосфора, включающей в себя также пирофосфаты (АТФ, АДФ и др.), гексозо-, глицерофосфаты и т.д. Кислоторастворимый фосфор вместе с кислотонерастворимым (фосфор нуклеопротеинов и липидов) образует так называемый общий фосфор плазмы крови. Концентрация неорганического фосфора в сыворотке крови во многом зависит от функции паращитовидных, щитовидных желез, влияние на его обмен витамина D, функции почек. Гиперфосфатемия встречается при почечной недостаточности, гипопаратиреоидизме, акромегалии, сахарном диабете, кетозе, приеме больших доз витамина D, УФ-облучении, спазмофилии. Гиперфосфатемия свойственна периоду заживления костных переломов (благоприятный признак). Мышечная работа сопровождается повышением содержания неорганического фосфора в результате расщепления органических фосфорных соединений (АТФ, креатинфосфат). Гипофосфатемия в детском возрасте наблюдается при рахите. Важно отметить, что снижение уровня неорганического фосфора в сыворотке крови отмечается в ранней стадии рахита (0,19-0,97 ммоль/л), когда клинические симптомы ещё недостаточно выражены.
ЖЕЛЕЗО. Запасы железа в организме сосредоточены в депонирующих органах, где оно накапливается в виде железосодержащего белка ферритина, а также в виде гемосидерина. Ферритин представляет собой универсальный депонирующий железо белок, присутствующий во всех клетках и тканях организма. Концентрация ферритина 1 мкг/л соответствует содержанию 8 мг резервного (запасного) железа в организме. Снижение содержания ферритина сыворотки отмечается при: железодефицитных состояниях и заболеваниях, связанных с нарушением метаболизма железа, анемиях, сопровождающих беременность. Повышение содержания ферритина сыворотки наблюдается: 1. вследствие перераспределения фондов железа при: заболеваниях, связанных с нарушением кровообращения: инсультах, инфаркте миокарда; 2. острых и хронических заболеваниях, связанных с поражением печеночных клеток: гепатитах, циррозах различной этиологии, алкогольных поражениях печени; 3. системной красной волчанке, ревматоидном полиартрите; онкологических заболеваниях: раке молочной железы, лимфогранулематозе и др. 4. вследствие некротических и некробиотических процессов; Железо — один из важнейших олигоэлементов, в плазме крови его концентрация составляет в среднем 0,02 ммоль/л.
Снижение количества железа в организме и плазме крови может быть вызвано: 1. недостаточным поступлением с пищей, например при длительном молочно-растительном питании; 2. плохим усвоением в желудочно-кишечном тракте: при анацидных и гипоцидных гастритах, резекции желудка и кишечника, при глистных инвазиях; 3. усиленной утилизацией органами и тканями: при беременности, быстром росте организма, повышенной физической активности; 4. потерей железа: при кровотечениях, дисфункциональных маточных кровотечениях, фибромиомах, вследствие активации клеточных элементов системы фагоцитирующих мононуклеаров; 5. временным перераспределением железа в организме: при системных заболеваниях соединительной ткани; злокачественных новообразованиях. Дефицит железа может быть: скрытым — характеризуется уменьшением содержания или отсутствием резервного железа, нормальным уровнем гемоглобина и железа в какой-то промежуток времени; относительным, обусловленным перераспределением железа при воспалительных процессах, инфекционных заболеваниях, некрозах и опухолях; абсолютным, характеризующимся отсутствием резервного железа, снижением уровня сывороточного железа, гипогемоглобинемией; Содержание сывороточного железа крови значительно уменьшено при железодефицитной анемии. МЕДЬ. Медь содержится как в эритроцитах, так и в плазме крови. Около 90% меди плазмы входит в состав церулоплазмина (Cu- альфа-2-глобулинового комплекса), незначительная часть ионов меди находится в свободном состоянии. Медь играет важную биологическую роль, так как является составной частью ряда ферментов, участвуя в обмене витаминов, гормонов, белков, углеводов, а также в некоторых иммунных процессах. Возрастание концентрации меди (а также церулоплазмина) отмечается при состояниях, связанных с распадом клеточных элементов: пернициозной, мегалобластической и апластической анемии, осложнениях гемодиализа, большой и малой талассемии, лейкозах, лимфогранулематозе, злокачественных новообразованиях желудочно-кишечного тракта. Снижение содержания меди и активности церулоплазмина в плазме (сыворотке) крови отмечается при болезни Вильсона-Коновалова (гепатолентикулярной дегенерации), нефротическом синдроме, ожогах, хронической ишемической болезни сердца и некоторых железодефицитных анемиях. ЦИНК. Цинк всасывается в тонкой и подвздошной кишках. В крови он связывается с белками плазмы, в основном с альбуминами, которые поставляют этот микроэлемент в ткани, а также с β2-макроглобулином. Концентрация цинка в плазме составляет 100-140 мкг/ 100 мл (15-20 мкмоль). Основное количество (75 %) цинка крови приходится на эритроциты (он входит в состав карбангидразы), в лейкоцитах содержится 3 % (в составе фосфатазы). Цинк является незаменимой составной частью или кофактором более 300 ферментов (панкреатической карбоксипептидазы, глутамат-, манат-, лактатдегидрогеназ, алкогольдегидрогеназы, щелочной фосфатазы, карбангидразы и др.). Различают два способа его действия: 1) активация ферментативной реакции; 2) стабилизирует четвертичную структуру белков и удерживать аминокислотные цепи в порядке, благоприятном для химического катализа. Цинк является составной частью ДНК-связывающих белков, служит стабилизатором мембран, активатором тимулина - пептида, ответственного за стимуляцию активности Т-лимфоцитов. При врожденном дефиците цинка — энтеропатическом акродерматите - отмечаются изменения кожи (образование везикул и пустул) вследствие нарушенной проницаемости базальных клеток, а также гастроинтестинальный синдром. В основе заболевания лежит генетический дефект цинктранспортирующей системы в клетках слизистой оболочки кишечника, что влечет за собой нарушения всасывания и падение концентрации цинка в крови. Приобретенный дефицит цинка (при остром воспалении, заболеваниях кишечника, др.) приводит к расстройствам гуморального и клеточного иммунного ответа, нарушению барьерной функции кожи, бесплодию, выпадению волос. Развивается «куриная слепота», снижается обоняние. СЕЛЕН. Селен – мощный антиоксидант и антиканцероген. Глутатионпероксидаза является важнейшим звеном ферментативной антиоксидантной системы организма. Селен – входит в состав ферментов синтеза трийодтиронина. Ежедневно в организм должно поступят селена 100 мкг. Хроническая недостаточность селена проявляется кардиомиопатией, способной провоцировать приступы стенокардии и инфаркт миокарда. Нередко дисфункция щитовидной железы связана не с недостаточностью йода, а с дефицитом селена в организме.
МАРГАНЕЦ. В организме содержится 10-15 мг марганца. Всасываясь из кишечника, марганец связывается в крови с β-глобулинами, быстро захватывается тканями и в них - митохондриями. Поэтому ткани, богатые митохондриями, имеют повышенные концентрации марганца. Роль Мn2+ в метаболизме достаточно многогранна: 1. активирование ферментов глюконеогене-за - пируваткарбоксилазы и фосфоенолпируваткарбоксикиназы; 2. активирование аргиназы (фермент синтеза мочевины); 3. активирование изоцитратдегидрогеназы цикла Кребса; 4. марганец входит в состав активного центра митохондриальной Мп2+-СОД - важнейшего фермента антиоксидантной защиты митохондрий; 5. играет важную роль в обмене хрящевой и костной тканей, участвуя в синтезе протеогликанов. Дефицит элемента ведет к задержке роста, нарушению полового созревания, деформации скелета.
ЙОД. Йод необходим для синтеза гормонов щитовидной железы - тироксина и трийодтиронина. Щитовидная железа активно захватывает из крови йод и при участии йодидпероксидазы окисляет его в I2, который необходим для йодирования аминокислоты тирозина, используемого в синтезе тиреоидных гормонов. Уменьшение поступления йода в организм приводит к развитию зоба — компенсаторному увеличению щитовидной железы, однако продолжающийся дефицит йода приводит к развитию гипотиреоза.
Ф ТОР. Концентрация фтора в плазме крови составляет 0,01-0,02 мг/100 мл. У взрослого человека 99 % общего количества фтора находится в костях и зубах, остальное количество - в других тканях и межклеточной жидкости. При недостатке фтора уменьшается содержание фторгидроксиапатита в скелете, что является одной из важных причин развития остеопороза, а также деминерализация зуба ведет к кариесу.
Фракции остаточного азота Раньше в лабораториях широко использовалось определение общего содержания остаточного азота. Так как показатель включает различные низкомолекулярные азотсодержащие вещества, более информативным является определение отдельных фракций остаточного азота. К фракциям остаточного азота относится мочевина (перейти) (около 50%), аминокислоты(около 25%), эрготионеин (строение) (около 8%), креатин и креатинин (до 7,5%) (перейти), пептиды, нуклеотиды и азотистые основания (около 5%) (перейти), мочевая кислота(до 4%) (перейти), аммиак и индикан (0,5%). Небелковый азот крови называют также остаточным азотом. У здорового человека колебания в содержании небелкового, или остаточного азота крови незначительны и в основном зависят от количества поступающих с пищей белков. При ряде патологических состояний уровень небелкового азота в крови повышается. Это состояние носит название азотемии. Азотемия в зависимости от причин, вызвавших ее, подразделяется на ретенционную и продукционную. Ретенционная азотемия наступает в результате недостаточного выделения с мочой азотсодержащих продуктов при нормальном поступлении их в кровяное русло. Она в свою очередь может быть почечной и внепочечной. При почечной ретенционной азотемии концентрация остаточного азота в крови увеличивается вследствие ослабления очистительной (экскреторной) функции почек. Резкое повышение содержания остаточного азота при ретенционной почечной азотемии происходит в основном за счет мочевины. В этих случаях на азот мочевины приходится 90% небелкового азота крови, вместо 50% в норме. Внепочечная ретенционная азотемия может возникнуть в результате тяжелой недостаточности кровообращения, снижения артериального давления и уменьшения почечного кровотока. Нередко внепочечная ретенционная азотемия является результатом наличия препятствия оттоку мочи после ее образования в почках. Продукционная азотемия наблюдается при избыточном поступлении азотсодержащих продуктов в кровь, как следствие усиленного распада тканевых белков. Нередко наблюдаются азотемии смешанного типа. 144.Липопротеиновый состав плазмы крови, характеристика и клиническое значение определения липопротеинов. Гиперлипопротеинемии. Липопротеины в крови имеются постоянно, но их концентрация меняется в зависимости от ритма питания. После приема пищи концентрация липопротеинов повышается, достигает максимума через 4—5 ч, а затем вновь снижается. За нормальное принимают содержание липопротеинов у здоровых людей через 10-12 ч после еды (постабсорбтивное состояние; кровь для анализа берут утром до завтрака). В этом состоянии в крови здоровых людей отсутствуют хиломикроны и обнаруживаются только ЛОНП (около 15% от всех липопротеинов), ЛНП (60%) и ЛВП (25%). Практически весь холестерин и все жиры плазмы крови находятся в липопротеинах. При повышенном содержании липопротеинов в крови (гиперлипо-протеинемии) одновременно повышено содержание холестерина и жиров. Концентрация холестерина в большей мере связана с концентрацией ЛНП и ЛВП, а жиров—с концентрацией хиломикронов или ЛОНП В связи с этим различают три формы гиперлипопротеинемии: 1) гиперхолестеринемия (повышена концентрация ЛНП или ЛВП); 2) гипертриацилглицеринемия (повышена концентрация хило-микронов или ЛОНП); 3) смешанная форма. Гиперлипопротеинемии — очень распространенные нарушения обмена: они обнаруживаются примерно у каждого десятого человека. Главная опасность гиперлипопротеинемий связана с тем, что повышается вероятность возникновения атеросклероза. По механизму возникновения гиперлипопротеинемий делят на наследственные (первичные) и приобретенные (вторичные).
Вторичные гиперлипопротеинемий — обычное явление при таких хронических заболеваниях, как сахарный диабет, нефрозы, гепатиты, хронический алкоголизм. Клинико‑диагностическое значение Изменения в спектре отдельных фракций липопротеинов не всегда сопровождаются гиперлипидемией, поэтому наибольшее клинико‑диагностическое значение имеет выявление типов дислипопротеинемий, которое проводят по принципам, общим с типированием гиперлипопротеинемий по Фредриксону с соавт. (1965, 1971) с введением дополнительных типов гипер‑α‑ и гипо‑α‑липопротеинемий и гипоβ‑липопротеинемии: Ферменты крови. Ферменты в диагностике заболеваний. Примеры.
Ферменты сыворотки крови I. Ферменты, секретируемые в плазму, и выполняющие в ней специфические функции – истинноплазменные ферменты. В плазме их активность много больше, чем в органах (церулоплазмин, псевдохолинэстераза, липопротеинлипаза, белковые факторы систем свертывания крови, фибринолиза и кининогенеза, ренин). II. Ферменты, не характерные для плазмы – органоспецифичные. Именно определение активности этих ферментов чаще всего используют для верификации диагноза и контроля лечения. Выделяют две группы органоспецифичных ферментов: 1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации: Например, · при изменениях со стороны сердечной мышцы происходит повышение активности сердечного изофермента креатинкиназы (КК-MB), изоферментов лактатдегидрогеназы 1 и 2 (ЛДГ-1 и ЛДГ-2), аспартатаминотрансферазы, · нарушения скелетных мышц – мышечного изофермента креатинкиназы (КК-MM), алкогольдегидрогеназы, · костной ткани – щелочной фосфатазы (ЩФ), альдолазы (АЛД), · предстательной железы – кислой фосфатазы, · гепатоцитов – аланинаминотрансферазы, глутаматдегидрогеназы, холинэстеразы, сорбитолдегидрогеназы, · желчевыводящих путей – щелочной фосфатазы, γ-глутамилтранспептидазы (γ-ГТП). 2. Ферменты, экскретируемые в выводные протоки желчных путей, панкреатические и слюнные протоки. В норме активность таких ферментов в плазме намного ниже, чем в клетках и имеет постоянное значение (α-амилаза, липаза поджелудочной железы). Изучение активности этих ферментов позволяет судить о функционировании соответствующего органа.
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 42; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.39.32 (0.073 с.) |