
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биосинтез и мобилизация гликогена: последовательность реакций, регуляция гормонами, физиологическое значение.
1. Гликоген - основной резервный полисахарид в клетках животных. Гликоген представляет собой разветвленный гомополисахарид, мономером которого является глюкоза. Остатки глюкозы соединены в линейных участках а1,4-гликозидными связями, а в местах разветвления - связями α1,6. Молекула гликогена более разветвлена, чем молекула крахмала, точки ветвления встречаются через каждые 8-10 остатков глюкозы. Разветвленная структура гликогена обеспечивает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры, так как эти ферменты могут одновременно работать на многих ветвях молекулы гликогена. Гликоген депонируется главным образом в печени и скелетных мышцах и хранится в цитозоле клеток в форме гранул. Гранулы гликогена плохо растворимы в воде и не влияют на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. С гранулами связаны и некоторые ферменты, участвующие в обмене гликогена, что облегчает взаимодействие ферментов с субстратами. 2. Синтез гликогена. Гликоген синтезируется в период пищеварения (абсорбтивный период: 1-2 часа после приема углеводной пищи) в основном в печени и в мышцах. Этот процесс требует затрат энергии, так включение одного мономера в полисахаридную цепь сопряжено с расходованием АТФ и УТФ (рис. 6.4, реакции 1 и 3). Образованная УДФ-глюкоза (реакция 3) является субстратом для гликогенсинтазы, которая переносит остаток глюкозы (реакция 4) на праймер (олигосахарид из 4-8 остатков глюкозы) и соединяет его а1,4-глюкозной связью. Когда длина синтезируемой цепи увеличивается на 11-12 остатков глюкозы, фермент ветвления - глюкозил- 1,4-1,6-трансфераза (реакция 5) образует боковую цепь путем переноса фрагмента из 5-6 остатков глюкозы на внутренний остаток глюкозы, соединяя
Итак, регуляция скоростей синтеза и распада гликогена в печени поддерживает постоянство концентрации глюкозы в крови (3,3-5,5 ммоль/л). Регуляция обмена гликогена в мышцах обеспечивает энергетическим материалом как интенсивную работу мышц, так и энергозатраты в состоянии покоя. |
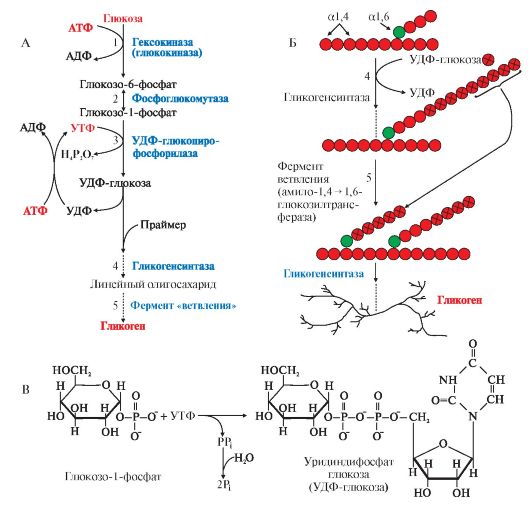
 его а1,6-гликозидной связью. Затем удлинение цепей и ветвление их повторяется много раз. В итоге образуется сильно разветвленная молекула, содержащая до 1млн глюкозных остатков.
его а1,6-гликозидной связью. Затем удлинение цепей и ветвление их повторяется много раз. В итоге образуется сильно разветвленная молекула, содержащая до 1млн глюкозных остатков.
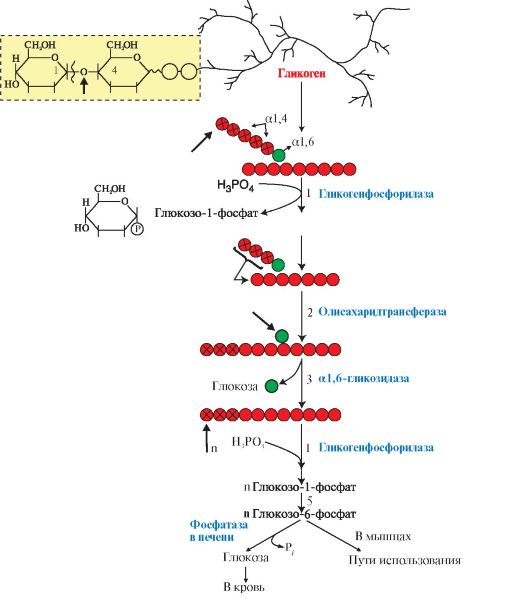
3. Мобилизация (распад) гликогена происходит в интервалах между приемами пищи (постабсорбтивный период) и ускоряется во время физической работы. Этот процесс осуществляется путем последовательного отщепления остатков глюкозы, в виде глюкозо-1-фосфата (рис. 6.5, реакция 1) с помощью гликогенфосфорилазы, расщепляющей а1,4-гликозидные связи. Этот фермент не расщепляет а1,6-гликозидные связи в местах разветвлений, поэтому необходимы еще два фермента, после действия которых остаток глюкозы в точке ветвления освобождается в форме свободной глюкозы (рис. 6.5, реакции 2 и 3). Гликоген распадается до глюкозо-6-фосфата и свободной глюкозы без затрат АТФ.
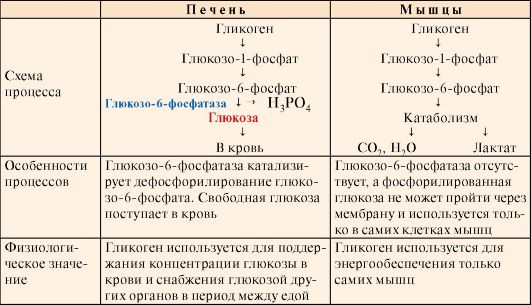
Мобилизация гликогена в печени отличается от таковой в мышцах одной реакцией (реакция 5), обусловленной наличием в печени фермента глюкозо- 6-фосфатазы.
Присутствие в печени глюкозо-6-фосфатазы обеспечивает главную функцию гликогена печени - высвобождение глюкозы в кровь в интервалах между едой для использования ее другими органами. Таким образом, мобилизация гликогена печени обеспечивает поддержание глюкозы в крови на постоянном уровне 3,3-5,5 ммоль в постабсорбтивном периоде. Это обстоятельство является обязательным условием для работы других органов и особенно мозга. Через 10-18 часов после приема пищи запасы гликогена в печени значительно истощаются, а голодание в течение 24 часов приводит к полному его исчерпанию.
Функция мышечного гликогена заключается в обеспечении клеток глю- козо-6-фосфатом, используемым в самой мышце для окисления и получения энергии или других целей (табл. 6.2).
|
|
Таблица 6.2. Особенности мобилизации гликогена в печени и в мышцах
 4. Переключение процессов синтеза и мобилизации гликогена в печени и мышцах происходит при переходе из абсорбтивного состояния в постабсорбтивное и из состояния покоя в режим физической работы. В переключении этих метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах - инсулин и адреналин.
4. Переключение процессов синтеза и мобилизации гликогена в печени и мышцах происходит при переходе из абсорбтивного состояния в постабсорбтивное и из состояния покоя в режим физической работы. В переключении этих метаболических путей в печени участвуют инсулин, глюкагон и адреналин, а в мышцах - инсулин и адреналин.
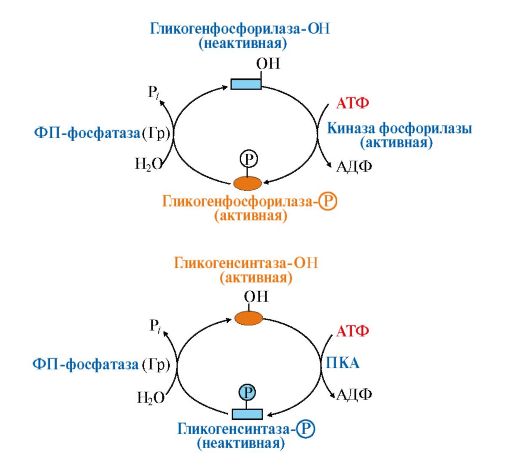
Влияние этих гормонов на синтез и распад гликогена осуществляется путем изменения в противоположном направлении активности двух ключевых ферментов: гликогенсинтазы и гликогенфосфорилазы с помощью их фосфорилирования и дефосфорилирования (рис. 6.6).
 Первичным сигналом для синтеза инсулина и глюкагона является изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при переходе из абсорбтивного периода в постабсорбтивный изменяется их относительная концентрация. Отношение концентраций инсулина и глюкагона в крови называют инсулин-глюкагоновым индексом, в зависимости от которого изменяется направление метаболизма гликогена в печени.
Первичным сигналом для синтеза инсулина и глюкагона является изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при переходе из абсорбтивного периода в постабсорбтивный изменяется их относительная концентрация. Отношение концентраций инсулина и глюкагона в крови называют инсулин-глюкагоновым индексом, в зависимости от которого изменяется направление метаболизма гликогена в печени.
42.Реакции распада гликогена. Роль адреналина в регуляции этого процесса
См выше
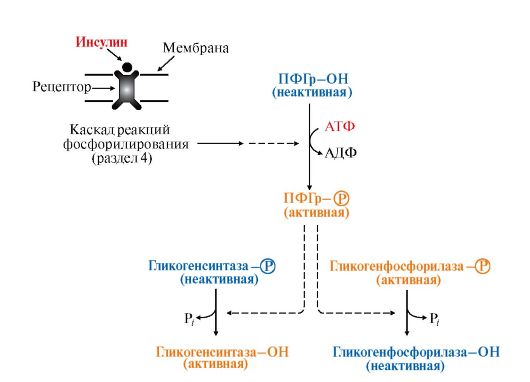 Рис. 6.7. Влияние инсулина на активность гликогенсинтазы и гликогенфосфорилазы:
Рис. 6.7. Влияние инсулина на активность гликогенсинтазы и гликогенфосфорилазы: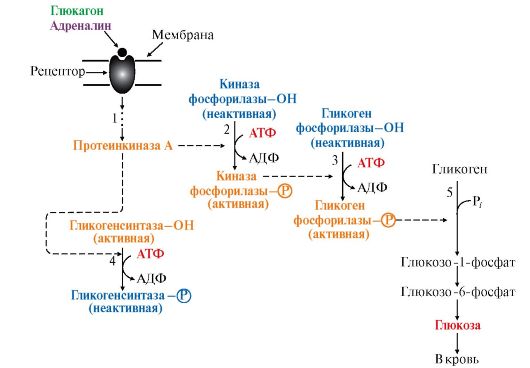 Рис. 6.8. Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином:
Рис. 6.8. Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином: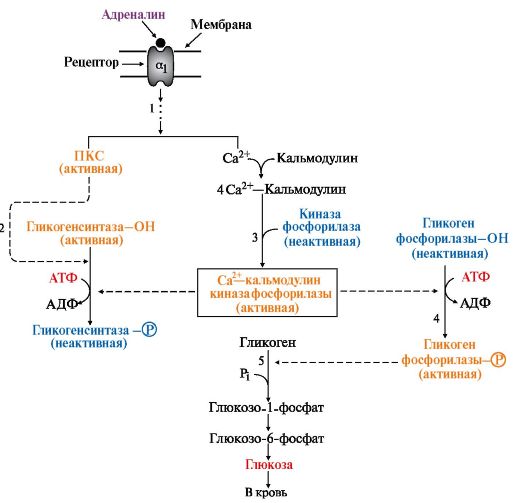 Рис. 6.9. Инозитолфосфатный механизм регуляции синтеза и распада гликогена в печени адреналином и Са2+:
Рис. 6.9. Инозитолфосфатный механизм регуляции синтеза и распада гликогена в печени адреналином и Са2+: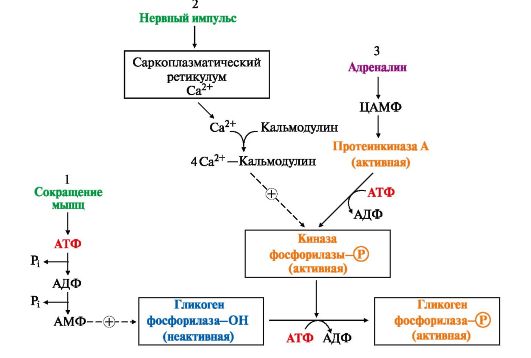 Рис. 6.10. Способы активации гликогенфосфорилазы мышц:
Рис. 6.10. Способы активации гликогенфосфорилазы мышц:


