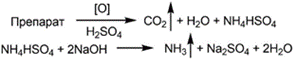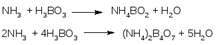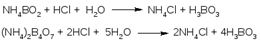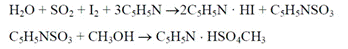Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Количественное определение азота в органических соединениях методом Къельдаля.Стр 1 из 8Следующая ⇒
Вопросы к экзамену «Методы фармакопейного анализа» Количественное определение азота в органических соединениях методом Къельдаля. Преимущества, ограничения и разновидности метода. Ход определения, химизм, Уравнения для расчета. Метод Къельдаля основан на минерализации лекарственного средства под воздействием серной кислоты концентрированной при нагревании в присутствии катализаторов (калия сульфата, меди сульфата и/или селена и/или титана диоксида)
Аммиак с паром в приемник, содержащий кислоту для его поглощения: борную – в методе прямого титрования (1 и 2); серную или хлористоводородную – в методе обратного титрования (3). В методах 1 и 2 поглощенный аммиак титруют раствором хлористоводородной или серной кислоты, в методе 3 избыток кислоты оттитровывают раствором натрия гидроксида. По результатам титрования рассчитывают содержание азота. Преимущества: - универсальность - высокая точность - хорошая воспроизводимость (основной метод для оценки содержания белка в пищевых продуктах) Ограничения: - не применяется к соединениям, содержащим азот в нитро и азогруппах и азот, присутствующий в кольцах (например, пиридин, хинолин, изохинолин), так как азот этих соединений не превращается в сульфат аммония в условиях этого метода - низкая скорость анализа - необходимость использования агрессивных реагентов (концентрированная серная кислота и раствор щелочи). Разновидности метода: 1) Классический метод Къельдаля, 2) микрометод Къельдаля, 3) метод Къельдаля (обратное титрование).
1. Классический метод Къельдаля. Аммиак улавливается раствором борной кислоты. ЛС + конц. H2SO4 + катализаторы → (NH4)2SO4 + CO2 + H2O (NH4)2SO4 + 2NaOH → NH3 + Na2SO4 + 2H2O
Отгон титруют раствором 0,1М хлороводородной или 0,05М серной кислоты (индикатор смешанный: метиловый красный и метиленовый синий 2:1).
До перехода окраски смешанного индикатора из зеленой в красно-фиолетовую. Параллельно проводят контрольный опыт. Микрометод Къельдаля. Отличия от метода 1 – масса навески в 10 раз меньше Концентрация титрантов тоже в 10 раз меньше Определение воды по К. Фишеру, значение метода для фармацевтического анализа. Преимущества, ограничения и разновидности метода. Состав реактива, химизм
Взаимодействия с водой. Немногие органические реакции способны протекать в водной среде. Более того, вода способна оказывать разрушающее действие на многие органические соединения, приводить к побочным реакциям в химических процессах. Т.о. необходимо точное определение воды в используемых реагентах и/или растворителях. (по Фишеру определяется как гигроскопическая, так и кристаллизационная вода) Реактив К. Фишера представляет собой раствор серы диоксида, йода и пиридина в метаноле (должны быть безводными). Взаимодействие реактива с водой протекает в две стадии стехиометрически по уравнениям:
В качестве спирта обычно используется метанол, реже диэтиленгликоль. В качестве основания – пиридин, но чаще имидазол или первичные амины. Типы титрования по Фишеру Метод А Точную навеску испытуемого вещества, содержащую приблизительно от 30 до 50 мг воды, помещают в сосуд для титрования, в который предварительно внесено 5,0 мл метанола безводного. Титруют. КТТ по окраске титруемой жидкости (от желтой до красновато-коричневой) Параллельно проводят контрольный опыт (титруют 5,0 мл метанола безводного). Метод В Около 20 мл метанола безводного титруют реактивом К. Фишера, определяя конечную точку титрования амперометрически. Затем вносят точную навеску(по гф) испытуемого вещества. Титруют, определяя конечную точку титрования амперометрически. Метод С Около 10 мл метанола безводного титруют йодсернистым реактивом, определяя конечную точку титрования амперометрически. Затем быстро вносят точную навеску и точно отмеренный объем йодсернистого реактива, взятый с избытком приблизительно на 1 мл или объем, указанный в фармакопейной статье. Сосуд закрывают пробкой, выдерживают в защищенном от света месте в течение 1 мин или в течение времени, указанного в фармакопейной статье, периодически перемешивая содержимое сосуда. Избыток йодсернистого реактива титруют до первоначального значения силы тока, используя метанол безводный или растворитель, указанный в фармакопейной статье.
Преимущества ● Высокая точность и воспроизводимость ● Селективность по воде ● Малые количества необходимых образцов ● Малое время анализа ● Практически неограниченный диапазон измерения (1ppm миллионная доля до 100 %) ● Пригоден для анализа: ○ Твердых веществ ○ Жидкостей ○ Газов Ограничения 1. Реагент Фишера неустойчив к действию света и влаги. Его стандартизация должна проводиться перед каждым использованием. 2. Рабочий интервал pH для определения воды по Фишеру между 5 и 8, в противном случае высоко кислотные или основные соединения рекомендуется буферизовать. 3. Плохо растворимые в метаноле соединения (например, жиры, углеводороды) следует растворять в высших спиртах или хлороформе, возможны также добавки формамида (для полярных веществ). 4. Следует избегать титрования веществ, которые способны реагировать с компонентами реактива Фишера (например, альдегиды и кетоны, сильные кислоты и основания, окислители и восстановители, соединения, реагирующие с компонентами реактива Фишера с образованием воды).
3. Определение азота аминокислот методами формольного и йодометрического Сущность метода. За основу метода взяты окислительно-восстановительные, диазотирующие нитрозирующие свойства NaNО2 (в кислой среде). Поэтому им можно определить: - окислители Н2О2, КМnО4, активный хлор в хлорной извести, которые окисляют нитрит-ионы до нитрат-ионов согласно уравнению: -2 е + HNО2 + Н2 О ↔ NО З - + 3Н+ Е0 = 0,94 В; - восстановители Sn2+, Fe2+, которые восстанавливают NО2 - до NO: + е + HNО2 + Н+ ↔ NO↑ + Н 2 О Е0 = 1,20 В; - производные первичных и вторичных ароматических аминов. NaNО2 (в среде НСl) может вступать в реакцию диазотирования с первичными ароматическими аминами с образованием солей диазония: R - NH2 + NaNО2 + 2НСl ↔ [R-N ≡N]Сl - + NaCl + 2Н2О Вторичные амины взаимодействуют с нитритом натрия с образованием N-нитрозоаминов: RR1NH + NaNO2 + НСl ↔ RR 1 N-NO↓ + Н 2 О + NaCl Титрант и индикаторы. Титрантом являются 0,5 и 0,1 М растворы NaNO2. Внутренние индикаторы: тропеолин ОО, переход окраски от красной до желтой; метиленовый синий — от красно-фиолетовой до голубой; нейтральный красный — от красно-фиолетовой к синей. Внешний индикатор — йодкрахмальная бумага. Это фильтровальная бумага, пропитанная раствором KI и раствором крахмала и высушенная.
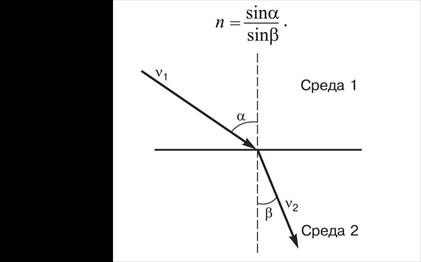
Условия титрования. Титрование проводят в среде соляной кислоты на холоду (не выше 20°С, лучше 0-10°С), чтобы предотвратить разложение соли диазония и потери HNO2, с медленной скоростью. В титруемый раствор вносят до 1 г KBr, который катализирует процесс диазотирования. Точку эквивалентности фиксируют с помощью внешних индикаторов (йодкрахмальная бумага синеет) и внутренних индикаторов (тропеолин 00 изменяет окраску с малиновой на бледно-желтую; смесь тропеолина 00 и метиленового синего изменяет окраску с малиновой на синюю). Возможно потенциометрическое титрование с платиновым индикаторным электродом. Раствор NaNO2 стандартизируют по сульфаниловой кислоте или стандартному раствору КМnО4. Сущность метода. Рефрактометрический метод – это метод, который основан на том, что при переходе светового луча из среды (1) в среду (2) вследствие различия их физических свойств происходит изменение скорости и направления распространения электромагнитных волн. Экспериментально измеряемой характеристикой этих изменений является показатель (коэффициент) преломления n.
Если луч света пересекает границу раздела двух прозрачных сред, то направление луча изменяется — происходит его преломление, или рефракция. Отношение синусов углов падения и преломления — величина постоянная:
где: v 1, v 2 – скорости распространения световой волны в средах 1 и 2 соответственно. α – угол падения луча, т.е.угол между направлением луча в среде (1) и нормалью к плоскости раздела сред. β − угол преломления, т.е. угол между направлением луча в среде (2) и нормалью к плоскости раздела сред. Коэффициент n, или показатель преломления, — безразмерная величина. Наиболее часто его определяют относительно воздуха. Показатель преломления зависит от факторов: - природы вещества; - плотности вещества; - концентрации вещества в растворе; - температуры и давления, при которых проводится измерение (так как они влияют на плотность вещества); - длины волны света. Показатель преломления измеряют рефрактометром. В фармацевтическом анализе определяют показатель преломления для D-линии спектра натрия (589,3 нм — среднее значение для дублета) при 20 С ИСПЫТАНИЕ НА СТЕРИЛЬНОСТЬ 2.1. Отбор образов для испытания Отбирают образцы препарата, как указано в Таблице в ОФС, учитывают общее количества единиц в серии.
2.2. Метод мембранной фильтрации: для определения стерильности ЛС - обладающих выраженным антимикробным действием - ЛС в емкостях вместимостью более 100 мл. ! Кроме препаратов с антимикробным действием, нерастворимых в водных разбавителях или ИПМ! Основных стадий: смачивание мембран, подготовка образцов и фильтрация содержимого всех емкостей через мембранные фильтры, отмывка мембранных фильтров соответствующим стерильным раствором, добавление питательной среды и инкубирование посевов.
Метод прямого посева - для ЛС, не обладающих антимикробным действием - тех препаратов, испытание которых невозможно выполнить методом мембранной фильтрации. В том случае, если препарат обладает антимикробным действием в условиях испытания, его нейтрализуют инактиваторами или увеличивая объем питательной среды.
Испытуемые образцы засевают непосредственно в питательные среды в соотношении 1:10 или 1:20.
Условия инкубации посевов Посевы инкубируют не менее 14 сут при температуре 32,5 ± 2,5 градусов в жидкой тиогликолевой среде и при температуре 22,5 ± 2,5 градусов в жидких соевоказеиновой среде или среде Сабуро (независимо от метода посева). При испытании ИЛП возможно использование только тиогликолевой среды и инкубирование посевов при двух температурных режимах 32,5 ± 2,5
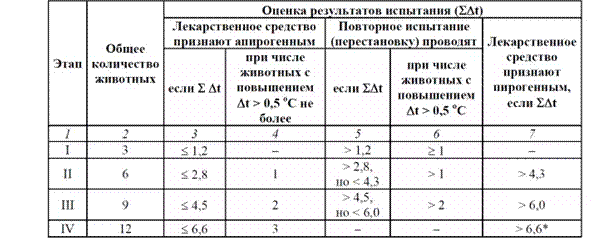
Область применения. Испытание на пирогенность инъекционных растворов и фармацевтических субстанций, из которых они изготавливаются. Методика выполнения. Биологический метод Испытуемое лекарственное средство вводят в ушную вену кролика, если в фармакопейной статье не указан другой путь введения. Объем инъецируемого раствора должен составлять не менее 0,2 мл и не более 10 мл на 1,0 кг массы тела животного. Испытание лекарственного средства проводят на группе из трех кроликов с исходной температурой 38,5-39,5 ºС. Измерения температуры после внутривенного введения испытуемого лекарственного средства проводят с интервалом не более 30 минут на протяжении трех часов. При других путях парентерального введения – на протяжении пяти часов. Учет результатов. На каждом этапе используют трех кроликов. Максимальное число этапов не должно превышать четырех. По окончании каждого из этапов испытания определяют максимальное изменение температуры (дельта t) тела каждого кролика по сравнению с исходным значением. Изменение температуры тела животного ниже исходной величины принимают за нулевое и не учитывают. Для трех кроликов определяют сумму индивидуальных максимальных повышений температур (S Dt). Значения S Dt, полученные на разных этапах испытания, последовательно суммируют, а результаты сравнивают с уровнями, указанными в таблице.
Оценка результатов. Взаимосвязь между логарифмом доз и диаметром зон угнетения роста должна быть представлена в виде прямой линии во всем диапазоне исследованных доз; прямая линия испытуемого должна быть параллельна соответствующей прямой линии стандартного образца.
Расчет антимикробной активности испытуемых образцов по стандартной кривой может быть проведен 2 способами: графическим методом или путем непосредственного расчета с использованием соответствующих формул. Количественное определение. Проводится различными методами: фотоколометрическим, спектрофотометрическим, флюориметрическим, газожидкостной хроматографии и биологической стандартизации. НТД на лекарственное растительное сырье, содержащее сердечные гликозиды, требует обязательной стандартизации сырья биологическими методами, которая проводится на лягушках, кошках, голубях. Активность оценивают по сравнению со стандартным кристаллическим препаратом и выражают в единицах действия (лягушачьих, кошачьих и голубиных). Чаще других используется стандартизация на лягушках.
За единицу (1 ЛЕД) принято наименьшее количество испытуемого вещества, способное вызвать систолическую остановку сердца у животных в течение 1 ч.(Для биологической стандартизации используют лягушек массой 25-40 г, предпочтительно самцов. Стандарты изготовляют и выпускают специализированные научно-исследовательские организации. В НТД на лекарственное растительное сырье, содержащее сердечные гликозиды, обязательно указывается валор.) Валор сырья - это количество единиц действия в 1 г сырья. (Например, при испытании на лягушках в 1 г листьев наперстянки пурпуровой должно содержаться не менее 50-66 ЛЕД, в траве ландыша майского - 120 ЛЕД, а в цветках ландыша - 200 ЛЕД. При испытании кардиотонических средств на кошках или голубях активность выражают в кошачьих и голубиных единицах действия: КЕД и ГЕД. Гликозиды действуют на сердце в 5-6 раз сильнее, чем их агликоны.) Испытания проводят на лягушках разных видов. - Устанавливают наименьшие дозы стандартного образца и испытуемого лекарственного средства (испытуемого лекарственного растительного сырья/препарата), вызывающие систолическую остановку сердца подопытных животных. - Затем рассчитывают содержание единиц действия в 1 г испытуемого лекарственного средства (ИЛС), если испытывается лекарственное растительное сырье или сухие концентраты; в одной таблетке — при испытании таблеток или в 1 мл, если испытываются жидкие лекарственные формы. (Биологическую активность стандартных образцов устанавливают на лягушках-самцах (Rana temporaria) массой 28 — 33 г при подкожном введении в октябре-ноябре (таких лягушек условно называют «стандартными» или «нормальными»).) При испытании на лягушках разведения стандартных образцов подбирают с таким расчетом, чтобы одна лягушачья единица действия (1 ЛЕД) соответствовала дозе стандартного образца, вызывающей в определенных условиях опыта систолическую остановку сердца у большинства стандартных подопытных лягушек.
методы: 1 Метод испытания при введении под кожу. Растворы вводят шприцем с тонкой иглой в бедренные лимфатические мешки лягушек. Дозы, не превышающие 0,35 мл, вводят в одну конечность, большие дозы (но не более 0,7 мл) вводят равными частями в обе конечности. 2 Метод испытания при введении в полость желудочка сердца. Испытуемые растворы, предварительно освобожденные от избытка спирта (его концентрация не должна превышать 10 %) и летучих веществ, в соответствующем разведении вводят лягушкам непосредственно в полость желудочка сердца со скоростью 0,1 мл в 5 с, прокалывая его в момент диастолы тонкой иглой, соединенной со шприцем с делением 0,02 мл. Иглу вынимают из полости желудочка во время систолы, чтобы избежать кровотечения в месте укола. 3 Метод испытания при введении в вену. У лягушек проводят поперечный разрез кожи на уровне ключиц, затем по средней линии живота до симфиза, где надсекают кожу вправо и влево. Образовавшиеся лоскуты кожи отводят в стороны. На внутренней поверхности после отведения в сторону лоскутов кожи с каждой стороны видна большая кожная вена в виде петли, идущей по поверхности прямой мышцы живота от кожи спины книзу, а затем снова вверх, где она впадает в верхнюю полую вену. Затем выводят наружу сердце аналогично методу испытания при введении под кожу. Доску с группой препарированных лягушек поворачивают так, чтобы их головы были обращены к экспериментатору для удобства введения иглы в нисходящее колено петли вены лягушки.)
20. Основные отличия биологических методов испытаний от физических, химических и физико-химических тестов.
Химические испытания - в основе лежат хим реакции - это реакции подлинности, реакции на примеси. Физ-хим - это спектрометрия, флуориметрия, масс-спектрометрия, хроматография (на бумаге, тонкослояная, газовая, высокоэффективная жидкостная), рефрактометрия, поляриметрия. Физические испытания - измерения физ показателей - на осмолярность, ионометрия, растворимость, степень окраски жидкостей, прозрачность и степень мутности жидкостей, потеря в массе при высушивании, температура плавления, температура затвердевания, плотность, вязкость, электропроводность Биологические - тестирование на живых организмах - Пирогенность, Токсичность/аномальная токсичность/безвредность, Испытания на гистамин, Бактериальные эндотоксины (ЛАЛ-тест).
Определение биол активности Биологическими методами проводятся на живых организмах- голубях, кошках, лягушках. Биологические методы нацелены на определение эффективности (биол акт-ти - диффузия в агар для апределения акт. антибиотиков, на животных опр акт. сердечных гликозидов) и определения безопасности (специфические - опр эндотоксинов, аномальной токсичности, пирогенности и неспецифические - например, вакцина против коклюша не вызывает заболевания) Вопросы к экзамену «Методы фармакопейного анализа» Количественное определение азота в органических соединениях методом Къельдаля. Преимущества, ограничения и разновидности метода. Ход определения, химизм, Уравнения для расчета. Метод Къельдаля основан на минерализации лекарственного средства под воздействием серной кислоты концентрированной при нагревании в присутствии катализаторов (калия сульфата, меди сульфата и/или селена и/или титана диоксида)
Аммиак с паром в приемник, содержащий кислоту для его поглощения: борную – в методе прямого титрования (1 и 2); серную или хлористоводородную – в методе обратного титрования (3). В методах 1 и 2 поглощенный аммиак титруют раствором хлористоводородной или серной кислоты, в методе 3 избыток кислоты оттитровывают раствором натрия гидроксида. По результатам титрования рассчитывают содержание азота. Преимущества: - универсальность - высокая точность - хорошая воспроизводимость (основной метод для оценки содержания белка в пищевых продуктах) Ограничения: - не применяется к соединениям, содержащим азот в нитро и азогруппах и азот, присутствующий в кольцах (например, пиридин, хинолин, изохинолин), так как азот этих соединений не превращается в сульфат аммония в условиях этого метода - низкая скорость анализа - необходимость использования агрессивных реагентов (концентрированная серная кислота и раствор щелочи). Разновидности метода: 1) Классический метод Къельдаля, 2) микрометод Къельдаля, 3) метод Къельдаля (обратное титрование).
1. Классический метод Къельдаля. Аммиак улавливается раствором борной кислоты. ЛС + конц. H2SO4 + катализаторы → (NH4)2SO4 + CO2 + H2O (NH4)2SO4 + 2NaOH → NH3 + Na2SO4 + 2H2O
Отгон титруют раствором 0,1М хлороводородной или 0,05М серной кислоты (индикатор смешанный: метиловый красный и метиленовый синий 2:1).
До перехода окраски смешанного индикатора из зеленой в красно-фиолетовую. Параллельно проводят контрольный опыт. Микрометод Къельдаля. Отличия от метода 1 – масса навески в 10 раз меньше Концентрация титрантов тоже в 10 раз меньше
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 99; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.4.206 (0.099 с.) |