Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства электронных оболочек
Акцентируем еще раз внимание на самых основных физических принципах формирования электронных оболочек атомов. Во-первых, электроны, взаимодействуя друг с другом и с ядром атома, образуют электронные оболочки в виде резонансных структур. Каждая оболочка - резонанс объединяет в себе совокупность электронов и продольные волны в пространстве вокруг ядра. Резонансные максимумы этого поля играют формирующую роль, так как задают пространственное положение электронов, которые в результате повторяют пространственную периодичность поля и, таким образом, “демонстрируют” свои волновые свойства. Во-вторых, неподвижные электроны в “оболочках”, взаимодействуя с резонансным продольным полем, создают циркулирующий поток энергии, который обеспечивает “зависание” электронов над ядром и создает имитацию вращения электронов по орбитам. Коллективные свойства электронов в “оболочках” атомов фактически соответствуют наличию в оболочках явления сверхтекучести. Действительно, так как энергия тепловых колебаний оказывается очень малой в сравнении с энергией связи электронов в атомах, то нет ничего удивительного в том, что внутри каждой оболочки электроны обладают свойствами сверхтекучести. Процессы, происходящие в электронных оболочках атомов, фактически представляют собой явление сверхтекучести (сверхпроводимости) электронов. Реальное движение электронов при этом останавливается, а “включается” передача энергии (и соответствующей массы!) полевым “каналом” по цепочкам взаимодействующих электронов [8]. Как уже отмечалось, Р.Фейнман сделал очень интересное сравнение сверхпроводимости с течением заряженной жидкости. Как “положено” жидкости, она склонна растекаться по эквипотенциалям (а в составе атома – образовывать “оболочки”). Кроме того, такая “заряженная жидкость”, как известно, проявляет себя и как резонансная система. Например, когда она “течет” по замкнутому контуру, то общая волновая функция составляющих ее электронов содержит целое количество длин волн. Это, действительно, полностью аналогично свойствам замкнутых систем электронных оболочек атомов! “Куперовскими парами” в электронных оболочках атомов являются соседние электроны, имеющие противоположные направления спинов (для получения минимума совместной энергии). Соответственно электроны, принадлежащие одной “куперовской паре”, оказываются на расстоянии полуволны друг от друга - в соседних максимумах поля.
Таким образом, каждая электронная оболочка обладает целым набором уникальных групповых свойств электронов, которые не сводятся к свойствам отдельных электронов. Эти групповые свойства электронов (бозе-конденсат куперовских пар) реализуются через “объединение” электронов каждой оболочки посредством резонансного продольного поля. Перейдем теперь к анализу электронных оболочек конкретных атомов и проведем соответствующие количественные расчеты, которые послужат иллюстрацией и подтверждением изложенных выше соображений. Начнем с атома водорода. Он состоит из одного протона (ядра) и одного электрона. Электрон, находясь в электростатическом поле ядра, имеет энергию (частоту), которая зависит от того, на каком расстоянии R от ядра он находится. Однако резонанс продольных волн в пространстве вокруг ядра (формирующий электронную оболочку) возникает только при условии, если на длине окружности 2π R укладывается целое число длин волн де Бройля:
Это так называемое условие Бора для квантования орбит электронов в атоме. По сути, оно задает величину пространственного волнового коэффициента (и соответствующей частоты) резонансного продольного поля электронной оболочки. Поэтому получающиеся из условия (22) уровни энергии совпадают с результатами решения уравнения Шредингера для атома водорода, которое, по сути, также является волновым уравнением и описывает волновой процесс. Впрочем, планетарная теория атома Бора оказывается даже ближе к реальности, чем разработанная позже квантово-механическая теория атома. Во всяком случае, в модели Бора электроны “не размазываются” по пространству и не концентрируются в центре атома (где находится ядро), как это происходит с так называемыми s-электронами с нулевым орбитальным моментом. Самая близкая к ядру оболочка в теории Бора соответствует согласно (22) одному полному пространственному периоду (n =1). Это согласуется с изложенными выше соображениями о резонансном характере оболочек атомов.
При этом в атоме водорода электрон занимает один из двух максимумов поля, а второй максимум (на противоположной стороне от ядра) остается вакантным. Поэтому заметим, что первая оболочка оказывается полностью “укомплектованной” в атоме гелия, имеющем два электрона, которые как раз располагаются напротив друг друга с разных сторон от ядра. Забегая вперед, скажем, что если подходить корректно к описанию многоэлектронных атомов с использованием квантовой механики, то такая задача практически не выполнима. Дело в том, что добавление каждого последующего электрона (при разработке теории заполнения электронных оболочек) требует учета влияния “облаков” всех предыдущих электронов. Поэтому даже добавление второго s-электрона не может сводиться только к замене в волновой функции направления спина на противоположное, как это фактически принято в существующей теории. Присутствие второго электрона изменит распределение пространственного заряда, и оба эти электрона уже не будут соответствовать первоначальной “идеальной” функции. Кроме того, каждый последующий электрон будет влиять и на решения для предыдущих электронов. Причем это влияние оказывается существенным, так как “орбитали” внешних электронов (s-электроны) “проникают” вплоть до самого ядра, “не обращая внимания” на заполненные внутренние оболочки. Очевидно, что уже на простейшем примере атома водорода мы получили принципиальные несоответствия с “общепринятым” на сегодняшний день квантово-механическим описанием электронов в атоме. Действительно, квантово-механическая s-орбиталь фактически предполагает не азимутальное, а радиальное движение электрона через центр (ядро) атома водорода! При этом электронное “облако” получается сферически симметричным и самым плотным у ядра в центре атома. Почему же в ряде случаев довольно успешно “работает” так называемое одноэлектронное приближение? Оно сводится к тому, что задача решается для простейшего случая наличия только одного электрона. А затем, реально присутствующие в условиях задачи другие электроны “распределяются” по получившемуся набору возможных состояний первого рассмотренного электрона. Такая “хитрость” применима в случаях, когда каждый последующий электрон не “пересекается” с предыдущими электронами системы, а занимает строго свою “нишу”. При квантово-механическом описании электронов в атомах такое взаимное влияние, как мы видели, является весьма существенным, так как электронные “облака” взаимно перекрываются. Следовательно, успех применения одноэлектронного решения можно рассматривать как косвенное подтверждение идеи резонансной природы электронных оболочек атомов, когда каждый последующий электрон попадает в уже “приготовленный” для него “свободный” максимум общего резонанса электронной оболочки. Природа сама упростила для нас эту многоэлектронную задачу, так как электроны в атомах проявляют в меньшей степени индивидуальные свойства, а в большей степени – коллективные свойства. Итак, в случае водорода электрон располагается сбоку от ядра в одном из двух симметрично расположенных максимумов поля резонансной оболочки. Энергия резонанса поля, связанного с этой оболочкой, соответствует, как уже говорилось выше, кинетической энергии электрона на воображаемой орбите
Из (23) видно, что в этом простейшем случае величина энергии резонанса, имитирующей кинетическую энергию, получается непосредственно из равенства центробежной силы силе притяжения к ядру. Одновременно эта величина энергии оказывается равной половине абсолютной величины отрицательной потенциальной энергии электрона в поле ядра, что соответствует теореме о вириале. Поэтому энергия, которая требуется для удаления электрона из атома (энергия ионизации), равна разнице между энергией связи и кинетической энергией и по абсолютной величине оказывается равна кинетической энергии (23)
Из выражения (23) с учетом условия (22) получаем выражение для R и так называемого первого радиуса Бора (n=1) орбитали электрона в атоме водорода
Радиус Бора приближенно равен 0,529Ǻ и оказывается в 1/α раз больше, чем диаметр электрона (2). Потенциал ионизации φ i атома водорода (24) с учетом (25) равен
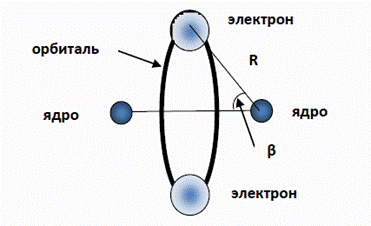
и численно совпадает с известным экспериментальным значением [10]. Радиус первой орбиты электрона (25) и потенциал ионизации (26) водорода являются естественным мерилом для аналогичных характеристик других атомов. Два атома водорода объединяются в молекулу. Мы коротко рассмотрим этот пример для иллюстрации несколько усложненной задачи. Интересно, что и в жидком состоянии водород сохраняет молекулы, то есть, атомы водорода оказываются объединенными в достаточно прочные пары. В чем состоит “секрет” относительной прочности молекулы водорода? Основываясь на резонансном принципе построения электронных оболочек и учитывая естественную симметрию молекулы водорода, наиболее вероятную конфигурацию молекулы можно представить себе следующим образом (рис. 5).
Рис. 5. Схематическое изображение молекулы водорода. Общая резонансная орбиталь, включающая в себя электроны двух атомов, располагается между двумя ядрами. Она компенсирует взаимное отталкивание ядер и скрепляет, таким образом, всю эту “конструкцию”. На орбитали укладывается одна длина волны, обеспечивая симметрично расположенные на противоположных сторонах орбитали “места” для двух электронов. Очевидно, что в отсутствии резонансного поля орбитали, которое фиксирует пространственное положение электронов в максимумах поля, такая конфигурация из четырех заряженных тел была бы неустойчивой.
Проведем ориентировочный расчет параметров молекулы водорода, основываясь на модели, изображенной на рис. 5. На каждый из электронов действует сила притяжения двух ядер и сила электростатического отталкивания между электронами. Поэтому результирующая центростремительная сила равна
Эта сила должна уравновешиваться центробежной силой, которая образуется в результате циркуляции энергии в резонансной оболочке, имитирующей вращение
Приравнивая друг другу (27) и (28), с учетом (25) получаем уравнение
Если предположить, что радиус резонансной орбитали, как и в атоме водорода равен радиусу Бора
то уравнение (29) сводится к условию:
Отсюда, с учетом (30), получаем: sinβ=0,855; cosβ=0,519; R=0,62Ǻ, а расстояние между ядрами атомов равно 2Rcosβ=0,643Ǻ, что для прикидочного расчета достаточно близко к фактической величине 0,74Ǻ. Кроме того, угол β=1,025 (или 58,76о) близок к 60о, то есть, к величине угла, при котором обеспечивается равновесие сил, действующих на ядра (рис.5):
Таким образом, ромбовидная конфигурация молекулы удовлетворяет одновременно двум условиям: равновесию сил, действующих на электроны оболочки (орбитали) с учетом циркуляции энергии в ней, а, с другой стороны, равновесию электростатических сил, действующих на ядра. Очевидно, что присоединение третьего электрона невозможно к оболочке, имеющей только два места (резонансных максимума), которые уже заняты электронами молекулы водорода. Это напоминает свойства полностью заполненных оболочек инертных (благородных) газов. Поэтому для того, чтобы водород вступил в какую-либо химическую реакцию необходимо сначала “разбить” его молекулу. Отметим также, что в рассмотренной модели молекулы водорода расчетный потенциал ионизации оказывается близким к потенциалу ионизации атома водорода 13,6 эВ. Это, в свою очередь, достаточно близко к фактической величине потенциала ионизации молекулы водорода 15,4 эВ. Мы не будем дальше уточнять эту модель, а сосредоточимся, как и раньше, в большей степени на принципиальной стороне вопроса, продолжив изучение свойств электронных оболочек атомов. Электронная оболочка атома гелия аналогична рассмотренным выше резонансным орбиталям атома водорода и молекулы водорода. В атоме гелия резонанс электронной оболочки также имеет один пространственный период (n =1) и соответственно два максимума поля. В этих максимумах симметрично с двух сторон от ядра располагаются электроны. Однако радиус электронной оболочки гелия почти в два раза меньше, чем у атома (и молекулы) водорода, так как электроны испытывают на себе большую притягивающую силу со стороны ядра гелия, заряд которого равен двум зарядам электрона. Проведем расчеты, исходя из баланса сил, действующих на электроны оболочки - электростатической (центростремительной) и центробежной
Учитывая условие резонанса
и приравнивая друг другу силы (33), получаем:
Анализируя атом водорода, мы убедились, что потенциал ионизации численно соответствует кинетической энергии электрона. Принимая это в расчет и учитывая (34) и (35), для атома гелия получаем
В действительности потенциал ионизации обычно включает в себя дополнительную “поправку”, которая вызвана перестройкой электронной оболочки, происходящей непосредственно в момент удаления электрона. Дело в том, что удаление электрона из оболочки (ионизация) затрагивает коллективный организм электронов оболочки атома, а, следовательно, акт ионизации не является простым “выбиванием” электрона. Электронная оболочка “берет на себя” энергию ионизующего воздействия и после этого “излучает” электрон, одновременно переходя в другое состояние (соответствующее меньшему количеству электронов в оболочке). Поэтому электрон получает “добавку” энергии от произошедшей перестройки оболочки. Если же взять удвоенную расчетную энергию (36), то она должна быть равна сумме двух потенциалов ионизации атома – при последовательном удалении сначала первого электрона, а затем второго электрона. Это исключает необходимость перераспределения “добавки” энергии и дает возможность прямого сравнения расчетной удвоенной величины с экспериментом. Таким образом, расчетная сумма двух потенциалов ионизации, исходя из (36) равна 83,3 эВ, а сумма экспериментальных значений равна 24,58+54,4≈79 эВ. Можно сказать, что полученная точность для такого элементарного расчета является более чем удовлетворительной! Самая близкая к ядру электронная оболочка у всех других атомов, также как и электронная оболочка гелия, состоит из двух электронов (n =1). Поэтому у нас есть возможность проанализировать, каким образом изменяется эта внутренняя оболочка при увеличении заряда ядра. Повторив расчеты, аналогичные расчетам электронной оболочки гелия, но положив заряд ядра равным z, получаем формулы для радиуса электронной оболочки и для суммарной величины потенциалов ионизации двух электронов оболочки:
Расчеты и экспериментальные данные [18] сведем в таблицу. Таблица 1 Параметры первой электронной оболочки (из двух электронов)
Из таблицы 1 следует (графа расчет/факт), что при увеличении заряда ядра относительное отличие между результатами расчетов потенциалов ионизации и соответствующими экспериментальными данными уменьшается (с более, чем 5% до почти 1%). То есть расчетные величины становятся ближе к фактическим. Обращает на себя внимание и то, что самая первая электронная оболочка приближается очень близко к ядру уже в конце первой десятки элементов периодической таблицы Д.И.Менделеева (0,054Ǻ у атома неона). Завершая рассмотрение самой близкой к ядру электронной оболочки, необходимо особо отметить удивительно точное совпадение расчетного и экспериментального значений потенциала ионизации для последнего электрона у атома любого химического элемента. Расчет аналогичен расчету потенциала ионизации атома водорода, но заряд ядра принимается равным z
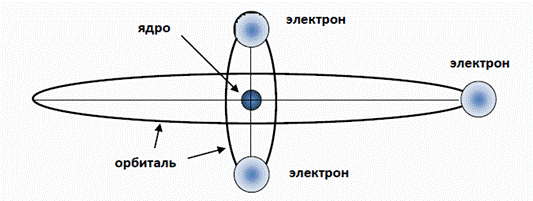
Например, экспериментальное значение потенциала ионизации последнего (десятого) электрона атома неона равно 1360,2 эВ. Следуя по порядку, нам предстоит теперь ответить на вопрос, каким образом располагаются электроны вокруг ядра атома лития? Параметры первой электронной оболочки атома лития, состоящей из двух электронов, нам уже известны (табл. 1). Но ядро лития имеет заряд, равный трем зарядам электрона и, таким образом, литий является первым химическим элементом с двумя электронными оболочками. При этом вторая (внешняя) оболочка представлена всего одним электроном (рис. 6).
Рис. 6. Схематическое изображение атома лития. Этот внешний электрон оказывается на довольно большом расстоянии от ядра и от двух электронов внутренней оболочки. Поэтому можно считать, что внешняя оболочка формируется центрально симметричным полем суммарного единичного положительного заряда центральной части (остова) атома. Как и раньше, запишем баланс сил, действующих на внешний электрон лития (это справедливо для любого одновалентного атома)
Отсюда следует, что в одновалентных атомах единственный электрон внешней оболочки должен находиться на расстоянии от ядра, определяемом по той же формуле, что и в атоме водорода:
Тем не менее, именно здесь возникают непредвиденные трудности! Действительно, если бы радиус внешней оболочки лития был как у атома водорода (n =1), то и его потенциал ионизации был бы равен потенциалу ионизации водорода (13,6 эВ). Но у лития потенциал ионизации составляет всего 5,39 эВ и указывает на то, что радиус внешней электронной оболочки атома лития существенно (в 2,523 раза) больше, чем у водорода. Значит, внешняя оболочка лития должна содержать больше, чем один пространственный период, то есть, число n должно быть больше единицы. Но, положив n =2, мы получим слишком большое расстояние R, равное четырем радиусам Бора. Потенциал ионизации при таком расстоянии должен быть равен 3,4 эВ, что не соответствует фактической величине 5,39 эВ. Эта ситуация представляется тупиковой! Тем не менее, она имеет логичное разрешение. В первой части статьи мы специально так подробно остановились на частотных взаимодействиях в микромире. Поэтому для нас нет ничего удивительного в том, что эти взаимодействия могут происходить на соизмеримых и кратных частотах. Аналогичные эффекты, как мы увидим, проявляются и при формировании электронных оболочек атомов. Чтобы убедиться в этом, проведем расчеты волновых характеристик электронов, исходя из величины эквивалента кинетической энергии, заключенной в поле электронной оболочки. Эта энергия, как мы видели, численно соответствует потенциалу ионизации. Для получения наибольшей точности расчетов нам наилучшим образом подходят атомы с единственным электроном на внешней оболочке, так как присутствие большего количества электронов не только усложняет расчеты, но и снижает их точность. В этом мы уже убедились на примере гелия. Начнем с более подробного расчета основных количественных характеристик электрона в атоме водорода. Изменение частоты электрона из-за нахождения его в составе атома, как следует из выражения (20), можно определить, исходя из удвоенной величины его кинетической энергии (эта энергия, как мы помним, принадлежит не конкретному электрону, а всей электронной оболочке):
Подставляя конкретные величины, получаем частоту и скорость (в качестве вспомогательных параметров для определения длины волны):
Отсюда
Аналогичным образом сделаем расчеты для электрона внешней оболочки атома лития (первый потенциал ионизации равен 5,39 эВ)
В этих расчетах нами введено новое обозначение Rλ для условного радиуса (обратная величина волнового коэффициента), являющегося показателем скорости пространственных волновых изменений. Фактически эта величина фигурирует уже в формуле (22). Как мы и ожидали, внешняя электронная оболочка лития характеризуется числом (n =1,593), которое в отличие от водорода (n =1), не является целым числом и находится в промежутке между числами 1 и 2! Однако в действительности внешняя электронная оболочка лития также является резонансной и характеризуется целым количеством длин волн. Достигается это за счет возбуждения более высокочастотной гармоники. То есть, некоторое неизвестное нам целое число длин волн N1, характеризующее резонанс оболочки, должно быть результатом умножения числа 1,593 на другое число N2 - номер гармонической составляющей. Поэтому здесь есть некоторый элемент неопределенности, и нам придется сделать несколько простых расчетов и подобрать подходящие цифры. Например, поделив число N1=8 на n=1,593, мы получаем N2=5,02, то есть, пятая гармоника позволяет получить восемь длин волн для резонанса электронной оболочки лития. При этом формула (40) для реального радиуса оболочки оказывается справедливой и при значении n, отличном от целого числа
Эта величина действительно соответствует реальному значению радиуса внешней электронной оболочки лития, полученному непосредственно, используя формулу (24) для потенциала ионизации
Так как атомов, подобных литию, с одним электроном на внешней электронной оболочке довольно много, то мы имеем возможность провести аналогичные расчеты и для них. Результаты всех расчетов сведены в таблицу 2. Мы уделяем этим расчетам так много внимания, чтобы убедиться в закономерном характере результатов. Приведенные в таблице 2 данные позволяют сделать вывод о справедливости сделанных предположений. Природа использует в электронных оболочках резонансы, возбуждаемые на гармонических составляющих, в результате чего атомы оказываются очень компактными и, в то же время, обладают способностью “разместить” в электронных оболочках большое количество электронов! Таблица 2
Здесь следует сразу оговориться, что цифры и расчеты в правом столбце таблицы получены подбором и должны быть подтверждены в ходе дальнейших исследований (например, путем изучения пространственной симметрии соединений, образуемых этими атомами). В частности, числа N1 и N2, очевидно, могут иметь значения, кратные указанным в таблице числам. Однако с принципиальной стороны не столь важно, будут ли эти числа кратными или соизмеримыми, так как в любом случае полученные результаты демонстрируют нам чрезвычайно важную закономерность строения атомов. Естественно, предстоит очень большая работа по подробному описанию свойств и определению параметров всех электронных оболочек атомов. Эти чрезвычайно интересные и важные вопросы, несомненно, привлекут к себе внимание исследователей и станут предметом жарких дискуссий. Но мы теперь попробуем взглянуть на свойства электронных оболочек атомов с еще одной не менее интересной стороны. Из проведенного анализа следует, что устройство атомов основано на послойном расположении электронов вокруг ядра. Каждый из этих слоев, который мы именуем резонансной электронной оболочкой, является совокупностью электронов, связанных единым полем. Таким образом, многоэлектронную оболочку можно представить себе в виде сферы с симметрично расположенными на ней электронами (например, в вершинах многогранника, мысленно вписанного в эту сферическую поверхность). Такая конфигурация электронной оболочки дает возможность при анализе ее свойств использовать наиболее простую модель в виде заряженной сферы. При этом структура атома напоминает “матрешку”, в центре которой расположено ядро, а концентрические электронные оболочки располагаются вокруг него - одна внутри другой. Каким образом отражается на свойствах атомов такая особенность строения? Рассмотрим в качестве примера атомы инертных газов, внешние электронные оболочки которых достаточно плотно “заселены” и должны действительно походить на заряженные сферы. Как известно, электростатическая энергия заряженной сферы равна [9]
Применительно к электронной оболочке заряд Q определяется количеством электронов в оболочке. Вспомним также, что потенциал ионизации соответствует половине абсолютной величины энергии связи электрона в составе оболочки. Исходя из этого и с учетом (44), сумма потенциалов ионизации всех электронов внешней оболочки, например, атома неона выражается формулой:
Дело в том, что удаление каждого электрона оболочки (акт ионизации) сопровождается “проникновением” соответствующей части некомпенсированного поля остова атома за пределы внешней оболочки, что воспринимается как увеличение ее заряда. Поэтому удаление каждого последующего электрона оболочки требует все больших затрат энергии, а суммарный результат будет как раз соответствовать формуле (45). Используя формулу (44), можно определить и каждый потенциал ионизации в отдельности (как изменение энергии при удалении одного электрона). Выражение (45) можно представить в виде суммы таких изменений энергии
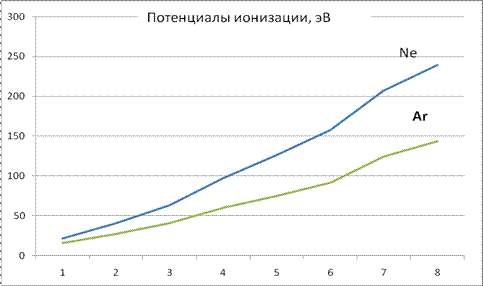
Как мы и ожидали, потенциалы ионизации изменяются пропорционально кратности ионизации (слагаемые в скобках (46) записаны в обратном порядке по кратности ионизации). Электронные оболочки, конечно, не являются равномерно заряженными сферами (особенно при малом числе электронов), тем не менее, результаты экспериментов в целом подтверждают применимость модели (рис. 7). Отклонения от линейной зависимости, очевидно, связаны также с уже упоминавшимися ранее процессами перестройки электронных оболочек после каждого акта ионизации. В результате, общая энергия электронной оболочки дополнительно перераспределяется между потенциалами ионизации. Однако суммарная величина (45) “поглощает” все перераспределения и, также как в уже рассмотренном случае первой оболочки из двух электронов, дает возможность наиболее наглядно сравнить расчеты с данными опытов.
Рис. 7. Потенциалы ионизации неона и аргона
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-19; просмотров: 174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.103.234 (0.108 с.) |
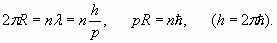 (22)
(22)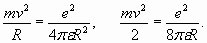 (23)
(23) (24)
(24) (25)
(25)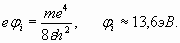 (26)
(26)
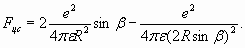 (27)
(27) (28)
(28) (29)
(29) (30)
(30)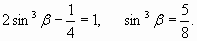 (31)
(31)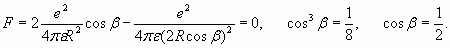 (32)
(32)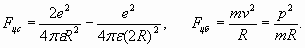 (33)
(33)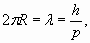 (34)
(34)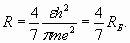 (35)
(35)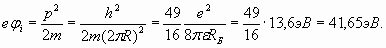 (36)
(36)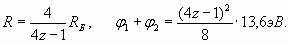 (37)
(37)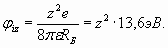 (38)
(38)
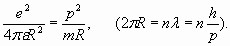 (39)
(39)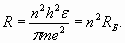 (40)
(40)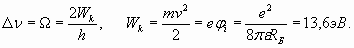 (41)
(41)
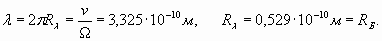
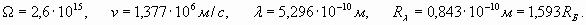
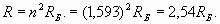 (42)
(42)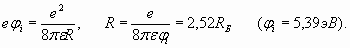 (43)
(43)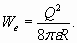 (44)
(44) (45)
(45) (46)
(46)