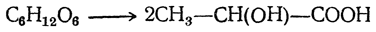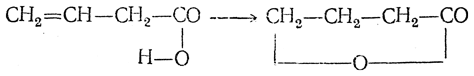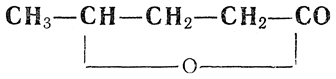Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Альфа-Оксикислоты. Гликолевая кислота
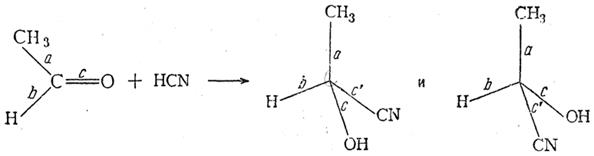
Гликолевая кислота СН2ОН—СООН была так названа потому, что она была впервые получена окислением этиленгликоля. Обыкновенно ее получают кипячением водного раствора калиевой соли хлоруксусной кислоты или самой хлоруксусной кислоты в присутствии порошка мрамора. Гликолевая кислота может быть получена также электролитическим восстановлением щавелевой кислоты. Она содержится в недозрелом винограде, в свекловичном соке и пр. Чистая гликолевая кислота — кристаллы с т. пл. 79—80° С, весьма легко растворимые в воде. При перегонке ее в вакууме отщепляется вода и отгоняется гликолид. Молочная кислота Молочная кислота СН3—СН(ОН)—СООН (α-оксипропионовая, этилиденмолочная) содержит асимметрический атом углерода и поэтому может существовать, в оптически изомерных формах. Молочная кислота может быть получена различными синтетическими способами, но при всех этих синтезах кислота получается в виде оптически недеятельной, т. е. всегда получаются равные количества правого и левого изомеров. То же наблюдается и во всех других случаях, когда путем синтетических реакций получаются вещества, содержащие асимметрический атом углерода. Причина обязательного образования оптически недеятельных соединений при синтетических реакциях может быть показана на следующих примерах:
Как видно из приведенной схемы, при действии цианистоводородной кислоты на уксусный альдегид анион CN– может атаковать π-связь карбонильной группы равновероятно как с одной, так и с другой стороны плоскости, в которой расположены σ-связи а, b и с молекулы кетона. В результате должны образоваться равные количества оптически изомерных молекул оксинитрилов. Точно так же в тех случаях, когда асимметрический атом углерода появляется в результате реакций замещения
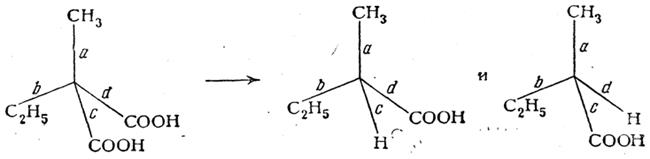
или реакций расщепления
вероятности образования молекул оптических антиподов совершенно одинаковы, что и должно вести к образованию оптически недеятельных смесей или рацемических соединений. Значительные количества молочной кислоты образуются при действии щелочей на водные растворы простейших сахаристых веществ (моноз). Так, например, из смеси глюкозы и фруктозы («инвертный» сахар) можно получить до 60% молочной кислоты. И в этом случае образуется недеятельная молочная кислота.
Наиболее важным источником получения молочной кислоты является процесс молочнокислого брожения, которому легко подвергаются растворы многих сахаристых веществ (молочного сахара, тростникового сахара, виноградного сахара и др.). Брожение является результатом жизнедеятельности бактерий молочнокислого брожения, зародыши которых всегда находятся в воздухе. Протеканием этого процесса и объясняется наличие молочной кислоты в кислом молоке, откуда она была впервые выделена Шееле (1780). Молочнокислое брожение сахарных растворов лучше всего протекает под действием чистых культур молочнокислых бактерий (Bacillus Delbrückii)при температуре 34—45° С, с добавкой необходимых для жизни бактерий минеральных веществ, а также мела или карбоната цинка. Последние добавки вводятся для нейтрализации свободной кислоты, так как при сколько-нибудь значительной концентрации кислоты бактерии погибают и брожение прекращается. Молочнокислое брожение является одним из процессов, протекающих при изготовлении масла (из скисшего молока), при созревании сыра, квашении капусты, при силосовании кормов и пр. Уравнение процесса молочнокислого брожения имеет вид:
Для молочнокислого брожения, как и для спиртового, доказано существование особого энзима, зимазы молочнокислого брожения, могущего вызывать брожение и без живых бактерий (Бухнер и Мейзенгеймер). Обычно молочнокислое брожение приводит к образованию оптически недеятельной молочной кислоты, однако часто при этом получается кислота, обладающая слабым правым или левым вращением. Чистая левовращающая молочная (D -молочная) кислота может быть получена брожением сахаристых веществ при посредстве особого возбудителя брожения (Bacillus acidi laevolactici).Правовращающий изомер молочной кислоты (L -молочная) был открыт Либихом (1847) в мясном экстракте и получил название мясомолочной кислоты. Правовращающая молочная кислота всегда содержится в мышцах животных. Обыкновенная (недеятельная) молочная кислота, часто называемая «молочной кислотой брожения», долгое время была известна лишь в виде густой жидкости. Осторожным выпариванием в высоком вакууме (0,1—0,5 мм рт. ст.) можно получить ее в безводном состоянии в виде кристаллической массы, плавящейся при 18° С. Из солей i -молочной кислоты характерной является хорошо кристаллизующаяся цинковая соль, содержащая три молекулы воды (С3Н5О3)2Zn ∙ 3Н2О.
Различие свойств недеятельной молочной кислоты и оптически деятельных кислот и их солей показывает, что недеятельное вещество представляет собой не смесь, а рацемическое соединение обеих (D - и L -) кислот или их солей (лактатов). Правовращающая (L -молочная) и левовращающая (D -молочная) кислоты представляют собой расплывающиеся на воздухе призмы с т. пл. 25—26° С. Они обладают равным, но противоположным оптическим вращением (в 10%-ном растворе [α] D 15°C=±3,82° и в 2,5%-ном [ α ] D 15°C=±2,67°). При продолжительном нагревании до 130—150°С оптически деятельные изомеры рацемизуются и дают ангидриды недеятельной молочной кислоты. Цинковые соли оптически деятельных изомеров молочной кислоты кристаллизуются только с двумя молекулами воды (C3H5O3)2Zn ∙ 2H2O и обе обладают совершенно одинаковой растворимостью в воде (1: 175 при 15° С), отличной от растворимости недеятельной соли (1: 50 при 10° С). Оптически недеятельная молочная кислота может быть разделена на оптически деятельные изомеры с помощью плесневых грибков, а также кристаллизацией молочнокислых солей оптически деятельных алкалоидов: стрихнина, хинина или морфина. Реакции молочной кислоты типичны для α-оксикислот. Особенно легко (даже при высушивании в вакууме) идет выделение воды с превращением в лактид, являющийся гомологом гликолида. Молочная кислота брожения находит значительное применение в технике, например в протравном крашении, в кожевенном производстве, в бродильных производствах (для предохранения от попадающих из воздуха посторонних бактерий), а также в медицине (80%-ный сироп; относительная плотность 1,21 — 1,22). Бета-Оксикислоты Гидракриловая кислота СН2ОН—СН2—COOН (β-оксипропионовая, этиленмолочная) может быть получена присоединением воды к акриловой кислоте, а также обменом иода на гидроксил в β-иодпропионовой кислоте. Она представляет собой густой сироп; при нагревании не дает ангидридов, а превращается с выделением воды в акриловую кислоту. β-Оксимасляная кислота СН3—СН(ОН) — СН2—СООН легко получается окислением альдоля СН3—СН(ОН)—СН2—СНО. Отщепляя воду, она переходит в кротоновую кислоту. Гамма-Oксикислоты и лактоны γ-Оксикислоты уже при выделении их действием минеральных кислот из водных растворов солей теряют воду и переходят в лактоны, вследствие чего они большей частью неизвестны в свободном состоянии, а известны лишь в виде солей, сложных эфиров, амидов и других производных. Лактоны обыкновенно получают название по одноименным жирным кислотам, производными которых они являются:
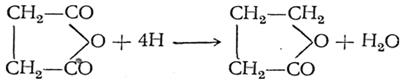
По женевской номенклатуре, им придается окончание олид, например бутиролактон называется бутанолидом и т. д. Класс лактонов был открыт А. М. Зайцевым (1873), получившим простейший из лактонов — γ-бутиролактон восстановлением хлорангидрида янтарной кислоты. Бутиролактон может быть получен также восстановлением ангидрида этой кислоты:
Лактоны получаются также при кипячении с разбавленной серной кислотой ненасыщенных кислот, содержащих этиленовую связь в β,γ- или в γ,δ-положениях. При этом происходит присоединение карбоксильного гидроксила по месту этиленовой связи, например:
При неполном окислении 1,4-гликолей также могут получаться лактоны, например бутиролактон из бутандиола-1,4. По-видимому, возникающая при окислении γ-оксимасляная кислота в момент образования теряет воду и дает лактон:
Лактоны не реагируют на холоду с растворами карбонатов щелочных металлов, при кипячении же, а также при действии едких щелочей превращаются в соли γ-оксикислот. Присоединением галоидоводорода к лактону получается γ-галоидзамещенная кислота, например СН2Сl—СН2—СН2—СООН; с водным аммиаком на холоду лактон дает амид γ-оксикислоты, например СН3—СН(ОН)—СН2—СН2—CONH2. Бутиролактон
(бутанолид) — жидкость, кипящая при 204° С; относительная плотность 1,129 (при 16° С). Валеролактон
(пентанолид) — один из наиболее доступных лактонов; может быть получен восстановлением левулиновой кислоты СН3—СО—(СН2)2—СООН. Валеролактон — жидкость, кипящая при 207° С, замерзающая при —315 С, относительная плотность 1,072 (при 0°С).
|
|||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 131; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.1.136 (0.009 с.) |