
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретическое введение к работе 2. 2
Адиабатическими называются процессы, происходящие без теплообмена с окружающей средой. Адиабатический процесс описывается уравнением Пуассона:
где Р – давление; V – объем; γ – показатель адиабаты, который в настоящей работе требуется определить.
где С p – молярная теплоемкость при постоянном давлении; С v – молярная теплоемкость при постоянном объеме. Молярной теплоемкостью называется величина, равная количеству теплоты, которую надо сообщить 1 молю вещества, чтобы повысить его температуру на 1К. Величина теплоемкости зависит от способа, которым системе сообщается тепло. Можно показать, что
где i – число степеней свободы (число независимых координат, определяющих положение молекулы в пространстве), R – универсальная газовая постоянная, R = 8,31 Дж/(К·моль). Число степеней свободы i зависит от строения молекулы газа. Если газ: – одноатомный: i = 3 (три степени свободы поступательного движения); – двухатомный: i = 5 (три степени свободы поступательного движения, две степени свободы вращательного движения); – трехатомный и более: i = 6 (три степени свободы поступательного движения и три степени свободы вращательного движения). Первое начало термодинамики является выражением закона сохранения и изменения энергии применительно к термодинамике. Формулируется он так: количество теплоты Q, сообщаемое телу, идет на увеличение его внутренней энергии ∆ U и на совершение телом работы А против внешних сил: Q = ∆ U + А (2.8)
В случае адиабатического процесса Q =0 и первое начало термодинамики принимает вид: А = – ∆ U (2.9)
Знак минус показывает, что при адиабатическом расширении система совершает работу за счет своей внутренней энергии.
Работа 2.2 Определение показателя адиабаты воздуха Цель работы: использование метода Клемана–Дезорма для экспериментального определения отношения молярных теплоемкостей воздуха при постоянном давлении и постоянном объеме.
Описание установки Для определения показателя адиабаты воздуха используется установка, представленная на рисунке 2.2. Она состоит из двух блоков. В нижнем блоке находится рабочий металлический сосуд, емкостью 3,5 л, совмещенный с компрессором. Компрессор предназначен для создания добавочного давления в рабочем сосуде, он включается переключателем «Компрессор» (2), установленным на передней панели установки. Кран К1 (3) предотвращает сброс давления из рабочего сосуда после остановки компрессора. Пневмотумблер «Атмосфера» (4) позволяет на короткое время соединять рабочий сосуд с атмосферой. Давление в колбе измеряется дифференциальным датчиком давления (5). В установке также предусмотрен контроль температуры (измеритель температуры 6) как внутри колбы, так и снаружи. Подключение установки осуществляется выключателем 1.
Рисунок 2.2 – Общий вид экспериментальной установки
При накачивании в рабочий сосуд некоторого количества воздуха с помощью компрессора давление и температура воздуха внутри сосуда повысятся. Вследствие теплообмена воздуха с окружающей средой через некоторое время температура воздуха, находящегося в баллоне, сравняется с температурой внешней среды t1. При этом давление, установившееся в сосуде, равно p 1 =р0+ Δ р1,
где р0 – атмосферное давление; Δ р1 – добавочное давление. Состояние воздуха внутри баллона (состояние 1) характеризуется термодинамическими параметрами: p 1, V 1 и t 1. Если открыть на короткое время пневмотумблер «Атмосфера», то воздух в баллоне будет расширяться. Этот процесс расширения можно считать адиабатическим, т.е. протекающим без теплообмена с окружающей средой. При этом давление газа уменьшается и достигает атмосферного, температура также понижается (расширяясь, газ совершает работу против атмосферного давления за счет уменьшения внутренней энергии) и оказывается ниже комнатной. В конце адиабатического процесса (состояние 2) параметры воздуха будут p 0, V 2 и t 2. Применяя к состояниям 1 и 2 уравнение Пуассона для адиабатического процесса, получим:
Охладившийся при расширении воздух в сосуде через некоторое время вследствие теплообмена нагреется до температуры внешней среды t 1: давление возрастет до некоторой величины:
p 2 = р0+ Δ р2, где Δ р2 – новое добавочное давление. Поскольку объём воздуха не изменится и останется равным V 2, то состояние воздуха (состояние 3) характеризуется параметрами: p 2, V 2 и t 1 . Так как в 1 и 3 состояниях воздух имеет одну и ту же температуру, то p 1 V 1 = p 2 V 2:
(р0+ Δ р1)· V 1 =(р0+ Δ р2) · V 2, (2.12) откуда:
Возведя обе части уравнения (2.12) в степень γ:
пользуясь выражениями (2.11) и (2.14), получим:
Логарифмируя (2.15) и решая получившееся уравнение относительно γ, находим:
Так как давления р0, р0+р1 и р0+р2 в условиях опыта мало отличаются друг от друга, можно показать, что разности логарифмов приблизительно равны разностям самих давлений:
или
Методика определения показателя адиабаты воздуха 1. Включить установку в сеть. Тумблером «Сеть» включить прибор, кран (К1) выставить в положение «Открыт». 2. С помощью компрессора поднять давление в ёмкости до показаний 9,00 – 10,00 кПа (индикатор давления 5), выключить компрессор и быстро кран (К1) перевести в положение «Закрыт». 3. Дождаться стабилизации давления (давление будет падать) на индикаторе давления. Показание датчика давления записать в таблицу 2.3 (графа Р1). 4. Резко повернуть ручку «Атмосфера» (4) по часовой стрелке и дождаться стабилизации давления (давление будет расти) на индикаторе давления. Показания давления записать в таблицу 2.3 (графа Р2). Таблица 2.3 – Результаты измерений и вычислений
5. Кран (К1) перевести в положение «Открыт». Поворотом ручки «Атмосфера» по часовой стрелке сбросить давление. 6. Повторить эксперимент не менее 5 раз. 7. По рабочей формуле (2.18) вычислить показатель адиабаты для каждого опыта. Определить среднее значение показателя адиабаты, абсолютную и относительную погрешности. 8. Записать окончательный результат в виде:
γ = (γср± Δγ), при δγ = … % Контрольные вопросы 1. Сформулируйте и запишите первое начало термодинамики. 2. Что такое адиабатический процесс? 3. Запишите уравнение Пуассона. 4. Как практически может быть реализован адиабатический процесс? Приведите примеры адиабатического процесса. 5. Какие процессы называются изотермическими? Какие процессы называются изохорическими? Какие законы описывают эти процессы? 6. Сформулируйте определения удельной и молярной теплоемкостей. 7. Почему теплоемкость газа при постоянном давлении отличается от его теплоемкости при постоянном объеме? 8. Какие газовые процессы используются в данной работе? 9. Выведите рабочую формулу, выражающую γ.
10. Что называется числом степеней свободы и от чего оно зависит? 11. Как выражаются теплоемкости Ср и Cv через число степеней свободы молекул газа? 12. Как выражается γ через число степеней свободы?
|
|||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 150; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.186.201 (0.02 с.) |
 , (2.6)
, (2.6)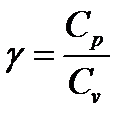 ,
, (2.7)
(2.7)
 , (2.10)
, (2.10)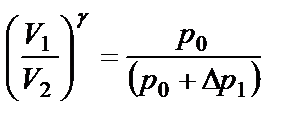 (2.11)
(2.11) (2.13)
(2.13)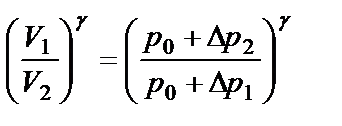 (2.14)
(2.14)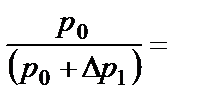
 (2.15)
(2.15)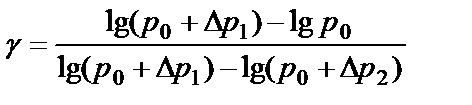 (2.16)
(2.16) , (2.17)
, (2.17)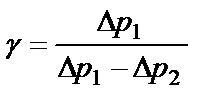 (2.18)
(2.18)


