
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Часть 1. Молекулярная физика. Термодинамика
Таблица вариантов (номер варианта определяется по последней цифре в шифре зачётной книжки) Таблица 3
Перед решением задач данной контрольной работы необходимо хорошо изучить соответствующие темы курса общей физики, указанные в следующей таблице. Таблица 4
201. В колбе объемом V = 100 см3 содержится некоторый газ при температуре Т = 300 К. Найдите уменьшение D p давления газа в колбе, если вследствие утечки из колбы выйдет число N = 1020 молекул. 202. Оболочка воздушного шара имеет объем V = 1600 м3. Принимая, что при подъеме воздушного шара водород может выходить через отверстие в нижней части шара, найдите подъемную силу F водорода, наполняющего оболочку, на высоте, где давление воздуха p = 60 кПа и его температура T = 280 К. 203. Средняя квадратичная скорость движения молекул некоторого газа ávквñ = 1 км/с. Определите среднюю арифметическую ávñ и наиболее вероятную vв скорости движения его молекул. 204. Азот находится при температуре Т = 1 кК. Определите среднюю кинетическую энергию áe1ñ, приходящуюся на одну степень свободы молекулы азота, среднюю кинетическую энергию áeпñ поступательного движения, среднюю кинетическую энергию áeврñ вращательного движения и среднюю полную кинетическую энергию áeñ молекулы азота.
205. Баллон объемом V = 30 л содержит смесь водорода и гелия при температуре Т = 300 К и давлении p = 830 кПа. Определите массу т 1 водорода и массу т 2 гелия, если масса смеси m = 24 г. 206. В баллоне объемом V = 25 л находится водород при температуре Т = 290 К. После того как часть водорода израсходовали, давление в баллоне уменьшилось на D p = 0,4 МПа. Считая процесс изотермическим, определите массу m израсходованного водорода. 207. В баллонах объемом V 1 = 20 л и V 2 = 44 л содержится некоторый газ. В первом баллоне давление газа p 1 = 2,4 МПа, во втором баллоне давление р 2 = 1,6 МПа. Определите парциальные давления 208. Средняя квадратичная скорость ávквñ движения молекул кислорода больше их наиболее вероятной скорости vв на Dv = 100 м/с. Определите температуру Т, при которой находится кислород. 209. В цилиндр длиной l o = 1,6 м, заполненный воздухом при нормальном атмосферном давлении, начали медленно вдвигать поршень площадью S = 200 см2. Определите силу F, которая будет действовать на поршень, если его остановить на расстоянии l = 10 см от дна цилиндра. 210. Давление некоторого газа p = 0,1 мПа, концентрация его молекул n = 1010 см-3. Определите температуру Т газа и среднюю кинетическую энергию áeпñ поступательного движения его молекул. 211. У поверхности Земли температура воздуха T = 290 К. Считая температуру воздуха и ускорение свободного падения постоянными и независящими от высоты, найдите высоту h над поверхностью Земли, на которой атмосферное давление в n = 2 раза меньше, чем на ее поверхности. 212. Одинаковые частицы массой т = 1 пг каждая распределены в однородном гравитационном поле напряженностью G = 0,2 мкН/кг. Температура воздуха Т = 290 К. Считая температуру воздуха во всех слоях одинаковой, определите отношение n 1/ n 2 концентраций частиц, находящихся на эквипотенциальных уровнях, отстоящих друг от друга на расстоянии D h = 10 м. 213. Ротор центрифуги, заполненный газообразным радоном, вращается равномерно с частотой n = 50 с-1 вокруг вертикальной оси, проходящей через его центр. Радиус ротора r = 50 см. Температура радона Т = 300 К. Считая температуру радона по всему объему ротора одинаковой, определите давление p газа на стенки ротора, если в его центре давление p o равно нормальному атмосферному.
214. У поверхности Земли температура воздуха T = 273 К. Считая температуру воздуха и ускорение свободного падения постоянными и независящими от высоты, найдите высоту h над поверхностью Земли, на которой плотность воздуха в e раз, где e - основание натуральных логарифмов, меньше его плотности на уровне моря. 215. Водород находится в равновесном состоянии при температуре T = 273 К. Определите относительное число D N / N молекул водорода, скорости движения которых заключены в интервале от v до v + Dv, где v = 2000 м/с и Dv = 100 м/с. 216. Пылинки массой m = 1 аг взвешены в воздухе, температура которого T = 300 К. Как и во сколько раз изменится концентрация пылинок при увеличении высоты на D h = 10 м? 217. Воздух у поверхности Земли находится при нормальных условиях. Считая температуру воздуха и ускорение свободного падения считать независящими от высоты, определите отношение p 1/ p 2 давления воздуха на дне скважины глубиной h 1 = 1 км к давлению воздуха на высоте h 2 = 1 км. 218. В центрифуге при температуре Т = 300 К находится газообразный ксенон. Ротор, радиус которого r = 50 см, вращается равномерно с частотой n = 30 с-1 вокруг вертикальной оси, проходящей через его центр. Определите отношение n / n o концентраций молекул ксенона у стенок ротора и в его центре. 219. Воздух у поверхности Земли находится при температуре T = 290 К и давлении p o = 100 кПа. Считая, что температура воздуха и ускорение свободного падения не изменяются с высотой, найдите уменьшение D p атмосферного давления при подъеме наблюдателя на высоту h = 100 м над поверхностью Земли. 220. Азот находится в равновесном состоянии при температуре T = 900 К. Определите относительное число D N / N молекул азота, скорости движения которых лежат в интервале от vв до vв + Dv, где Dv = 20 м/с. 221. Кислород находится при температуре Т = 250 К и давлении p = 100 Па. Найдите среднее время átñ свободного пробега его молекул. 222. Баллон объемом V = 10 л содержит водород массой т = 1 г. Определите среднюю длину á l ñ свободного пробега молекул водорода. 223. Азот находится при нормальных условиях. Вычислите коэффициент диффузии D азота. 224. Гелий находится при температуре T = 200 К под давлением p = 2 кПа. Найдите среднюю длину á l ñ свободного пробега его молекул и среднее число á z ñ столкновений, испытываемых одной молекулой гелия, за время t = 1 с. 225. Средняя длина свободного пробега его молекул разреженного водорода á l ñ = 1 см. Определите плотность r водорода. 226. Кислород находится при нормальных условиях. Вычислите коэффициент динамической вязкости h кислорода. 227. В сферической колбе объемом V = 3 л, содержащей азот при температуре Т = 250 К, создан вакуум с давлением p = 80 мкПа. Можно ли считать вакуум в колбе высоким? Примечание. Вакуум считается высоким, если средняя длина свободного пробега молекул газа много больше линейных размеров сосуда. 228. Водород находится при нормальных условиях. Определите общее число Z всех соударений, которые происходят в течение времени t = 1 с между всеми молекулами водорода в объеме V = 1 мм3. 229. Гелий находится при нормальных условиях. Вычислите коэффициент теплопроводности l гелия.
230. Водород находится при температуре Т = 100 К и давлении p = 0,1 Па. Определите среднюю длину á l ñ свободного пробега его молекул. 231. Газовая смесь состоит из азота массой т 1 = 3 кг и водяного пара массой т 2 = 1 кг. Определите удельные теплоемкости c v и cp соответственно при постоянном объеме и постоянном давлении этой газовой смеси. 232. Молярная масса некоторого газа М = 4×10-3 кг/моль. Отношение его теплоемкостей g = 1,67. Вычислите удельные теплоемкости c v и cp соответственно при постоянном объеме и постоянном давлении этого газа. 233. Смесь газов состоит из количества вещества n1 = 3 моль аргона и количества вещества n2 = 2 моль азота. Найдите показатель адиабаты g этой газовой смеси. 234. Сухой воздух состоит из кислорода с массовой долей w 1 = 0,232 и азота с массовой долей w 2 = 0,768. Определите удельные теплоемкости cV и cp соответственно при постоянном объеме и постоянном давлении этой газовой смеси. 235. На нагревание кислорода массой m = 165 г на D T = 12 К было затрачено количество теплоты Q = 1,80 кДж. Как протекал процесс: при постоянном объеме или при постоянном давлении? 236. Смесь газов содержит гелий массой m 1 = 8 г и водород массой m 2 = 2 г. Определите показатель адиабаты g этой газовой смеси. 237. Смесь газов состоит из количества вещества n1 = 2 моль кислорода и количества вещества n2 = 4 моль азота. Определите удельные теплоемкости cV и cp соответственно при постоянном объеме и постоянном давлении этой газовой смеси. 238. При нормальных условиях некоторый газ имеет удельный объем v = 0,7 м3/кг. Определите удельные теплоемкости c v и cp соответственно при постоянном объеме и постоянном давлении этого газа. Какой это газ? 239. Газовая смесь состоит из кислорода О2 с массовой долей w 1 = 85 % и озона О3 с массовой долей w 2 = 15 %. Определите показатель адиабаты g этой смеси газов. 240. При нормальных условиях плотность некоторого газа r = 1,25 кг/м3. Отношение его теплоемкостей g = 1,40. Определите удельные теплоемкости cV и cp соответственно при постоянном объеме и постоянном давлении этого газа. 241. Водород занимает объем V = 10 м3 при давлении p 1 = 100 кПа. Газ нагрели при постоянном объеме до давления p 2 = 300 кПа. Определите: 1) изменение D U внутренней энергии газа; 2) работу А, совершенную газом; 3) количество теплоты Q, сообщенной газу. 242. Кислород при неизменном давлении p = 80 кПа нагревается; при этом его объем увеличивается от V 1 = 1 м3 до V 2 = 3 м3. Определите: 1) изменение D U внутренней энергии кислорода; 2) работу А, совершенную им при расширении; 3) количество теплоты Q, сообщенной газу.
243. Кислород, занимавший объем V 1 = 1 л под давлением р 1 = 1,2 МПа, расширился адиабатно до объема V 2 = 10 л. Определите работу А расширения газа. 244. Азот массой m = 4 г расширился изобарно от объема V 1 = 5 л до объема V 2 = 9 л. Найдите изменение D S энтропии азота при этом процессе. 245. В цилиндре под поршнем находится азот массой m = 0,6 кг, занимающий объем V 1 = 1,2 м3 при температуре T = 560 К. В результате подвода теплоты газ расширился и занял объем V 2 = 4,2 м3, причем его температура осталась неизменной. Найдите: 1) изменение D U внутренней энергии газа; 2) работу А, совершенную им при расширении; 3) количество теплоты Q, сообщенной газу. 246. При нагревании давление азота объемом V = 3 л увеличилось на D p = 1 МПа. Определите количество теплоты Q, полученное газом, если объем газа остался неизменным. 247. Азот нагревался при постоянном давлении; при этом ему было сообщено количество теплоты Q = 21 кДж. Определите работу А, которую при этом совершил газ, и изменение D U его внутренней энергии. 248. При нормальных условиях водород занимал объем V 1 = 100 м3. Найдите изменение D U внутренней энергии газа при его адиабатном расширении до объема V 2 = 150 м3. 249. Водород массой m = 6 г расширился изотермически от давления р 1 = 100 кПа до давления p 2 = 50 кПа. Определите изменение D S энтропии водорода при этом процессе. 250. Азот массой m = 200 г расширяется изотермически при температуре T = 280 К; при этом его объем увеличивается в n = 2 раза. Найдите: 1) изменение D U внутренней энергии газа; 2) работу А, совершенную им при расширении; 3) количество теплоты Q, полученное газом. 251. Идеальный газ, совершающий цикл Карно, получив от нагревателя количество теплоты Q 1 = 4,2 кДж, совершил работу А = 590 Дж. Найдите термический КПД h этого цикла. Во сколько раз температура Т 1 нагревателя больше температуры Т 2 охладителя? 252. Идеальный газ совершает цикл Карно. Температура Т 1 нагревателя в n = 3 раза больше температуры Т 2 охладителя. Нагреватель передал газу количество теплоты Q 1 = 42 кДж. Какую работу А совершил газ? 253. Идеальный газ совершает цикл Карно. Температура Т 1 нагревателя в n = 4 раза больше температуры Т 2 охладителя. Какую долю w количества теплоты, получаемого за один цикл от нагревателя, газ отдает охладителю? 254. В результате кругового процесса газ совершил работу А = 1 Дж и передал охладителю количество теплоты Q 2 = 4,2 Дж. Определите термический КПД h цикла. 255. Совершая замкнутый процесс, газ получил от нагревателя количество теплоты Q 1 = 4 кДж. Определите работу А газа при протекании цикла, если его термический КПД h = 0,10. 256. Идеальный газ совершает цикл Карно. Температура нагревателя Т 1 = 470 К, температура охладителя Т 2 = 280 К. При изотермическом расширении газ совершил работу А = 100 Дж. Определите термический КПД h цикла, а также количество теплоты Q 2, которое газ отдает охладителю при изотермическом сжатии.
257. Идеальный газ, совершающий цикл Карно, отдал охладителю количество теплоты Q 2 = 14 кДж. Определите температуру T 1 нагревателя, если при температуре охладителя Т 2 = 280 К работа цикла А = 6 кДж. 258. Идеальный газ совершает цикл Карно. Температура охладителя Т 2 = 290 К. Как и во сколько раз увеличится КПД цикла, если температура нагревателя увеличится от T 1 = 400 К до 259. Идеальный газ совершает цикл Карно. Работа изотермического расширения А 1 = 5 кДж. Определите работу А 2 изотермического сжатия, если термический КПД цикла h = 0,2. 260. Идеальный газ, совершающий цикл Карно, отдает охладителю долю w = 2/3 количества теплоты Q 1, полученной от нагревателя. Определите температуру Т 1 нагревателя, если температура охладителя Т 2 = 280 К. 261. При выдувании мыльного пузыря его диаметр увеличился от d 1 = 1 см до d 2 = 11 см. Считая процесс изотермическим, найдите работу А, которая была при этом совершена. 262. В воду на очень малую глубину одним концом опущена стеклянная трубка с диаметром внутреннего канала d = 1 мм. Считая смачивание полным, найдите массу m воды, вошедшей в трубку. 263. В коленах U-образной трубки диаметры внутренних каналов равны соответственно d 1 = 2 мм и d 2 = 0,4 мм; при этом в коленах трубки разность уровней жидкости D h = 22,4 мм. Считая смачивание полным, определите коэффициент поверхностного натяжения s жидкости, если ее плотность r = 800 кг/м3. 264. Две (N = 2) капли ртути радиусом r = 1 мм каждая слились в одну большую каплю. Считая процесс изотермическим, определите энергию Е, которая выделилась при этом слиянии. 265. Две стеклянные пластинки с площадью поверхности S = 100 см2 каждая расположены параллельно друг другу. Расстояние между пластинками l = 20 мкм, а пространство между ними заполнено водой. Считая мениск вогнутым с диаметром D, равным расстоянию l между пластинками, определите силу F, прижимающую пластинки друг к другу. 266. В капиллярной трубке глицерин поднялся на высоту h = 20 мм. Считая смачивание полным, определите коэффициент поверхностного натяжения s глицерина, если диаметр внутреннего канала трубки d = 1 мм. 267. Стеклянная трубка имеет внутренний диаметр d = 0,2 см. На нижнем конце трубки вода повисла в виде капли, в момент отрыва имеющая вид шарика. Найдите диаметр D этой капли воды. 268. Диаметр мыльного пузыря d = 5 мм. На какую величину D p давление воздуха внутри пузыря больше нормального атмосферного давления? 269. Воздушный пузырек диаметром d = 2 мкм находится в воде у самой ее поверхности. Определите плотность r воздуха в пузырьке, если воздух над поверхностью воды находится при нормальных условиях. 270. Капиллярная трубка c внутренним диаметром d = 0,5 мм наполнена водой. На нижнем конце трубки вода повисла в виде капли, представляющей собой часть сферы радиуса R = 3 мм. Найдите высоту h столбика воды в трубке. 271. Считая известными значения критической температуры T кр и критического давления p кр ксенона, вычислите для этого газа постоянные а и b, входящие в уравнение Ван-дер-Ваальса. 272. Некоторый газ, содержащий количество вещества n = 250 моль, занимает объем V 1 = 1 м3. При расширении газа до объема V 2 = 1,2 м3 против сил межмолекулярного притяжения была совершена работа А = 1,42 кДж. Определите постоянную а для этого реального газа, входящую в уравнение Ван-дер-Ваальса. 273. Считая известными значения критической температуры Т кр и критического давления р кр хлора, определите внутреннее давление p ¢, обусловленное силами взаимодействия молекул этого газа при нормальных условиях. 274. Углекислый газ массой m = 2,2 кг находится в сосуде объемом V = 30 л при температуре T = 290 К. Считая известными для углекислого газа постоянные а и b, по уравнению Ван-дер-Ваальса определите давление p, под которым газ находится в сосуде. 275. Считая известными для гелия значения критической температуры Т кр и критического давления р кр, определите его плотность rкр в критическом состоянии. 276. Азот, находящийся под давлением p = 10 МПа, имеет плотность r = 140 кг/м3. Считая известными для азота постоянные а и b, по уравнению Ван-дер-Ваальса определите температуру Т этого газа. 277. Считая известными значения критической температуры Т кр и критического давления р кр аргона, определите критический молярный объем V m кр этого газа. 278. Считая известными значения критической температуры Т кр и критического давления р кр кислорода, вычислите эффективный диаметр d молекулы этого газа. 279. Углекислый газ массой m = 88 г при температуре T = 290 К занимает объем V = 1 л. Считать известной постоянную а для углекислого газа, определите внутреннюю энергию U этого газа. 280. Азот, содержащий количество вещества n = 3 моль, расширяется в вакуум, в результате чего объем газа увеличивается от V 1 = 1 л до V 2 = 5 л. Считая известной постоянную а для азота, определите количество теплоты Q, которую необходимо сообщить газу, если его температура в конце процесса осталась неизменной. Вопросы для самоконтроля РГР 1. Часть 1 1. Идеальный газ. Параметры состояния газа: давление, объем и температура. 2. Первое начало термодинамики. Внутренняя энергия, теплота и работа. 3. Распределение энергии по степеням свободы молекулы. Теплоемкость идеального газа. 4. Изопроцессы, адиабатический процесс, политропический процесс. Круговые процессы, цикл Карно. Обратимые и необратимые процессы. 5. Второе начало термодинамики. Энтропия. 6. Максвелловский закон распределения молекул газа по скоростям. 7. Распределение Больцмана. Барометрическая формула.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 148; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.53.209 (0.043 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
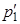 и
и  газа и общее давление p газа после соединения баллонов, если температура газа осталась прежней.
газа и общее давление p газа после соединения баллонов, если температура газа осталась прежней.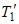 = 600 К?
= 600 К?


