
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные сведения об этиленеСтр 1 из 3Следующая ⇒
ОСНОВНЫЕ СВЕДЕНИЯ О МЕТАНЕ
Нахождение в природе Метан содержится в природном газе (от 60 до 98 %), попутном нефтяном газе (от 30 до 80 %). Метан называют болотным или рудничным газом, т.к. он образуется на болотах при гниении растительных остатков без доступа воздуха, а также при медленном разложении каменного угля под землёй. Содержится в атмосфере Сатурна и Юпитера. | ||||||||||||||
|
Получение 1) Образуется при крекинге нефти, сухой перегонке древесины, торфа и каменного угля. 2) С +2Н2 *3) CO + 3H2 **4) Al4C3 +12H2O → 3CH4↑ + 4Al(OH)3↓ гидролиз карбида алюминия **5) CH3COONa + NaOH | |||||||||||||||
|
Физические свойства Газ без цвета и запаха, очень плохо растворимый в воде. Легче воздуха. | |||||||||||||||
|
Химические свойства 1) CH4 + Cl2 2) CH4 + Br2 3) CH4 + HNO3 4) CH4 + 2O2 5) CH4 *5) 2CH4 | |||||||||||||||
|
Применение 1) Является сырьём для получения своих гомологов, ацетилена, метанола (метилового или древесного спирта), муравьиного альдегида (метаналя или формальдегида), сероуглерода (CS2), синильной кислоты (HCN), различных хлорпроизводных (например, хлороформа – СНCl3, тетрахлорметана – СCl4), а также фреонов (СF2Cl2) и сажи. 2) В быту и на производстве как газообразное топливо. | |||||||||||||||
ОСНОВНЫЕ СВЕДЕНИЯ Об эТАНЕ
| Общие сведения | ||
| Молекулярная формула С2Н6 | Графическая
формула

| Электронная
формула

|
Нахождение в природе
Этан содержится в природном газе (от 1 до 10 %), попутном нефтяном газе (от 4 до 25 %).
Получение
1) С2H4+ Н2  C2H6↑ гидрирование этилена
C2H6↑ гидрирование этилена
2) С2H2 +2Н2 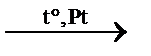 C2H6↑ гидрирование ацетилена
C2H6↑ гидрирование ацетилена
**3)2CO + 5H2  C2H6↑ + 2H2O синтез Ф.Фишера–Г.Тропша
C2H6↑ + 2H2O синтез Ф.Фишера–Г.Тропша
**4)2CН3I +2Na  C2H6↑ + 2NaI синтез Ш.А. Вюрца
C2H6↑ + 2NaI синтез Ш.А. Вюрца
**5) C2H5COONa + NaOH 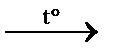 C2H6↑ + Na2CO3 реакция Ж.Б.А. Дюма
C2H6↑ + Na2CO3 реакция Ж.Б.А. Дюма
|
|
**6) 2CH3COONa + 2H2О  C2H6↑ + 2NaОН + 2CO2↑ + Н2↑
C2H6↑ + 2NaОН + 2CO2↑ + Н2↑
реакция А.В.Г. Кольбе
Физические свойства
Газ без цвета, запаха и вкуса, плохо растворимый в воде.
Тяжелее воздуха.
Химические свойства
1) C2H6 + Cl2 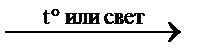 C2H5Cl + HCl↑ замещение (хлорирование)
C2H5Cl + HCl↑ замещение (хлорирование)
2) C2H6 + Br2 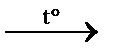 C2H5Br + HBr↑ замещение (бромирование)
C2H5Br + HBr↑ замещение (бромирование)
3) 2C2H6 + 7O2 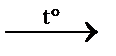 4CO2↑ + 6H2O горение
4CO2↑ + 6H2O горение
4) C2H6 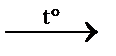 2C + 3H2↑ термическое разложение
2C + 3H2↑ термическое разложение
5) C2H6  C2H4 + H2↑ дегидрирование
C2H4 + H2↑ дегидрирование
Применение
Является сырьём для получения своих гомологов, этилена, этанола (этилового спирта), уксусного альдегида (этаналя или ацетальдегида), уксусной кислоты, различных галогенпроизводных (например, бромэтана – С2Н5Br), пластмасс, синтетических волокон, а также как газообразное топливо.
ОСНОВНЫЕ СВЕДЕНИЯ ОБ ЭТИЛЕНЕ
| Общие сведения | ||
| Молекулярная формула С2Н4 | Структурная формула

| Электронная формула
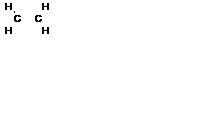
|
Нахождение в природе
В природе встречается редко, иногда как примесь в некоторых попутных нефтяных газах, а также, как фитогормон в растениях.
Получение
1) Образуется при крекинге и пиролизе нефти.
2) C2H6  C2H4 + H2↑ дегидрирование этана
C2H4 + H2↑ дегидрирование этана
3) С2H2 + Н2 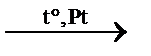 C2H4↑ гидрирование ацетилена
C2H4↑ гидрирование ацетилена
4) C2Н5ОН 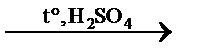 C2H4↑ + H2O дегидратация этанола
C2H4↑ + H2O дегидратация этанола
*5) С4Н10 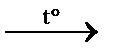 C2H4↑ + С2Н6↑ крекинг бутана
C2H4↑ + С2Н6↑ крекинг бутана
**6) C2H4Br2 + Mg(пыль) 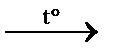 C2H4↑ + MgBr2 отщепление
C2H4↑ + MgBr2 отщепление
**7) C2H5Br + NaOH 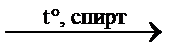 C2H4↑ + NaBr + Н2О отщепление
C2H4↑ + NaBr + Н2О отщепление
Физические свойства
Газ без цвета, со слабым запахом, плохо растворимый в воде (в 1 л Н2О при tº = 0 ºC около 0,25 л газа). Немного легче воздуха.
Химические свойства
1) C2H4 + Cl2 → C2H4Cl2 присоединение хлора
2) CH2=CH2 + Br2 → CH2Br–CH2Br обесцвечивание бромной воды, качественная реакция на двойную связь
3) C2H4 + HBr → CH3–CH2Br присоединение бромоводорода
4) С2H4 + Н2 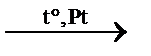 C2H6↑ гидрирование
C2H6↑ гидрирование
5) C2H4 + H2O 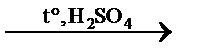 CH3–CH2–OH гидратация
CH3–CH2–OH гидратация
6) C2H4 + 3O2 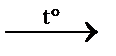 2CO2↑ + 2H2O горение
2CO2↑ + 2H2O горение
7) nC2H4 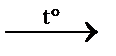 (–CH2– CH2–)n полимеризация
(–CH2– CH2–)n полимеризация
*8) 3CH2=CH2 + 2KMnO4 + 4H2O 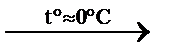 3CH2OH–CH2OH + 2MnO2↓+ +2KOH (этиленгликоль, этандиол-1,2)
3CH2OH–CH2OH + 2MnO2↓+ +2KOH (этиленгликоль, этандиол-1,2)
|
|
реакция Е.Е. Вагнера, качественная реакция на двойную связь
Применение
Является сырьё для получения этанола, уксусного альдегида (ацетальдегида), уксусной кислоты, дихлорэтана (СН2Cl–СН2Cl), этилбензола (C6H5C2H5), полиэтилена и других полимеров (например, поливинилхлорида), оксида этилена, этиленгликоля и других продуктов органического синтеза.
Нахождение в природе
В природе не встречается.
*Получение
1) СаС2 + 2Н2О → С2Н2↑ + Са(ОН)2 карбидный метод
2) 2CH4 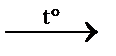 C2H2↑ + 3H2↑ пиролиз метана
C2H2↑ + 3H2↑ пиролиз метана
**3) C2H2Br4 + 2Mg(пыль) 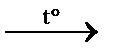 C2H2↑ + 2MgBr2 отщепление
C2H2↑ + 2MgBr2 отщепление
**4) C2H4Br2 + 2NaOH 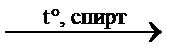 C2H2↑ + 2NaBr + 2Н2О отщепление
C2H2↑ + 2NaBr + 2Н2О отщепление
Физические свойства
Газ без цвета и запаха. Запах газа, получаемого при гидролизе карбида кальция, объясняется присутствием примесей сероводорода и фосфина. Лучше растворим в воде, чем метан и этилен. Легче воздуха, образует с ним «гремучую смесь».
Химические свойства
1) C2H2 + 2Cl2 → C2H2Cl4 присоединение хлора
2) C2H2 + 2Br2 → CHBr2–CHBr2 обесцвечивание бромной воды, качественная реакция на тройную связь
3) C2H2 + 2HBr → CH3–CHBr2 присоединение бромоводорода
4) С2H2 + 2Н2 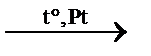 C2H6↑ гидрирование
C2H6↑ гидрирование
5) C2H2 + H2O 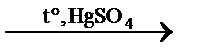 CН3–СНО (этаналь) реакция М.Г. Кучерова
CН3–СНО (этаналь) реакция М.Г. Кучерова
6) 2C2H2 + O2 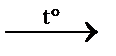 4C + 2H2O горение: на воздухе с копотью, 2C2H2 + 5O2
4C + 2H2O горение: на воздухе с копотью, 2C2H2 + 5O2 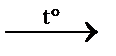 4CO2↑ + 2H2O в чистом кислороде без копоти
4CO2↑ + 2H2O в чистом кислороде без копоти
7) 3C2H2 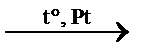 С6Н6 тримеризация
С6Н6 тримеризация
**8) НС≡CH + 2[Ag(NH3)2]OH→ AgC≡CAg↓+4NH3↑+ 2H2O замещение
качественная реакция на краевую тройную связь
Применение
1) Является сырьём для получения уксусного альдегида (ацетальдегида), уксусной и акриловой кислот, винилацетата, из которого производят клей ПВА, различных полимеров, каучуков, и других продуктов органического синтеза.
2) Для сварки и резки металлов (температура кислородно-ацетиленового пламени достигает 3000 ºС).
Физические свойства
Бесцветная легкоподвижная жидкость с характерным алкогольным запахом и жгучим вкусом, отлично растворимая в воде. Очень ядовита.
Действие на организм
При отравлении малыми дозами у человека мутнеет в глазах, руки и ноги сводят судороги. При более сильном отравлении человек может полностью потерять зрение или умереть от недостатка воздуха. Первая помощь при отравлении немедленно очистить и промыть желудок, полный покой и незамедлительное обращение к врачу.
Химические свойства
1) 2CH3ОН + 2Na → 2CH3ONa + H2↑ замещение
2) CH3OH + HBr 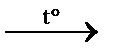 CH3Br + H2O замещение
CH3Br + H2O замещение
3) 2CH3OH + 3O2 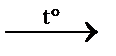 2CO2↑ + 4H2O горение
2CO2↑ + 4H2O горение
** 4) 2CH3OH 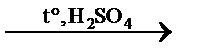 CH3OCH3 + H2O
CH3OCH3 + H2O
межмолекулярная дегидратация
Применение
Широко используется как растворитель органических веществ, а также как сырьё для получения метаналя (формальдегида), хлорметана, уксусной кислоты и других продуктов органического синтеза.
Физические свойства
Бесцветная легкоподвижная жидкость с характерным алкогольным запахом и жгучим вкусом, отлично растворимая в воде. Ядовита, но менее, чем метанол.
* В продажу поступает спирт-ректификат, т.е. 95,5 % раствор этанола, т.е. содержит 4,5 % воды. Такая смесь этилового спирта и воды перегоняется без разделения на спирт и воду и называется азеотропной смесью. Чтобы получить 100 % этиловый спирт (безводный или абсолютный) его кипятят с водоотнимающими реагентами (безводным медным купоросом или негашёной известью).
|
|
Химические свойства
1) 2C2H5ОН + 2Na → 2C2H5ОNa + H2↑ замещение
2) C2H5ОН + HBr 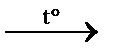 C2H5Br + H2O замещение
C2H5Br + H2O замещение
3) C2H5ОН + 3O2 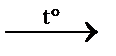 2CO2↑ + 3H2O горение
2CO2↑ + 3H2O горение
* 4) C2H5ОН + СuO 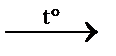 CH3CHO + Cu↓ +H2O окисление
CH3CHO + Cu↓ +H2O окисление
* 5) C2H5ОН  C2H4↑ + H2O внутримолекулярная дегидратация
C2H4↑ + H2O внутримолекулярная дегидратация
** 6) C2H5ОН + СН3СООН 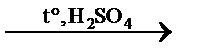 CH3СООC2H5 + H2O этерификация
CH3СООC2H5 + H2O этерификация
** 7) 2C2H5ОН  C2H5OC2H5 + H2O межмолекулярная дегидратация
C2H5OC2H5 + H2O межмолекулярная дегидратация
** 8) 2C2H5ОН 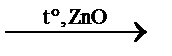 C4H6 + 2H2О + H2↑ реакция С.В. Лебедева
C4H6 + 2H2О + H2↑ реакция С.В. Лебедева
Применение
Является одним из наиболее важных органических веществ. Широко используется как растворитель (в технике) и антисептик (в медицине), для получения хлороформа, синтетического каучука, различных эфиров, красок и лаков, лекарственных препаратов, парфюмерных изделий (одеколонов, духов, лосьонов), а также в пищевой промышленности.
Нахождение в природе
Входит в состав всех жиров и некоторых других веществ, образующих животные ткани.
*Получение
1) Образуется при брожении углеводов (например, глюкозы – С6Н12О6) и гидролизе жиров (как кислотном, так и щелочном) – уравнения не приводятся, вследствие их сложности.
2) СН2Cl–СНCl– СН2Cl +3NaOH 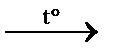 СН2OH–СНOH–СН2OH +3NaCl
СН2OH–СНOH–СН2OH +3NaCl
Физические свойства
Бесцветная, вязкая, гигроскопичная (см. стр.) жидкость без запаха и со сладковатым привкусом. Не ядовита. Смешивается с водой в любых отношениях. Имеет высокую температуру кипения (tº = 290 ºC).
Химические свойства
1) 2СН2OH–СНOH–СН2OH + 6Na → 2СН2ONa–СНONa–СН2ONa + 3H2↑ замещение
2) 2С3Н8О3 + 7О2 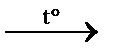 6CО2↑ + 8Н2О горение
6CО2↑ + 8Н2О горение
3) СН2OH–СНOH–СН2OH+ 3HNO3 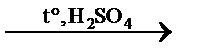 СН2ONO2–СНONO2–СН2ONO2 +
СН2ONO2–СНONO2–СН2ONO2 +
тринитрат глицерина («нитроглицерин»)
+ 3H2O нитрование
4) С3Н8О3 + Cu(OH)2 → глицерат меди (II) – ярко-синий комплекс. Полное уравнение не приводятся, вследствие его сложности.
Применение
Широко используется в кожевенной, текстильной, пищевой и кондитерской промышленностях, в парфюмерии и косметологии, как сырьё для получения лекарственных препаратов (например, 1 % раствор «нитроглицерина» используется, как сосудорасширяющее средство), взрывчатых веществ (например, динамита) и полимеров: лаков, красок, клеев.
ОСНОВНЫЕ СВЕДЕНИЯ
ОБ УКСУСНОЙ КИСЛОТЕ
|
|
| Общие сведения | ||
| Молекулярная формула СН3COOH | Графическая формула

| Электронная
формула

|
|
Нахождение в природе Широко распространена в природе – содержится зелёных листьях растений, в выделениях животных (моче, желчи). Образуется при окислении многих органических веществ, а также при брожении, гниении, скисании вина и пива, содержится в кислом молоке и сыре. | ||
| *Получение 1) С4Н10 + 4[O] 2) С2H5OH + 2[O] 3) СH3CHO + [O] 4) CH3COONa + H2SO4(конц.) | ||
|
Физические свойства Безводная уксусная кислота представляет собой бесцветную кристаллическую массу, напоминающую лёд, поэтому ее называют «ледяной» (впервые получена в 1789 году Т.Е. Ловицем (Россия)). Обычная техническая кислота – представляет бесцветную легкоподвижную жидкость с резким специфическим запахом, отлично растворимую в воде. 70-80 % раствор называют уксусной эссенцией, а 3-9 % раствор пищевым уксусом. | ||
|
Химические свойства 1) 2CH3COOH + Zn → (CH3COO)2Zn + H2↑ замещение 2) 2CH3COOH + ZnO → (CH3COO)2Zn + H2O обмен 3) CH3COOH + NaOH → CH3COONa + H2O обмен 4) 2CH3COOH + Na2CO3 → 2CH3COONa + CO2↑ + H2O обмен с разложением 5) CH3COOH + C2H5ОН | ||
|
Применение Широко используется в химической промышленности для получения солей – ацетатов, сложных эфиров (например, этилацетата), уксусного ангидрида, лекарственных препаратов, различных полимеров, ядохимикатов, а также в пищевой и консервной промышленностях. | ||
ОСНОВНЫЕ СВЕДЕНИЯ О ЖИРАХ
| ЖИР – это кислородсодержащее органическое веществ, состоящее из остатка глицерина и трёх остатков высших карбоновых кислот. | |
| Исторические сведения Впервые химический состав был установлен в 1817 году М.Э. Шеврелем совместно с А. Браконно (Франция), а первый синтез жира осуществлен в 1854 году П.Э.М. Бертло (Франция) при нагревании глицерина со стеариновой кислотой. | Графическая формула

|
Нахождение в природе
Широко распространены в природе, как в растительном, так и животном мире. В организмах они находятся либо в виде протоплазматического жира – выходят в состав протоплазмы клеток, либо в виде запасного (резервного) жира – входят в состав жировой ткани.
Жир человека содержит до 70 % олеиновой кислоты и 25 % стеариновой кислоты, а жир жвачных животных больше содержит стеариновой кислоты. Оливковое масло содержит до 80 %, а подсолнечное масло – до 40 % олеиновой кислоты.
Физические свойства
Жиры, как правило, белые, бледно-жёлтые или жёлтые вещества, не растворимые в воде и легче её. Хорошо растворимы в органических растворителях, например, бензоле, дихлорэтане, бензине и другие.
Химические свойства
1) жир +3NaOH 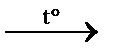 глицерин + мыла (соли высших карбоновых кислот)
глицерин + мыла (соли высших карбоновых кислот)
2) жир + 3H2O 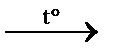 глицерин + высшие карбоновые кислоты
глицерин + высшие карбоновые кислоты
3) жидкий жир + 3Н2 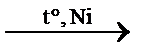 твёрдый жир (получение маргарина)
твёрдый жир (получение маргарина)
Применение
Широко используются в пищевой, фармацевтической и химической промышленностях (для получения олифы, мыла), косметологии и парфюмерии, а также как ценные питательные продукты.
|
|
ОСНОВНЫЕ СВЕДЕНИЯ О ГЛЮКОЗЕ
| Общие сведения | ||
| Молекулярная формула С6Н12О6 | Является моносахаридом, гексозой и альдозой | Графическая формула
|
|
Нахождение в природе Широко распространена в природе: в растительном мире содержится в спелых ягодах и фруктах, особенно винограде (поэтому её называют виноградным сахаром); в животном мире – в крови и других органах. Является составной частью сахарозы, крахмала, целлюлозы и других полисахаридов. | ||
|
Физические свойства Твёрдое бесцветное кристаллическое вещество, без запаха, сладкое на вкус, хорошо растворимое в воде. | ||
|
Химические свойства 1) C6H12O6 + Ag2O 2) C6H12O6 + Н2 3) С6Н12О6 4) С6Н12О6 5) С6Н12О6 маслянокислое брожение | ||
|
Применение Является сырьём для получения витамина С, глюконата кальция, сорбита, этанола, молочной кислоты и других продуктов. Используется в медицине в виде 2 %,10 % и 40 % растворов, а также входит в состав кровезаменителей и других препаратов. | ||
Нахождение в природе
Широко распространена в природе. Содержится в сахарной свекле (12-20 %) и сахарном тростнике (14-26 %), поэтому сахарозу называют свекловичным или тростниковым сахаром. Присутствует также в стеблях, корнях и плодах других растений (например, в кукурузе, арбузах и дынях), а также в соке сахарного клёна и сахарной пальмы.
Физические свойства
Твёрдое бесцветное кристаллическое вещество, без запаха, сладкое на вкус (более сладкое, чем глюкоза), хорошо растворимое в воде.
Химические свойства
1) С12Н22О11 + Н2O  C6H12O6 + C6H12O6 гидролиз
C6H12O6 + C6H12O6 гидролиз
глюкоза фруктоза
Применение
Широко применятся как ценный питательный продукт (занимает первое место среди органических веществ). Огромные количества сахара используются в пищевой и кондитерской промышленности.
Нахождение в природе
Образуется в растениях в результате фотосинтеза и откладывается в корнях, клубнях или семенах. Зерна риса содержат до 80 %, пшеницы и ржи – около 70 %, а клубни картофеля – от 12 до 24 % крахмала. В животном мире распространён родственник крахмала – гликоген (животный крахмал), он откладывается преимущественно в печени.
*Получение
1) В природе образуется в результате фотосинтеза:
6nCO2 + 5nH2O 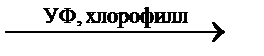 (C6H10O5)n + 6nO2↑
(C6H10O5)n + 6nO2↑
2) Выделяют из картофеля, риса или кукурузы.
При выделении из картофеля: клубни измельчают, заливают холодной водой, полученную взвесь отстаивают, фильтруют и сушат.
Физические свойства
Белый аморфный порошок, состоящий из мелких зерен, без запаха. В холодной воде не растворяется, в горячей набухает и постепенно растворяется и образует вязкий раствор, который при охлаждении застывает в стекловидную массу – клейстер.
Химические свойства
1) (C6H10O5)n + nН2O  nC6H12O6 гидролиз
nC6H12O6 гидролиз
2) (C6H10O5)n + I2 → ярко-синее окрашивание (**образуется комплекс включения), это качественная реакция
Применение
Широко используется как ценный питательный продукт, а также в пищевой, кондитерской промышленностях и в медицине. Из зерна или картофеля в результате ферментативного гидролиза крахмала получают этиловый спирт. Значительные количества крахмала употребляют для проклеивания тканей, склеивания бумаги и картона, приготовления канцелярского декстринового клея.
ОСНОВНЫЕ СВЕДЕНИЯ О
ЦЕЛЛЮЛОЗЕ (КЛЕТЧАТКЕ)
| Общие сведения | ||
| Молекулярная формула (С6Н10О5)m где, n < m (в сравнении с крахмалом) | Является полисахаридом, т.е. т.е. содержит несколько десятков тысяч, а иногда и сотен тысяч углеводных остатков | **Состоит из остатков β-глюкозы. Является линейным периодическим полимером. |
|
Нахождение в природе Очень широко распространена в природе. Является составной частью оболочки всех растительных клеток. Содержится в древесине (50-60 %), в волокнах конопли и льна (до 70 %), в волокнах хлопка (до 98 %). | ||
| *Получение В основном из древесины сульфитным методом: древесину измельчают, смешивают с гидросульфитом кальция (иногда гидросульфитом натрия) и помещают в автоклав, где нагревают до 150 ºС и повышают давление до 0,5–0,6 МПа. Полученную целлюлозу отфильтровывают, промывают и сушат. | ||
|
Физические свойства Белое волокнистое вещество, нерастворимое в воде и обычных органических растворителях. Целлюлоза хорошо растворима в реактиве Швейцера (аммиачном растворе гидроксида меди (II)). | ||
|
Химические свойства 1) (C6H10O5)m + mН2O 2) (C6H10O5)m + HNO3(конц.) 3) (C6H10O5)m + СН3СООН | ||
|
Применение Широко применяют в целлюлозно-бумажной (получение бумаги и картона) и текстильной (получение натуральных и искусственных тканей) промышленностях, для получения взрывчатых и полимерных веществ (например, целлофана), в медицине, а также для изготовления мебели и как строительный материал. | ||
ОСНОВНЫЕ СВЕДЕНИЯ
Об АМИНОУКСУСНОЙ КИСЛОТЕ
| Общие сведения | ||
| Молекулярная формула NH2СН2COOH содержит две функциональных группы: –NH2 аминогруппа –СООН карбоксильная группа | Простейшая α-аминокислота. Её также называют глицин или гликокол. | Графическая формула

|
|
Нахождение в природе Входит в состав белковых молекул животного и растительного происхождения (желатины, белков шёлка). | ||
| **Исторические сведения Впервые выделена в 1820 году А. Браконно (Франция). Он подверг кислотному гидролизу хрящи животных и выделил «зернистые кристаллы», которые были сладкими на вкус. Поэтому он назвал выделенное вещество «клеевым сахаром», в последствии оно было названо гликокол (глицин). В 1836 году подобные опыты проводил голландский химик | ||
| *Получение Образуется в результате гидролиза белковых молекул (желатины). Гидролиз можно проводить как в присутствии серной кислоты, так и щелочи (гидроксида бария). | ||
|
Физические свойства Бесцветное кристаллическое вещество, сладкое на вкус, без запаха, хорошо растворимое в воде. | ||
|
Химические свойства 1) NH2СН2COOH + NaOH → NH2СН2COONa + H2O обмен 2) присутствие двух противоположных групп (–СООН – кислотные, а 3) NH2СН2COOH + NH2СН2COOH → NH2СН2 CONH СН2COOH + H2O дипептид (выделена пептидная связь) | ||
|
Применение Применяется в медицине как восстанавливающее и укрепляющее лекарственное средство, а также для получения пептидов. | ||
ОСНОВНЫЕ СВЕДЕНИЯ О БЕЛКАХ
| Общие сведения Все белки содержат четыре химических элемента: C, H, O и N, некоторые S и Fe. Большинство белков состоят из двадцати α-аминокислот (девять из них для человека являются незаменимыми, т.е. в организме они не синтезируются). Каждый индивидуальный белок имеет строго свою последовательность и количество α-аминокислотных звеньев. |
| Нахождение и роль в природе Присутствуют во всех формах живой материи. Без белков жизнь фактически невозможна. Они содержатся в протоплазме и ядре всех растительных и животных клеток. |
| Биологические функции а) структурно-каркасная (например, коллаген, фиброин); б) защитная (например, интерферон); в) ферментативная – белки-ферменты (например, каталаза, амилаза); г) транспортная (например, гемоглобин, миоглобин); д) запасающая (например, альбумин, казеин); е) гормональная (например, инсулин); ж) энергетическая и другие. |
| Строение По современным представлениям белки имеют четыре уровня организации: первичную, вторичную, третичную и четвертичную структуры (см. в «Химическом минимуме»). |
| Физические свойства Очень разнообразны. Одни белки представляют жидкие коллоидные растворы, растворимые в воде или растворе хлорида натрия (альбумины, глобулины). Другие ни в чём не растворимы и представляют нитеподобные (фибриллярные) вещества (склеропротеины, из них состоят волосы, сухожилия, кости, рога, копыта, перья). |
Химические свойства
1) Белок + Н2O  α-АК (набор α-аминокислот) гидролиз
2) Под действие ряда факторов белки могут частично или полностью терять биологическую активность, т.е. не выполнять те или иные биологические функции, такой процесс называется денатурацией.
3) Белок + Cu(OH)2 → красно-фиолетовый раствор биуретовая реакция или качественная реакция на пептидную связь.
4) Белок + НNO3 α-АК (набор α-аминокислот) гидролиз
2) Под действие ряда факторов белки могут частично или полностью терять биологическую активность, т.е. не выполнять те или иные биологические функции, такой процесс называется денатурацией.
3) Белок + Cu(OH)2 → красно-фиолетовый раствор биуретовая реакция или качественная реакция на пептидную связь.
4) Белок + НNO3 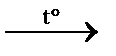 желтое окрашивание ксантопротеиновая реакция (см. в «Химическом минимуме») желтое окрашивание ксантопротеиновая реакция (см. в «Химическом минимуме»)
|
ОСНОВНЫЕ СВЕДЕНИЯ
О НУКЛЕИНОВЫХ КИСЛОТАХ
Общие сведения
Все нуклеиновые кислоты содержат пять химических элементов: C, H, O, N и Р. Состоят из нуклеотидов, которые связаны между собой фосфорнодиэфирной связью (** через положения 3 и 5). Нуклеотиды состоят из азотсодержащего гетероциклического основания, углевода и остатков фосфорной кислоты.
Классификация
Состав
Углевод
Азотсодержащие гетероциклические основания
(** привязаны к С1 в углеводе через атом азота):
Строение
Роль в природе
ОСНОВНЫЕ СВЕДЕНИЯ О МЕТАНЕ
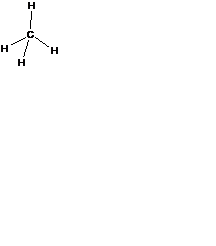
| Общие сведения | |||
| Молекулярная формула СН4 | Графическая
формула

| Структурная
формула
| Электронная
формула
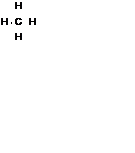
|
Нахождение в природе
Метан содержится в природном газе (от 60 до 98 %), попутном нефтяном газе (от 30 до 80 %). Метан называют болотным или рудничным газом, т.к. он образуется на болотах при гниении растительных остатков без доступа воздуха, а также при медленном разложении каменного угля под землёй. Содержится в атмосфере Сатурна и Юпитера.
Получение
1) Образуется при крекинге нефти, сухой перегонке древесины, торфа и каменного угля.
2) С +2Н2 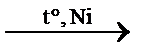 CH4↑ прямой синтез
CH4↑ прямой синтез
*3) CO + 3H2 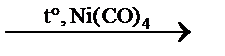 CH4↑ + H2O синтез Ф.Фишера–Г.Тропша
CH4↑ + H2O синтез Ф.Фишера–Г.Тропша
**4) Al4C3 +12H2O → 3CH4↑ + 4Al(OH)3↓ гидролиз карбида алюминия
**5) CH3COONa + NaOH 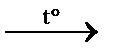 3CH4↑ + Na2CO3 реакция Ж.Б.А. Дюма
3CH4↑ + Na2CO3 реакция Ж.Б.А. Дюма
Физические свойства
Газ без цвета и запаха, очень плохо растворимый в воде. Легче воздуха.
Химические свойства
1) CH4 + Cl2 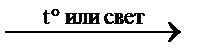 CH3Cl + HCl↑ замещение (хлорирование)
CH3Cl + HCl↑ замещение (хлорирование)
2) CH4 + Br2 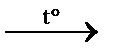 CH3Br + HBr↑ замещение (бромирование)
CH3Br + HBr↑ замещение (бромирование)
|
| Поделиться: |
Последнее изменение этой страницы: 2021-05-12; просмотров: 55; Нарушение авторского права страницы; Мы поможем в написании вашей работы!
infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.102.124 (0.217 с.)
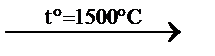 C2H2↑ + 3H2↑ пиролиз
C2H2↑ + 3H2↑ пиролиз
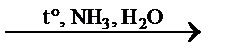 C6H12O7 + 2Ag↓ реакция «серебряного зеркала»
C6H12O7 + 2Ag↓ реакция «серебряного зеркала»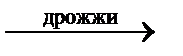 2C2Н5ОН + 2СО2↑ спиртовое брожение
2C2Н5ОН + 2СО2↑ спиртовое брожение 2C3Н6О3 молочнокислое брожение
2C3Н6О3 молочнокислое брожение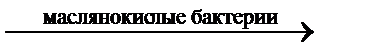 C3Н7СООН + 2СО2 + 2Н2
C3Н7СООН + 2СО2 + 2Н2 


