Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адениловая система (атф, адф, амф) и ее биологическое значение. Энергетический заряд клетки. Другие макроэргические соединения. Механизмы синтеза атф.Стр 1 из 15Следующая ⇒
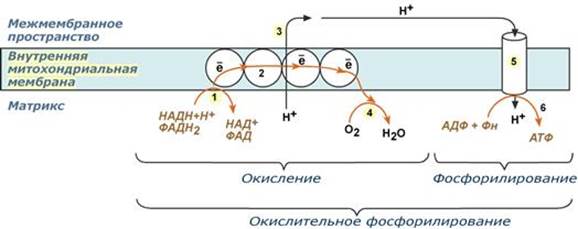
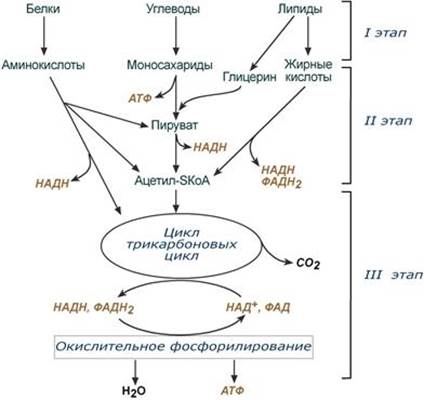
Современное представление о тканевом дыхании. Субстраты тканевого дыхания. Дыхательная цепь митохондрий и ее характеристика: пиридинзависимые и флавинзависимые дегидрогеназы, убихинон (коэнзим Q), цитохромы. Химическое строение, участие в транспорте электронов на кислород. Всего цепь переноса электронов (англ. electron transport chain) включает в себя разнообразные белки, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ. 1-ый комплекс. НАДН-КоQ-оксидоредуктаза Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 42 белковых молекулы, из них не менее 6 железосерных белков. Функция: 1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон). 2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 2 комплекс. ФАД-зависимые дегидрогеназы Данный комплекс как таковой не существует, его выделение условно. К нему относятся ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (β-окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса атомов водорода). Функция: 1. Восстановление ФАД в окислительно-восстановительных реакциях. 2. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q (убихинон) 3 комплекс. КоQ-цитохром c-оксидоредуктаза По другому данный комплекс называется цитохром с редуктаза. В его составе имеются молекулы цитохрома b и цитохрома c1, железо-серные белки. Комплекс представляет собой 2 мономера, в каждом из которых насчитывается 11 полипептидных цепей. Функция: 1. Принимает электроны от коэнзима Q и передает их на цитохром с. 2. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 4 комплекс. Цитохром с-кислород-оксидоредуктаза В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, состоит из 13 субъединиц. В комплексе имеются ионы меди, соединенные с белками комплекса через HS-группы цистеина, и формирующие центры, подобные тем, что имеются в железо-серных белках.
Функция: 1. Принимает электроны от цитохрома с и передает их на кислород с образованием воды. 2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 5 комплекс Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы: - одна группа формирует субъединицу Fo (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. - другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ. Механизм работы АТФ-синтазы получил название вращательный катализ. --- Окислительное фосфорилирование как основной механизм синтеза АТФ в животных клетках. Этапы, регуляция. Причины гипоэнергетических состояний. Разобщители и ингибиторы окислительного фосфорилирования, механизм их действия Окислительное фосфорилирование – это многоэтапный процесс, происходящий во внутренней мембране митохондрий и заключающийся в окислении восстановленных эквивалентов (НАДН и ФАДН2) ферментами дыхательной цепи и сопровождающийся синтезом АТФ. Впервые механизм окислительного фосфорилирования был предложен Питером Митчеллом. Согласно этой гипотезе перенос электронов, происходящий во внутренней митохондриальной мембране, вызывает выкачивание ионов Н+ из матрикса митохондрий в межмембранное пространство. Это создает градиент концентрации ионов Н+ между цитозолем и замкнутым внутримитохондриальным пространством. Ионы водорода в норме способны возвращаться в матрикс митохондрий только одним способом – через специальный фермент, образующий АТФ – АТФ-синтазу. По современным представлениям внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты называют дыхательными ферментами, а последовательность их расположения в мембране – дыхательной цепью или электрон-транспортной цепью (англ. electron transport chain).
В целом работа дыхательной цепи заключается в следующем: 1. Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи. 2. Электроны движутся по ферментам дыхательной цепи и теряют энергию. 3. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство. 4. В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды. 5. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу. При этом они теряют энергию, которая используется для синтеза АТФ
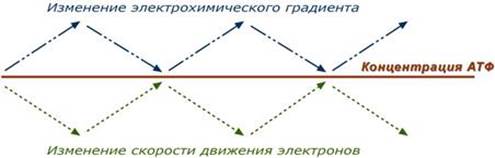
Дыхательный контроль – это прямое ингибирующее влияние электрохимического градиента на скорость движения электронов по дыхательной цепи (т.е. на величину дыхания). В свою очередь, величина градиента напрямую зависит от соотношения АТФ / АДФ, количественная сумма которых в клетке примерно постоянна ([АТФ] + [АДФ] = const). Реакции катаболизма направлены на поддержание постоянно высокого уровня АТФ и низкого АДФ.
Причиной гипоэнергетических состояний может быть следующее: - гиповитаминозы экзогенные и/или эндогенные – снижается скорость и эффективность окислительных реакций. Возникает обычно при нехватке витаминов – В1, В2, никотиновой кислоты, В6, пантотеновой кислоты и аскорбиновой кислоты, - дефицит белка в пище – снижается синтез всех ферментов и ферментов катаболизма в частности, - снижение потребления углеводов и липидов как основных источников энергии, - дефицит кислорода – отсутствие акцептора для электронов вызывает "переполнение" дыхательных ферментов, накопление НАДН и ФАДН2 в клетке и прекращение катаболизма, - дефицит железа – компонента цитохромов, миоглобина и гемоглобина, и меди – компонента цитохромоксидазы. Разъединение (разобщение) процессов окисления и фосфорилирования осуществляют вещества, называемые разобщители. Они снижают величину электрохимического градиента, что приводит к уменьшению синтеза АТФ, несмотря на увеличение скорости движения электронов по дыхательной цепи и возрастание катаболизма. К разобщителям в первую очередь относят " протонофоры " – молекулы, переносящие ионы водорода из межмембранного пространства в матрикс митохондрии. При этом одновременно уменьшаются оба компонента электрохимического градиента – электрический и химический, и энергия градиента не используется для синтеза АТФ, а рассеивается в виде тепла. Следствием эффекта протонофоров является возрастание катаболизма жиров и углеводов в клетке. Классическим экспериментальным протонофором является динитрофенол, жирорастворимое соединение, присоединяющий ионы водорода на внешней поверхности внутренней митохондриальной мембраны и отдающий их на внутренней поверхности. Физиологическими протонофорами являются особые разобщающие белки, в частности термогенин. Кроме динитрофенола и термогенина протонофорами, к примеру, являются салицилаты, дикумарол, жирные кислоты, непрямой билирубин, трийодтиронин. --- Митохондрии, особенности строения мембран митохондрий. Комплексы дыхательной цепи: состав, топология, участие в процессах биологического окисления. Митохондриальный синтез АТФ. АТФ- синтетаза. Сопряжение процессов тканевого дыхания и фосфорилирования.
Наружная мембрана митохондрий содержит много молекул специализированных транспортных белков (например, порин), что обеспечивает её высокую проницаемость, а также белки-рецепторы, распознающие белки, которые переносятся через обе мембраны митохондрий в особых точках их контакта – зонах слипания. Внутренняя мембрана митохондрий образует складки – кристы, благодаря чему значительно увеличивается внутренняя поверхность митохондрий. В состав внутренней мембраны входят транспортные белки; ферменты дыхательной цепи и сукцинатдегидрогеназа; комплекс АТФ-синтетазы. На кристах имеются элементарные частицы (оксисомы, или F1-частицы), состоящие из округлой головки (9 нм) и цилиндрической ножки. Именно на них происходит сопряжение процессов окисления и фосфорилирования (АДФ → АТФ). Чаще всего кристы располагаются перпендикулярно длинной оси митохондрий и имеют пластинчатую (ламеллярную) форму. В клетках, синтезирующих стероидные гормоны, кристы имеют вид трубочек или пузырьков - тубулярно-везикулярные кристы. В этих клетках ферменты стероидного синтеза частично локализуются на внутренней мембране митохондрий
Комплекс I (НАДН-дегидрогеназа) включает ФМН и железосерный белок FeS (негемовое железо). Железосерный белок участвует в окислительно-восстановительном процессе. Комплекс I окисляет НАДН, перенося с него 2 электрона на кофермент Q (KоQ) и перекачивает 4 протона из матрикса в межмембранное пространство митохондрии. KoQ(убихинон) - производное бензохинона. Это некрупная липофильная молекула. Перемещаясь в липидном слое мембраны, убихинон обеспечивает передачу электронов между комплексами I - III и II - III. Комплекс II (сукцинат-дегидрогеназа) включает ФАД и железосерный белок. Обеспечивает вход в цепь дополнительных электронов за счет окисления сукцината. Комплекс III (QН2-дегидрогеназа) включает цитохромы b и с1 и железосерный белок. Цитохромы- гемопротеины, в которых простетическая геминовая группа близка к гему гемоглобина (у цитохрома b идентична). Комплекс III переносит электроны с убихинона на цитохром с и перекачивает 2 протона в межмембранное пространство. Комплекс IV (цитохром c оксидаза) состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди. Комплекс IV катализирует перенос электронов с молекул цитохрома на O2 и перекачивает 4 протона в межмембранное пространство.
АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1.
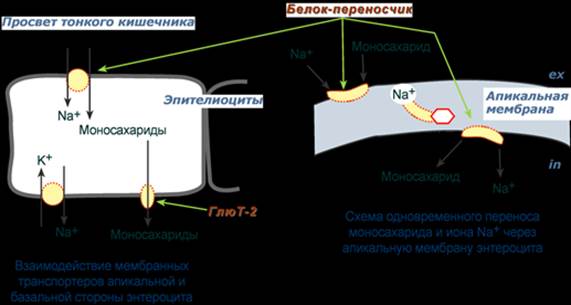
А - F0 и F1 - комплексы АТФ-синтазы, В состав F0 входят полипептидные цепи, которые образуют канал, пронизывающий мембрану насквозь. По этому каналу протоны возвращаются в матрикс из межмембранного пространства; белок F1 выступает в матрикс с внутренней стороны мембраны и содержит 9 субъединиц, 6 из которых образуют 3 пары α и β ("головка"), прикрывающие стержневую часть, которая состоит из 3 субъединиц γ, δ и ε. γ и ε подвижны и образуют стержень, вращающийся внутри неподвижной головки и связанный с комплексом F0. В активных центрах, образованных парами субъединиц α и β, происходит связывание АДФ, неорганического фосфата (Рi) и АТФ. Б - Каталитический цикл синтеза АТФ включает 3 фазы, каждая из которых проходит поочерёдно в 3 активных центрах: 1 - связывание АДФ и Н3РО4; 2 - образование фосфоангидридной связи АТФ; 3 - освобождение конечного продукта. При каждом переносе протонов через канал F0 в матрикс все 3 активных центра катализируют очередную фазу цикла. Энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация α- и β-субъединиц и происходит синтез АТФ. --- Всасывание в кишечнике После переваривания крахмала и гликогена, после расщепления дисахаридов в полости кишечника накапливается глюкоза и другие моносахариды, которые должны попасть в кровь. Для этого им необходимо преодолеть, как минимум, апикальную мембрану энтероцита и его базальную мембрану. Вторично-активный транспорт По механизму вторичного активного транспорта из просвета кишечника происходит всасывание глюкозы и галактозы. Такой механизм означает, что затрата энергии при переносе сахаров происходит, но тратится она не непосредственно на транспорт молекулы, а на создание градиента концентрации другого вещества. В случае моносахаридов таким веществом является ион натрия. Фермент Na+,К+-АТФаза постоянно, в обмен на калий, выкачивает ионы натрия из клетки, именно этот транспорт требует затрат энергии. В просвете кишечника содержание натрия относительно высоко и он связывается со специфическим мембранным белком, имеющим два центра связывания: один для натрия, другой для моносахарида. Примечательно то, что моносахарид связывается с белком только после того, как с ним свяжется натрий. Белок-транспортер свободно мигрирует в толще мембраны. При контакте белка с цитоплазмой натрий быстро отделяется от него по градиенту концентрации и сразу отделяется моносахарид. Результатом является накопление моносахарида в клетке, а ионы натрия выкачиваются Na+,К+-АТФазой. Выход глюкозы из клетки в межклеточное пространство и далее кровь происходит благодаря облегченной диффузии.
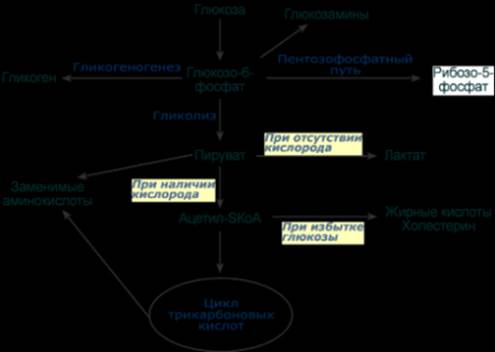
Пассивный транспорт В отличие от глюкозы и галактозы, фруктоза и другие моносахара всегда транспортируются белками-транспортерами, не зависящими от градиента натрия, т.е. облегченной диффузией. Так, на апикальной мембране энтероцитов находится транспортный белок ГлюТ-5, через который фруктоза диффундирует в клетку. Для глюкозы вторично-активный транспорт используется при ее низких концентрациях в кишечнике. Если концентрация глюкозы в просвете кишечника велика, то она также может транспортироваться в клетку путем облегченной диффузии при участии белка ГлюТ-5. Транспорт из крови через мембраны клеток После выхода в кровь, оттекающую от кишечника, моносахариды движутся по сосудам воротной системы в печень, частично задерживаются в ней, частично выходят в большой круг кровообращения. Следующей их задачей стоит проникновение в клетки органов. Из крови внутрь клеток глюкоза попадает при помощи облегченной диффузии по градиенту концентрации с участием белков-переносчиков (глюкозных транспортеров – " ГлюТ "). Всего выделяют 12 типов транспортеров глюкозы, отличающихся локализацией, сродством к глюкозе и способностью к регулированию. Глюкозные транспортеры ГлюТ-1 имеются на мембранах всех клеток и ответственны за базовый транспорт глюкозы в клетки, требуемый для поддержания жизнеспособности. Особенностями ГлюТ-2 является способность пропускать глюкозу в двух направлениях и низкое сродство к глюкозе. Переносчик представлен, в первую очередь, в гепатоцитах, которые после еды захватывают глюкозу, а в постабсорбтивный период и при голодании поставляют ее в кровь. Также присутствует этот транспортер в эпителии кишечника и почечных канальцев. Присутствуя на мембранах β-клеток островков Лангерганса, ГлюТ-2 переносит глюкозу внутрь при ее концентрации свыше 5,5 ммоль/л и благодаря этому генерируется сигнал для увеличения выработки инсулина. Глют-3 обладает высоким сродством к глюкозе и представлен в нервной ткани. Поэтому нейроны способны поглощать глюкозу даже при низких ее концентрациях в крови. В мышцах и жировой ткани находится ГлюТ-4, только эти транспортеры являются чувствительными к влиянию инсулина. При действии инсулина на клетку они выходят на поверхность мембраны и переносят глюкозу внутрь. Указанные ткани получили название инсулинзависимых. Некоторые ткани совершенно нечувствительны к действию инсулина, их называют инсулиннезависимыми. К ним относятся нервная ткань, стекловидное тело, хрусталик, сетчатка, клубочковые клетки почек, эндотелиоциты, семенники и эритроциты. После активации (фосфорилирования) глюкоза, в зависимости от условий и вида клетки, превращается по различным направлениям: - часть глюкозы обязательно используется в энергетическом обмене, она сгорает в реакциях аэробного и анаэробного гликолиза для синтеза АТФ, - при достаточно большом количестве глюкоза запасается в виде гликогена, к синтезу гликогена способны большинство тканей, - в гепатоцитах (при высокой концентрации), в миоцитах и в адипоцитах глюкоза перенаправляется на синтез триацилглицеролов, - в печени и иных тканях глюкоза используется для синтеза холестерола, - при определенных условиях часть глюкозы идет в реакции пентозофосфатного пути, в котором образуются рибозо-5-фосфат и НАДФН, - некоторая доля глюкозы используется для синтеза глюкозаминов и далее структурных или иных гетерополисахаридов.
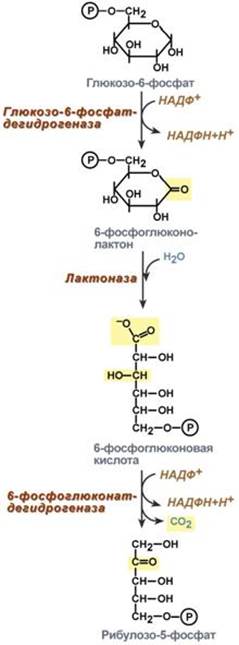
--- Энергетическая Генерация атомов водорода для работы дыхательной цепи, а именно трех молекул НАДН и одной молекулы ФАДН2, синтез одной молекулы ГТФ (эквивалентна АТФ). 2. Анаболическая. В ЦТК образуются предшественник гема – сукцинил-SКоА, кетокислоты, способные превращаться в аминокислоты – α-кетоглутарат для глутаминовой кислоты, оксалоацетат для аспарагиновой, лимонная кислота, используемая для синтеза жирных кислот, оксалоацетат, используемый для синтеза глюкозы. --- 18. Пентозофосфатный путь распада глюкозы, этапы, назначение. Так как в клетках непрерывно просходят реакции синтеза белков, то для этого процесса требуются рибонуклеиновые кислоты. В свою очередь для синтеза самих нуклеиновых кислот, а точнее пуриновых и пиримидиновых нуклеотидов, требуется рибозо-5-фосфат. Если клетка готовится к делению, то для синтеза ДНК ей нужны дезоксирибонуклеотиды, которые образуются при участии НАДФН. Наиболее активно реакции пентозофосфатного пути идут в цитозоле клеток печени, жировой ткани, эритроцитах, коре надпочечников, молочной железе при лактации, в гораздо меньшей степени в скелетных мышцах. Этот путь окисления глюкозы не связан с образованием энергии, а обеспечивает анаболизм клеток. В связи с этим у новорожденных и детей первых лет жизни его активность довольно высока. Пентозофосфатный путь включает два этапа – окислительный и этап структурных перестроек (неокислительный). На первом, окислительном, этапе глюкозо-6-фосфат в трех реакциях превращается в рибулозо-5-фосфат, реакции сопровождаются восстановлением двух молекул НАДФ до НАДФН. На этом этапе происходит регуляция процесса: инсулин повышает активность глюкозо-6-фосфат-дегидрогеназы и фосфоглюконат-дегидрогеназы.
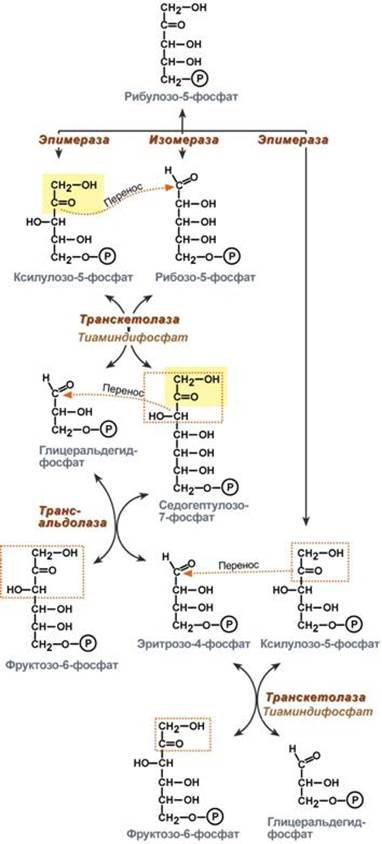
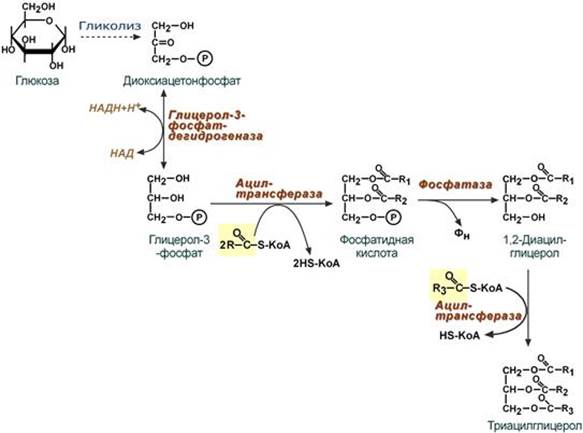
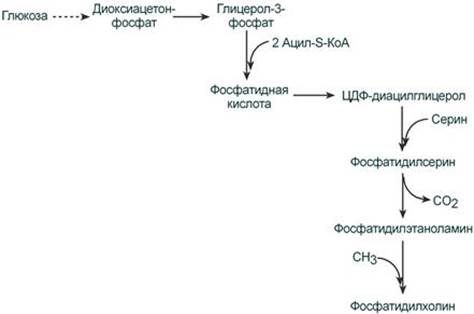
Второй этап – этап структурных перестроек, благодаря которым пентозы способны возвращаться в фонд гексоз. В этих реакциях молекулы рибулозо-5-фосфата изомеризуются до рибозо-5-фосфата и ксилулозо-5-фосфата. Далее под влиянием ферментов транскетолазы и трансальдолазы происходят структурные перестройки с образованием других моносахаридов. При реализации всех реакций второго этапа пентозы превращаются во фруктозо-6-фосфат и глицеральдегид-3-фосфат, т.е. возвращаются в реакции гликолиза. Поэтому иногда пентозофосфатный путь называют шунтом, т.е. рассматривают как обходной путь окисления глюкозы. Глицеральдегид-3-фосфат в зависимости от условий и вида клеток может либо "проваливаться" во 2-й этап гликолиза, либо через диоксиацетонфосфат восстанавливаться до глицерол-3-фосфата и далее направляться в синтез фосфатидной кислоты и далее триацилглицеролов, либо при необходимости из него могут образоваться и гексозы.
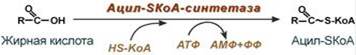
--- 21. Ресинтез липидов в клетках слизистой тонкого кишечника. Пути ресинтеза триацилглицеролов, фосфолипидов, эфиров холестерола. Ресинтез липидов – это синтез липидов в стенке кишечника из поступающих сюда экзогенных жиров, одновременно могут использоваться и эндогенные жирные кислоты, поэтому ресинтезированные жиры отличаются от пищевых и более близки по составу к "своим" жирам. Основная задача этого процесса – связать поступившие с пищей средне- и длинноцепочечные жирные кислоты со спиртом – глицеролом или холестеролом. Это, во-первых, ликвидирует их детергентное действие на мембраны и, во-вторых, создает их транспортные формы для переноса по крови в ткани. Активация жирной кислоты Поступившая в энтероцит (как и в любую другую клетку) жирная кислота обязательно активируется через присоединение коэнзима А. Образовавшийся ацил-SКоА участвует в реакциях синтеза эфиров холестерола, триацилглицеролов и фосфолипидов.
Ресинтез эфиров холестерола Холестерол этерифицируется с использованием ацил-SКоА и фермента ацил-SКоА:холестерол-ацилтрансферазы (АХАТ).
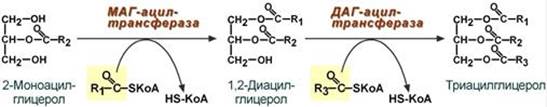
Ресинтез триацилглицеролов Для ресинтеза ТАГ есть два пути: 1. Первый путь, основной – 2-моноацилглицеридный – происходит при участии экзогенных 2-МАГ и ЖК в гладком эндоплазматическом ретикулуме энтероцитов: мультиферментный комплекс триацилглицерол-синтазы формирует ТАГ.
2. Поскольку 1/4 часть ТАГ в кишечнике полностью гидролизуется, а глицерол в энтероцитах не задерживается и быстро переходит в кровь, то возникает относительный избыток жирных кислот для которых не хватает глицерола. Поэтому существует второй, глицеролфосфатный, путь в шероховатом эндоплазматическом ретикулуме. Источником глицерол-3-фосфата служит окисление глюкозы. Здесь можно выделить следующие реакции: - Образование глицерол-3-фосфата из глюкозы. - Превращение глицерол-3-фосфата в фосфатидную кислоту. - Превращение фосфатидной кислоты в 1,2-ДАГ. - Синтез ТАГ.
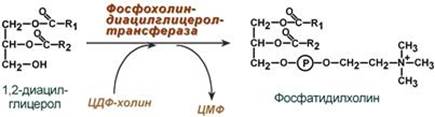
Ресинтез фосфолипидов Фосфолипиды синтезируются также, как и в остальных клетках организма (см "Cинтез фосфолипидов"). Для этого есть два способа: Первый путь – с использованием 1,2-ДАГ и активных форм холина и этаноламина для синтеза фосфатидилхолина или фосфатидилэтаноламина.
Второй путь – на основе синтезируемой in situ фосфатидной кислоты.
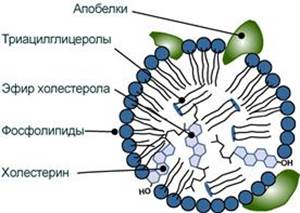
--- 22. Транспорт липидов в крови. Структура, образование и метаболизм хиломикронов. Роль липопротеинлипазы в обмене хиломикронов и других липопротеинов Поскольку липиды являются в основе своей гидрофобными молекулами, то они транспортируются в водной фазе крови в составе особых частиц – липопротеинов. Структуру транспортных липопротеинов можно сравнить с орехом, у которых имеется скорлупа и ядро. "Скорлупа" липопротеина является гидрофильной, ядро – гидрофобное. поверхностный гидрофильный слой формируют фосфолипиды (их полярная часть), холестерол (его ОН-группа), белки. Гидрофильность липидов поверхностного слоя призвана обеспечить растворимость липопротеиновой частицы в плазме крови, "ядро" формируют неполярные эфиры холестерола (ХС) и триацилглицеролы (ТАГ), которые и являются транспортируемыми жирами. Их соотношение колеблется в разных типах липопротеинов. Также к центру обращены жирнокислотные остатки фосфолипидов и циклическая часть холестерола.
Выделяют четыре основных класса липопротеинов: - липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП), - липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП), - липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП), - хиломикроны (ХМ). Свойства и функции липопротеинов разных классов зависят от их состава, т.е. от вида присутствующих белков и от соотношения триацилглицеролов, холестерола и его эфиров, фосфолипидов.
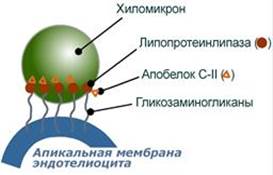
Функция Транспорт экзогенных ТАГ из кишечника в ткани, запасающие или использующие жирные кислоты, в основном в жировую ткань, миокард, скелетные мышцы и лактирующую молочную железу, в меньшей степени в легкие, костный мозг, почки, селезенку. На эндотелии капилляров этих тканей имеется фермент липопротеинлипаза.
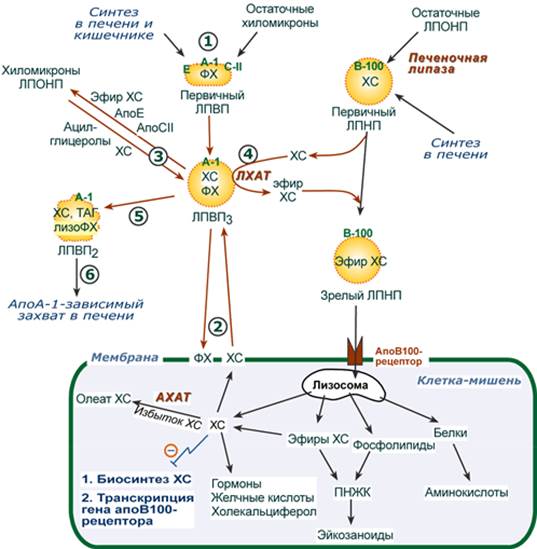
Метаболизм хиломикронов 1. После ресинтеза жиров в эпителиоцитах кишечника формируются первичные хиломикроны, имеющие только апоВ-48. 2. Из-за большого размера они не проникают напрямую в кровеносное русло и эвакуируются через лимфатическую систему, попадая в кровь через грудной лимфатический проток. 3. В крови хиломикроны взаимодействуют с ЛПВП и приобретают от них апоС-II и апоЕ, образуя зрелые формы. Белок апоС-II является активатором фермента липопротеинлипазы, белок апоЕ понадобится для удаления из крови остаточных хиломикронов. 4. На эндотелии капилляров вышеперечисленных тканей находится фермент липопротеинлипаза (ЛПЛ), отщепляющая жирные кислоты от ТАГ в положении 1 и 3, в результате накапливаются моно- и диацилглицеролы. 5. Находясь в плазме крови, хиломикроны также взаимодействуют с ЛПВП, отдавая им часть своих МАГ и ДАГ и получая взамен эфиры ХС. 6. После взаимодействия хиломикрона с липопротеинлипазой полученные свободные жирные кислоты проникают в клетки органа, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани. Липопротеинлипаза способна удалить до 90% всех ТАГ, находящихся в хиломикроне. 7. Остаточные (ремнантные) хиломикроны, сохранившие в своем составе МАГ и ДАГ, попадают в гепатоциты посредством апоЕ-рецепторного эндоцитоза и разрушаются до составных частей. 8. Часть фосфолипидной оболочки ремнантных хиломикронов, содержащая апоС-II и апоЕ, способна "отрываться" от основной частицы и формировать первичные ЛПВП. --- 23. Транспорт липидов в крови. Структура, образование и метаболизм ЛПОНП, ЛППП и ЛПНП. Роль липопротеинлипазы, печеночной липазы и рецепторов клеточной поверхности. Общая характеристика Липопротеины очень низкой плотности: - синтезируются в печени из эндогенных и экзогенных липидов, - в их составе преобладают ТАГ, около 40% от массы составляют белок, фосфолипиды и холестерол (8% белка, 60% ТАГ, 6% ХС, 12% эфиров ХС, 14% фосфолипидов), - основным белком является апоВ-100, выполняющий структурную функцию, - в норме концентрация 1,3-2,0 г/л, - слабо атерогенны. Функция Транспорт эндогенных и экзогенных ТАГ от печени в ткани, запасающие и использующие жирные кислоты, т.е. в те же ткани, что и хиломикроны. Метаболизм 1. Первичные ЛПОНП образуются в печени и содержат только апоВ-100. Липидный компонент синтезируется: - из пищевых липидов, МАГ и ДАГ, пришедших в гепатоциты с остаточными хиломикронами, - из липидов, синтезируемых из глюкозы. 2. В крови первичные ЛПОНП взаимодействуют с ЛПВП и приобретают от них апоС-II и апоЕ, образуя зрелые формы. 3. Аналогично хиломикронам, на эндотелии капилляров ряда тканей зрелые ЛПОНП подвергаются воздействию липопротеинлипазы с образованием свободных жирных кислот. Жирные кислоты перемещаются в клетки органа, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани. 4. При действии липопротеинлипазы в составе ЛПОНП снижается количество ТАГ и нарастает доля МАГ и ДАГ. Зрелый ЛПОНП превращается в остаточный (ремнантный) ЛПОНП. 5. Находясь в плазме крови, ЛПОНП взаимодействуют с ЛПВП, отдавая им часть своих МАГ и ДАГ и получая взамен эфиры ХС. 6. Остаточные ЛПОНП (также называемые липопротеины промежуточной плотности, ЛППП) в соотношении примерно 50 на 50: - либо попадают в гепатоциты посредством эндоцитоза, связанного со смешанным рецептором к апоЕ и апоВ-100-белкам, - либо после воздействия на них печеночной липазы, находящейся в синусоидах печени, превращаются в следующий класс липопротеинов – липопротеины низкой плотности (ЛПНП). --- Функция Транспорт свободного ХС от тканей к печени. Фосфолипиды ЛПВП являются источником полиеновых кислот для синтеза клеточных фосфолипидов и эйкозаноидов. Метаболизм 1. Синтезированный в печени ЛПВП (насцентный или первичный) содержит в основном фосфолипиды и апобелки. Остальные липидные компоненты накапливаются в нем по мере метаболизма в плазме крови. 2-3. В плазме крови насцентный ЛПВП сначала превращается в ЛПВП3 (условно его можно назвать "зрелый"). В этом превращении главным является то, что ЛПВП забирает от клеточных мембран свободный холестерин при непосредственном контакте или при участии специфических транспортных белков, взаимодействуя с мембранами клеток, отдает им часть фосфолипидов из своей оболочки, доставляя таким образом полиеновые жирные кислоты в клетки, тесно взаимодействует с ЛПНП и ЛПОНП, получая от них свободный холестерин. В обмен ЛПВП3 отдают эфиры ХС, образованные благодаря переносу жирной кислоты от фосфатидилхолина (ФХ) на холестерин (ЛХАТ-реакция, см п.4). 4. Внутри ЛПВП активно протекает реакция при участии лецитин:холестерол-ацилтрансферазы (ЛХАТ-реакция). В этой реакции остаток полиненасыщенной жирной кислоты переносится от фосфатидилхолина (из оболочки самого ЛПВП) на получаемый свободный холестерин с образованием лизофосфатидилхолина (лизоФХ) и эфиров ХС. ЛизоФХ остается внутри ЛПВП, эфир холестерина отправляется в ЛПНП.
5. В результате первичный ЛПВП постепенно, через зрелую форму ЛПВП3, преобразуется в ЛПВП2 (остаточный, ремнантный). При этом происходят и дополнительные события: взаимодействуя с разными формами ЛПОНП и ХМ, ЛПВП получают ацил-глицеролы (МАГ, ДАГ, ТАГ), и обмениваются холестерином и его эфирами, ЛПВП отдают апоЕ- и апоСII-белки на первичные формы ЛПОНП и ХМ, и потом забирают обратно апоСII-белки от остаточных форм. Таким образом, при метаболизме ЛПВП в нем происходит накопление свободного ХС, МАГ, ДАГ, ТАГ, лизоФХ и утрата фосфолипидной оболочки. Функциональные способности ЛПВП снижаются. 6. Далее ЛПВП2 захватывается гепатоцитами при помощи апоА-1-рецептора, происходит эндоцитоз и частица разрушается.
--- Пример. Окисление пальмитиновой кислоты Так как имеется 16 атомов углерода, то при β-окислении образуется 8 молекул ацетил-SКоА. Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН (7,5 АТФ), 1 молекула ФАДН2 (1,5 АТФ) и 1 молекула ГТФ, что эквивалентно 10 молекулам АТФ. Итак, 8 молекул ацетил-SКоА обеспечат образование 8×10=80 молекул АТФ. Для пальмитиновой кислоты число циклов β-окисления равно 7. В каждом цикле образуется 1 молекула ФАДН2 (1,5 АТФ) и 1 молекула НАДН (2,5 АТФ). Поступая в дыхательную цепь, в сумме они "дадут" 4 молекулы АТФ. Таким образом, в 7 циклах образуется 7×4=28 молекул АТФ. Двойных связей в пальмитиновой кислоте нет. На активацию жирной кислоты идет 1 молекула АТФ, которая, однако, гидролизуется до АМФ, то есть тратятся 2 макроэргические связи или две АТФ. Таким образом, суммируя, получаем 80+28-2 =106 молекул АТФ образуется при окислении пальмитиновой кислоты. --- Катаболизм жирных кислот в клетках. Особенности окисления ненасыщенных жирных кислот, с нечетным числом углеродных атомов, с разветвленным радикалом, с большим числом углеродных атомов. a- и w -Окисление (?)
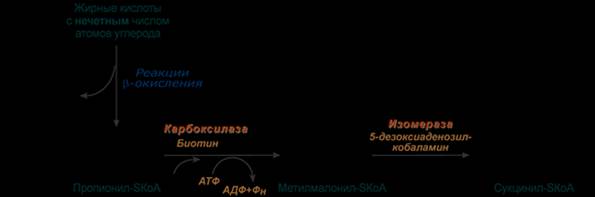
Жирные кислоты с нечетным числом углеродов поступают в организм с растительной пищей и морепродуктами. Их окисление происходит по обычному пути до последней реакции, в которой образуется пропионил-SКоА. Суть превращений пропионил-SКоА сводится к его карбоксилированию, изомеризации и образованию сукцинил-SКоА. В этих реакциях участвуют биотин (витамин H) и 5-дезоксиаденозилкобаламин (витамин В12).
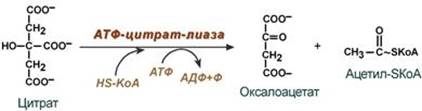
--- 29. Биосинтез жирных кислот. Происхождение субстратов. Полиферментный комплекс, синтезирующий жирные кислоты в эукариотической клетке. Значение биотина, НАДФН.Н+. Активаторы и ингибиторы синтеза жирных кислот Биосинтез жирных кислот наиболее активно происходит в цитозоле клеток печени, кишечника, жировой ткани в состоянии покоя или после еды. Условно можно выделить 4 этапа биосинтеза: 1. Образование ацетил-SКоА из глюкозы, других моносахаров или кетогенных аминокислот. 2. Перенос ацетил-SКоА из митохондрий в цитозоль: - может быть в комплексе с карнитином, подобно тому как переносятся внутрь митохондрии высшие жирные кислоты, но здесь транспорт идет в другом направлении, обычно в составе лимонной кислоты, образующейся в первой реакции ЦТК. Поступающий из митохондрий цитрат в цитозоле расщепляется АТФ-цитрат-лиазой до оксалоацетата и ацетил-SКоА.
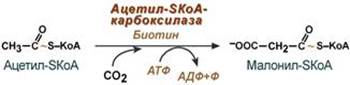
Оксалоацетат в дальнейшем восстанавливается до малата, и последний либо переходит в митохондрии (малат-аспартатный челнок), либо декарбоксилируется в пируват малик-ферментом ("яблочный" фермент). 3. Образование малонил-SКоА из ацетил-SКоА. Карбоксилирование ацетил-SКоА катализируется ацетил-SКоА-карбоксилазой, мульферментным комплексом из трех ферментов.
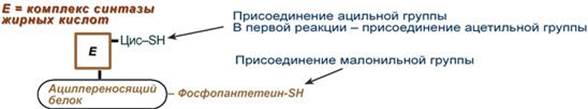
4. Синтез пальмитиновой кислоты. Осуществляется мультиферментным комплексом "синтаза жирных кислот" (синоним пальмитатсинтаза) в состав которого входит 6 ферментов и ацил-переносящий белок (АПБ). Ацил-переносящий белок включает производное пантотеновой кислоты – 6-фосфопантетеин (ФП), имеющий HS-группу, подобно HS-КоА. Один их ферментов комплекса, 3-кетоацил-синтаза, также имеет HS-группу в составе цистеина. Взаимодействие этих групп обусловливает начало и продолжение биосинтеза жирной кислоты, а именно пальмитиновой кислоты. Для реакций синтеза необходим НАДФ.
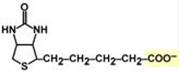
В первых двух трансферазных реакциях последовательно присоединяются малонил-SКоА к фосфопантетеину ацил-переносящего белка и ацетил-SКоА к цистеину 3-кетоацилсинтазы. 3-Кетоацилсинтаза катализирует третью реакцию – перенос ацетильной группы на С2 малонила с отщеплением карбоксильной группы в виде CO2. Далее 3-кетогруппа в реакциях восстановления (3-кетоацил-редуктаза), дегидратации (дегидратаза) и опять восстановления (еноил-редуктаза) превращается в метиленовую с образованием насыщенного ацила, связанного с фосфопантетеином. Ацилтрансфераза переносит полученный ацил на цистеин 3-кетоацил-синтазы, к фосфопантетеину АПБ присоединяется малонил-SКоА и цикл повторяется 7 раз. В первом цикле синтеза получается 4-углеродная (масляная) кислота, во втором - 6-углеродная (капроновая), и так далее до образования остатка пальмитиновой кислоты C16. После этого пальмитиновая кислота отщепляется шестым ферментом комплекса тиоэстеразой. Строение биотина
Биохимические функции Биотин участвует в переносе СО2 либо из НСО3– (реакции карбоксилирования), либо от R-СООН (реакция транскарбоксилирования). Такая реакция необходима: - при синтезе оксалоацетата – биотин находится в составе пируваткарбоксилазы, что обеспечивает поддержание активности цикла трикарбоновых кислот и глюконеогенеза,
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 652; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.149.242 (0.145 с.) |