
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбция окислителей на металлах
Первой стадией взаимодействия металла с коррозионной средой является адсорбция окислительного компонента среды (О2, CO2, SO2, Сl2, Br2, I2, пары воды) на поверхности металла. В среднем на 1 см2 чистой металлической поверхности приходится около 1015 атомов, на которых может адсорбироваться газ или другой окислитель. Различают два типа адсорбции. Физическая адсорбция, осуществляемая за счет ван-дер-ваальсовых сил. Физическая адсорбция протекает без заметной энергии активации и почти мгновенно, как только молекулы газа ударяются о поверхность. Энергия процесса физической адсорбции до (20 - 25) кДж/моль. Химическая или хемосорбция, осуществляется за счет сил химического взаимодействия. Хемосорбция называется активированной адсорбцией. При ней реакция протекает медленнее, т.к. связана с энергией активации, которая зависит от кристаллографической ориентации дефектов на поверхности металла и происходит только до тех пор, пока на поверхности не образуется мономолекулярный слой адсорбата. Взаимодействие адсорбированных атомов с поверхностью металла, приводит к перегруппировке атомов в поверхностном слое металла и их ионизации. Адсорбированные атомы или ионы кислорода образуют поверхностные кислородные структуры, т.е. упорядоченное расположение ионов или атомов кислорода, отражающие симметрию металлической подложки и зависящие от ее кристаллографической ориентации. Атомы или ионы расположены не хаотично, а образуют двухмерную кристаллическую решетку. Хемосорбцию атомов кислорода на поверхности металла можно представить следующим образом: Me(ТВ) + О2 (ГАЗ) = Me(ТВ)2ОАДС. Связь, возникающая между кислородом и поверхностными атомами металла, чисто ионная: металл отдает атому кислорода два электрона. Возникающая при этом связь отличается от связи кислорода с металлом в оксиде. Она значительно сильнее, за счет энергии поляризации.
Образование пленки продуктов коррозии
Дальнейший рост окисной пленки идет за счет образования зародышей. Дислокации, поверхностные дефекты, примеси служат местами образования зародышей, где двухмерная структура адсорбированного кислорода переходит в объёмную, трехмерную плёнку с правильным чередованием атомов металла и кислорода. После образования хаотично размещающихся зародышей окисла, окисление идет путем роста отдельных кристаллитов до тех пор, пока поверхность полностью не покроется окислом.
При наличии химического сродства между металлом и окислителем хемосорбированная пленка быстро переходит в состояние оксидной пленки в результате протекания химической реакции
и перестройки атомов металла и кислорода, соответствующей их пространственному распределению в оксиде. Получающийся оксид образует на поверхности корродирующего металла пленку. Толщина пленок продуктов коррозии на металлах изменяется в широком интервале. Пленки по толщине подразделяют на три группы: 1) тонкие (невидимые), толщина которых от нескольких ангстрем до 400 ангстрем; 2) средние (дают различные цвета), толщина которых от 400 до 5000 ангстрем; 3) толстые (видимые), толщина которых свыше 5000 ангстрем и достигает во многих случаях значительной величины (например, окалина на стали). При изучении газовой коррозии необходимо определять характер изменения толщины пленки во времени, а также изменение структуры образующейся пленки. Для определения толщины, структуры и свойств оксидных пленок используют различные современные методы: интерференционные, электронографию, рентгенографию и др. Некоторые примеры условий образования различных по толщине пленок указаны в табл. 2.1. Таблица 2.1 Условия образования пленок на железе и алюминии
Таблица 2.2 Толщина и цвет окисных пленок на железе и меди
Оксидные пленки могут быть сплошными или несплошными. Пиллинг и Бедвортс сформулировали условие, при котором образуются сплошные пленки, способные препятствовать дальнейшему окислению металла: молекулярный объем соединения, возникшего из металла и окислителя, Vок должен быть больше объема металла VMе, израсходованного на образование молекулы соединения. В противном случае образующегося соединения не хватает, чтобы покрыть сплошным слоем весь металл, в результате чего пленка продукта коррозии металла получается пористой и рыхлой. Таким образом, если Vок/VMе < 1, то пленка не может быть сплошной, если Vок/VMе > 1, то пленка может быть сплошной. Отношение объемов соединений металла с окислителем и металла можно рассчитать по формуле
где Mок – молекулярная масса продукта коррозии (окисла); АМе – атомная масса металла; ρок – плотность продукта коррозии (окисла); ρМе – плотность металла, m – число атомов металла в продукте коррозии. Отношения Vок/VMе для некоторых металлов приводятся в табл. 2.3.
Таблица 2.3 Значения объемов оксидов и металлов
Защитные свойства пленки определяются рядом факторов, из которых сплошность является необходимым, но недостаточным условием. В реальных условиях роста пленки в ней могут возникнуть такие внутренние напряжения, которые начнут разрушать ее, частично или полностью нарушая ее сплошность, и тем самым значительно уменьшают или полностью устраняют ее защитные свойства. Это наблюдается при Vок/VMе > 2.5. Достаточно хорошими защитными свойствами могут обладать лишь пленки на металлах, удовлетворяющие условию 2,5 > Vок/VMе > 1. (2.6) При окислении легких металлов объем оксидного слоя меньше объема израсходованного на его образование металла. Оксидное покрытие обычно пористое и не обладает защитными свойствами. При коррозии тяжелых металлов объем образующегося соединения (оксида) больше объема израсходованного металла. И хотя при этом наблюдается тенденция к образованию тонкого покрытия, при слишком большом различии в объемах (>2,5) в системе возникают сжимающие напряжения, приводящие к расслаиванию или другим механическим повреждениям защитного слоя.
Кинетика газовой коррозии
Термодинамические расчеты не позволяют оценить скорость коррозии металла. Рассмотрением этого вопроса, а также различных факторов, влияющих на скорость коррозии и характер коррозионного разрушения металлов, занимается кинетика коррозионных процессов. Скорость газовой коррозии vгаз, обычно принято выражать через скорость роста толщины оксидной пленки:
где h – толщина пленки; t – время коррозии.
Скорость коррозии в этом случае будет в соответствии с уравнением определяться уравнением:
где kp – константа скорости реакции; СМе – равна 1; СО – концентрация кислорода у поверхности металла. Так как СМе =1 уравнение (2.8) имеет вид:
Далее разделяем переменные и интегрируем:
Величины k р и СО – постоянные, и их выносят за знак интеграла. После интегрирования получаем:
Произведение k р СО обозначим через k 1. Тогда из (2.11) следует:
Из уравнения (2.12) следует, что толщина тонкой рыхлой пленки с течением временем увеличивается линейно. Если пленка сплошная (рисунок 2.1 б), то она оказывает торможение проникновению кислорода к металлу и скорость коррозии описывается уравнением:
Принимая площадь сечения, через которое идет диффузия, равным единице и выражая градиент концентрации через (С0 – С0)/x, где C0 – концентрация кислорода в объеме, С0 – концентрация кислорода у поверхности металла, получаем:
Если диффузия является лимитирующим фактором, то весь кислород, достигший поверхности металла, успевает вступить в реакцию, и тогда С0 → 0. В этом случае имеют место предельные условия диффузии:
Для вычисления толщины пленки x это уравнение нужно проинтегрировать. Разделяя переменные, получим:
После интегрирования получаем:
Обозначив 2· K д ·СО через k 2, записываем уравнение (2.17) в виде h 2 = k 2 · t. (2.18) Из уравнения (2.18) видно, что рост сплошной оксидной пленки происходит по параболическому закону. Если же скорость коррозии лимитируется и кинетикой, и диффузией (СО ≠ 0), что часто наблюдается в начальный период коррозии, то для стационарной скорости газовой коррозии можно получить уравнение:
Уравнение (2.19) учитывает влияние на скорость окисления металла химической реакции и диффузии. Если пленка очень тонкая (h → 0), то первый член уравнения (2.19) значительно меньше второго. Пренебрегая первым членом, получим:
т.е. получается линейный закон роста пленки. Если толщина пленки велика, то можно пренебречь вторым членом по сравнению с первым, в этом случае получаем:
т.е. получается параболический закон роста пленки. Часто рост пленки протекает медленнее, чем это следует из параболического закона. Затухание процесса коррозии в таких случаях объясняется либо уплотнением пленок, либо появлением различных дефектов или расслоений, что тормозит диффузию. В этих случаях рост пленки протекает в соответствии с логарифмическим законом h = ln (k 3 · t), (2.22) где k 3 некоторая константа. Для тонких пленок при низких температурах применяется логарифмическая или обратно-логарифмическая зависимости: h = k4 lg(at+b) ; 1/h = k5 – k6 lgt (2.23)
hn = k 7 t, n >2, (2.24) где k 4 k 5 k 6 k 7 некоторые константы независящие от времени.
Различные металлы в различных температурных интервалах окисляются по-разному. Линейный закон окисления характерен для натрия, кальция, магния, вольфрам; параболический – для меди, железа, никеля; логарифмический – для алюминия и цинка в интервале 25-225ºC, никеля до 650 ºC, железа до 375 ºC, меди до 100 ºC и т.д.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.122.162 (0.034 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
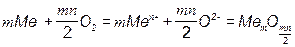
 (2.5)
(2.5)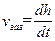 , (2.7)
, (2.7)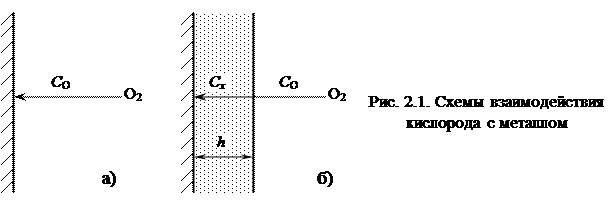 Возможны два случая окисления металла. Если на поверхности металла отсутствует оксидная пленка или она очень тонкая или пористая (несплошная Vок/Vмет < 1), то процесс коррозии контролируется реакцией взаимодействия металла с кислородом и рост пленки протекает при кинетическом контроле (рисунок 2.1 a).
Возможны два случая окисления металла. Если на поверхности металла отсутствует оксидная пленка или она очень тонкая или пористая (несплошная Vок/Vмет < 1), то процесс коррозии контролируется реакцией взаимодействия металла с кислородом и рост пленки протекает при кинетическом контроле (рисунок 2.1 a). , (2.8)
, (2.8) . (2.9)
. (2.9)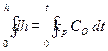 . (2.10)
. (2.10)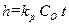 . (2.11)
. (2.11)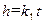 . (2.12)
. (2.12)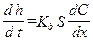 . (2.13)
. (2.13)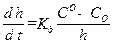 . (2.14)
. (2.14) . (2.15)
. (2.15)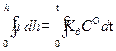 . (2.16)
. (2.16)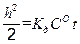 или
или 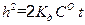 (2.17)
(2.17) . (2.19)
. (2.19) , (2.20)
, (2.20) , (2.21)
, (2.21) На рис. 2.2. представлены зависимости для линейного, параболического и логарифмического законов окисления.
На рис. 2.2. представлены зависимости для линейного, параболического и логарифмического законов окисления.


