
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Описание установки и вывод расчетной формулы⇐ ПредыдущаяСтр 15 из 15
В работе осуществляется три состояния газа: 1. При помощи насоса нагнетается газ в систему до возможно большего избыточного давления P 1, по сравнению с атмосферным давлением P 0. 2. На короткое время открывается пробка, и газ начинает выходить из баллона. Если избыточное давление достаточно велико, а время открытия баллона мало, то скорость истечения газа из системы будет высока. Таким образом, процесс расширения избыточного газа от начального объема V1 до конечного объема V2 можно считать адиабатическим. При этом расширении газ остывает. 3. Система изолируется от атмосферы, и через некоторое время её температура становится комнатной. Таким образом, переход от состояния 1 до состояния 2 проходит по адиабате. При этом изменяется число молей газа в системе и температура газа. Переход от состояния 2 до состояния 3 происходит при постоянном объёме V2 (концентрация молей) газа в системе, т. е. по изохоре.
Начальное состояние и конечное состояние соответствуют одной и той же комнатной температуре, т. е. переход из состояния 1 в состояние 3 происходит по изотерме. Отметим, что все газовые законы формулируются для постоянного количества молей Непосредственно из основного уравнения Рассмотрим закон Пуассона
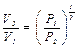 или или 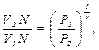
где N – число молекул газа. Для концентраций n получаем:
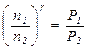
Сравнивая состояния 1 и 2 по уравнению адиабаты, получаем:
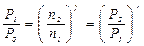
или
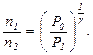
Если измерять давление высотой водяного столба, то атмосферному давлению P 0 соответствует высота H = 10 м. Давлению P 1 высота H + h 1 и давлению P 1 высота H + h 2. При этом h 1 > h 2 и избыточное давление h 1 << H. Тогда получаем:
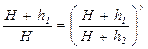
или
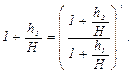
После логарифмирования выражение может быть записано, как:
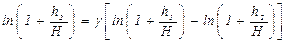
У нас
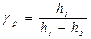 . .
Формула (2.41) является расчётной.
Порядок выполнения работы 1. При закрытой пробке баллона насосом медленно подкачать воздух в систему до возможной большей разности высот в трубках манометра. 2. После того, как колебание жидкости в манометре прекратится, и разность уровней стабилизируется во времени (это означает, что температура газа установилась)отметить значение разности высот 3. На очень короткое время откупорить пробку баллона, затем быстро закрыть. 4. Дождаться прекращения колебания жидкости в трубках манометра и, когда разность уровней примет максимальное положение, измерить разность высот жидкости 5. Измерение повторить 7 раз и результаты занести в табл. 2.3.
6. Вычислить
7. Вычислить среднее значение
Сравнить с теоретическим значением Контрольные вопросы 1. Как вывести уравнение адиабаты в параметрах 2. Какие процессы рассматриваются в работе? 3. Почему для любого газа 4. Что такое число степеней свободы молекулы? 5. Почему избыточное давление
Список литературы 1. Бондарев В. В. Курс общей физики. — Т. 1 / В. В. Бондарев, Н. П. Калашников, Г. Г. Спирин. — М.: Высш. шк., 2003.
2. Савельев И. В. Курс физики. — Т. 1 И. В. Савельев. — М.: Высш. шк., 1998. 3. Трофимова Т. И. Курс физики / Т. И. Трофимова. — М.: Высш. шк., 2001. 4. Физический практикум / Под ред. В. И. Ивероновой. — М.: Наука, 1968. 5. Матвеев А.Н. Молекулярная физика. – М.: Высшая школа, 1987. 6. Кухлинг Х. Справочник по физике. – М.: Мир, 1982.
Горбунов Николай Аркадьевич,канд. физ.-мат. наук, доцент Пашин Анатолий Борисович,канд. физ.-мат. наук, доцент Сурба Регина Эдуардовна, ст. преподаватель
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 218; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.12.240 (0.01 с.) |
 Лабораторная установка изображена на рисунке. Она состоит из насоса (Z), баллона с воздухом (А), стакана частично заполненного водой (В) и дифференциального манометра (С). Насос, баллон, стакан и один конец U-образной трубки манометра соединены гибким шлангом. Второй конец U-образной трубки манометра открыт в атмосферу.
Лабораторная установка изображена на рисунке. Она состоит из насоса (Z), баллона с воздухом (А), стакана частично заполненного водой (В) и дифференциального манометра (С). Насос, баллон, стакан и один конец U-образной трубки манометра соединены гибким шлангом. Второй конец U-образной трубки манометра открыт в атмосферу.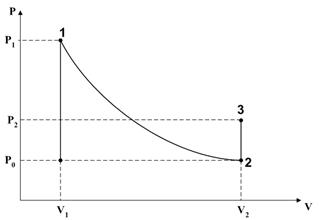
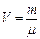 . При реализации адиабатического процесса газ вытекает из системы. По этой причине переформулируем газовые законы, так чтобы вместо объёма V стояла бы концентрация молекул n.
. При реализации адиабатического процесса газ вытекает из системы. По этой причине переформулируем газовые законы, так чтобы вместо объёма V стояла бы концентрация молекул n.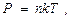 при
при 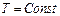 получаем такую формулировку закона Бойля-Мариота
получаем такую формулировку закона Бойля-Мариота 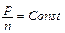 .
.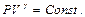 Отсюда сразу получаем для двух состояний
Отсюда сразу получаем для двух состояний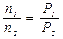 .
.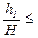 10-4, при малых x выполнено равенство
10-4, при малых x выполнено равенство 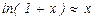 . Поэтому
. Поэтому 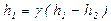 и
и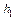 .
.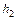 .
. по формуле:
по формуле: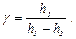
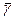 и по методу Стьюдента найти погрешность
и по методу Стьюдента найти погрешность 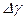 . Затем найденные значения
. Затем найденные значения 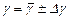 .
.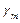 для воздуха.
для воздуха.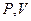 ?
?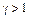 ?
?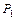 должно быть, по возможности, большим?
должно быть, по возможности, большим?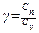 ......
Список литературы...................................
......
Список литературы...................................



