
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные сведения о строении атомов. Состав атомных ядер. Изотопы и изобары.Стр 1 из 19Следующая ⇒
Введение. Химия относится к числу естественных наук, изучающих окружающий нас мир со всем богатством его форм и многообразием происходящих в нем явлений. В отличие от других наук химия изучает состав, строение и свойства веществ, зависимость свойств от состава и строения, а так же превращение одних веществ в другие и сопровождающие эти превращения явления. Современная химия тесно связана как с др. науками, так и со всеми отраслями народного хозяйства. Соприкосновение химии с др. науками порождает специфические области взаимного их проникновения. Так, области перехода между химией и физикой представлены физической химией и химической физикой. Между химией и биологией, химией и геологией возникли особые пограничные области – геохимия, биохимия, биогеохимия, молекулярная биология. Важнейшие законы химии формулируются на математическом языке, и теоретическая химия не может развиваться без математики. Рассматриваемая дисциплина призвана дать студентам современное научное представление о веществе как одном из видов движущейся материи, о путях, механизмах и способах превращения одних веществ в другие. Знание основных химических законов, владение техникой химических расчетов, понимание возможностей, предоставляемых химией, значительно ускоряют получение нужного результата в различных сферах инженерной и научной деятельности. Умение грамотно организовать производство и предвидеть последствия его воздействия на природу позволяют миниминизировать вредное воздействие на окружающую нас среду.
Тема 1. Основные понятия и законы химии Основные понятия Таким образом, можно сказать, что химия изучает материю, ее движение в целом и движение, присущее каждой ее частице. Вещество и поле – две формы существования материи. Вещество – форма материи, которая обладает собственной массой, т.е. массой покоя. Оно состоит из элементарных частиц: электронов, протонов, нейтронов, мезонов и др. Поле – форма существования материи, которая тесно связана с энергией. Химия изучает главным образом вещество, организованное в атомы, молекулы, ионы и радикалы. Можно сказать, что эти частицы являются производными различных химических элементов. Химический элемент – это совокупность атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек. Так, например, можем найти в таблице Менделеева следующие химические элементы: 6С (углерод с зарядом ядра +6), 7N (азот с зарядом ядра +7), 8О (кислород с зарядом ядра +8) и др. Как мы видим, атомы различных химических элементов имеют различный заряд ядра. В настоящее время известно 110 (см. таблицу Д.И. Менделеева) элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем.
Атом – мельчайшая (химически неделимая) частица химического элемента, сохраняющая все его химические свойства. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем. Атомное ядро – центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атомов. Заряд ядра – положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A = Z + N (или относительной атомной массой). Атомы, как и любые другие частицы, имеют массу. Но масса атома ничтожно мала. Например, масса атома водорода Н равна 1,67∙10–24 г. Использовать в расчетах такое маленькое число очень неудобно. Поэтому в химии пользуются не реальными массами атомов, измеренными в граммах, а их относительными атомными массами – массами, измеренными относительно массы эталона. За эталон была взята масса 1/12 части атома элемента углерода 12С, равная 1,67∙10–24 г. Число, показывающее во сколько раз реальная масса атома (в граммах) больше массы 1/12 части атома элемента углерода 12С, называется относительной атомной массой (Ar).
Например, относительная атомная масса кислорода вычисляется следующим образом:
Таким образом, относительная атомная масса Ar – это просто число, то есть безразмерная величина. В качестве размерности зачастую указывают [а.е.м.] – атомных единиц массы. Относительные атомные массы записаны в ячейках химических элементов в периодической таблице Д. И. Менделеева. Например, Ar(Fe)=55,847. Для расчетов обычно использую округленные до целых чисел значения Ar, кроме Ar хлора. Его относительная атомная масса принята округленно за 35,5.
При необходимости можно определить абсолютную массу атома данного элемента, умножив относительную атомную массу на абсолютное значение атомной единицы массы: Ar (Mg) = 24,312 а.е.м. m (Mg) = 24,312∙1,67∙10–24 = 4,037∙10–24 г Атомы вступают в химические реакции и складываются в молекулы. Молекулой называется наименьшая частица вещества, которая может существовать самостоятельно, обладает химическими свойствами данного вещества и состоит из атомов одного или нескольких химических элементов. Между молекулами имеются промежутки: у газов – самые большие, у твердых веществ – самые маленькие. Молекулы двигаются беспорядочно и непрерывно. Молекулы одного вещества имеют одинаковый состав и свойства, молекулы разных веществ отличаются друг от. друга по составу и свойствам. В химических реакциях одни молекулы разрушаются и образуются другие. Химическая формула – это условная запись состава вещества с помощью химических знаков и индексов (индекс – цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле). Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле. Например, в состав молекулы H2SO4 входят два атома водорода, один атом серы и четыре атома кислорода. Как и атом, молекула имеет массу, которая также ничтожно мала. Относительная молекулярная масса (Mr) – безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов. Так, например, Mr (B2O3) = 2∙Ar(B) + 3∙Ar(O) = 2∙11 + 3∙16 = 70 а.е.м.; Mr (KAl(SO4)2) = 1∙Ar(K) + 1∙Ar(Al) + 2∙(Ar(S) + 4∙Ar(O)) = 39 + 27 + 2∙(32 + 4∙16) = 258 а.е.м. Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на значение 1 а.е.м. То есть, m (B2O3) = 70∙1,67∙10–24 = 116,9∙10–24 г Молекулы, состоящие из атомов одного химического элемента, образуют простые вещества (Cu, H2, O3…). Поэтому можно сказать, что простые вещества являются формой существования химического элемента в свободном состоянии. Аллотропия – явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам (аллотропных модификаций). Явление аллотропии обусловлено в одних случаях тем, что молекулы разных аллотропных модификаций состоят из различного количества атомов (например, белый фосфор состоит из молекул Р4, а красный имеет полимерную структуру), а в других – тем, что их кристаллы имеют различное строение (алмаз и графит – аллотропные модификации одного химического элемента – углерода).
Сложные вещества образованы атомами различных элементов и могут иметь состав, постоянный или меняющийся в разных пределах (Н20, Na2S04, FeCl3...). Так как размеры и масса атомов и молекул ничтожно малы, то количество атомов и молекул в обычных образцах веществ очень велико. Поэтому при характеристике количества вещества в химии используют специальную единицу измерения – моль. Количество вещества – число структур единиц в системе. Единицей количества вещества является моль. Моль – это количество вещества системы, содержащее столько структурных единиц данного вещества (молекул, атомов, электронов, ионов и т. д.), сколько атомов содержится в 12 г изотопа углерода 12C. То есть, количество частиц в 1 моль любого вещества одно и то же и равно 6,02∙1023. Это число называют постоянной Авогадро (N А = 6,02∙1023 моль-1). Понятие «моль» сродни такому понятию, как «десяток». Говорят – десяток яиц, десяток яблок и т.д., а в химии – моль молекул, моль атомов и т.п. Масса одного моль вещества, то есть 6,02∙1023 частиц, называется молярной массой (М). Численно она равна относительной атомной массе атомной для атома, и относительной молекулярной – для молекулы. Но здесь она имеет другой смысл и другую размерность: кг/моль или г/моль. Например, М (О) = 16 г/моль, М (B2O3) = 70 г/моль. Количество моль (количество вещества) можно найти по отношению массы всего вещества к его молярной массе:
Так, например, в 6,4 г серы содержится 6,4/32 = 0,2 моль атомов серы. Количество моль можно рассчитать и по отношению общего количества частиц к количеству, частиц, содержащихся в одном моле (к постоянной Авогадро):
Для газов справедливым будет соотношение:
В химических реакциях элементы всегда соединяются друг с другом в строго установленных соотношениях. Поэтому вводят такое понятие, как эквивалент. Термин эквивалент в химии означает равнозначное, равноценное количество. Это значит, что число эквивалентов данного вещества всегда реагирует с точно таким же количеством эквивалентов другого вещества. В качестве эталона используют эквивалент водорода, равный одному молю.
Эквивалентом (Э) называют то количество вещества, которая может замещать, присоединять или обмениваться на один моль атомов водорода (или ½ моль атомов кислорода) в ионно-обменных реакциях или соответствует одному молю электрону в окислительно-восстановительных реакциях. Эквиваленты обычно находят по данным анализа соединений, или на основании результатов протекания химических реакций. Эквивалент измеряется в молях. Так в соединениях HBr, H2Te, AsH3 эквиваленты элементов равны соответственно Э (Br) =1моль, Э (Te) =1/2 моля, Э (As) =1/3 моля. Это следует из того, что с одним атомом водорода, эквивалент которого равен одному молю, соединяется соответственно один, два и три атома элемента. Для математических расчетов вводят понятие фактора эквивалентности (f э), значение которого численно совпадает со значением эквивалента. Но в отличие от последнего фактор эквивалентности является величиной безразмерной. Рассмотрим формулы, по которым определяется значение фактора эквивалентности соединений различных классов: 1. для элемента f э = 1/В (валентность), fэ (Са) = 1/2; 2. для кислоты f э = 1/О (основность, равная количеству атомов водорода), fэ (H2SO4) = 1/2; 3. для основании f э = 1/ K (кислотность, равная количеству гидроксогрупп), fэ (Сr(OH)3) = 1/3; 4. для оксида f э = 1/ n ∙ В (n – количество атомов элемента, В – его валентность), fэ (СuO) = 1/1∙2 = 1/2, fэ (Na2O) = 1/2∙1 = 1/2, fэ (Al2O3) = 1/2∙3 = 1/6; 5. для соли f э = 1/ n ∙ В (n – количество атомов металла, В – его валентность), fэ (AlPO4) = 1/1∙3 = 1/3; 6. для иона f э = 1/ | заряд |, fэ (SO42-) = 1/2, fэ (Ti4+) = 1/4. Масса одного эквивалента называется (М( fэ элемента) или Мэ). Для любого соединения она рассчитывается по формуле: Мэ = М ∙ f э Молярные массы эквивалентов элементов в соединениях HBr, H2Te, AsH3 будут равны соответственно М (1Br) =80 г/моль (или Мэ (Br) =80 г/моль), М (1/2 Te) = 128/2 = 64 г/моль, (или Мэ (Te) =64 г/моль) Э (1/3 As) = 75/3 = 25 г/моль (или Мэ (As) =25 г/моль). Для кислот, оснований, средних солей и оксидов, проявляющих основные свойства, молярная масса эквивалента может быть рассчитана как сумма молярных масс эквивалентов ионов, составляющих данное соединение: Мэ (соединения) = Мэ ∙ (катиона) + Мэ (аниона) Например, М (1/2 СuO) = М∙ f э = (64+16)∙1/2 = 40 г/моль или М (1/2 СuO) = = М (1/2 Сu) + М (1/2 О) = 64/2 + 16/2 = 40 г/моль. Фактор эквивалентности и эквивалент сложных соединений определяется в уравнении химической реакции по отношению к количеству заместившихся или перестроившихся связей. Например: 1) NaOH + 3H3PO4 → Na3PO4 + 3H2O, f э (H3PO4) = 1/3 (так как три атома водорода замещаются на три атома натрия, то есть три связи перестраиваются); 2) KOH + H3PO4 → KH2PO4 + H2O, f э (H3PO4) = 1 (так как один атома водорода замещается на один атом калия, то есть одна связь перестраивается); 3) Al(OH)3 + 2HNO3 → AlOH(NO3)2 + 2H2O, f э (Al(OH)3) = 1/2 (так как две гидроксогруппы замещаются на две группы NO3-, то есть две связи перестраиваются).
В окислительно-восстановительных реакциях эквивалентные массы окислителей и восстановителей находят иначе. Основные законы Важнейший закон природы – закон сохранения массы и энергии – говорит о вечности материи, о ее переходе из одной формы в другую как о форме движения: В изолированной системе сумма масс и энергий постоянна. То есть происходит превращение одного вида материи в другой. Изолированной системой является та система, у которой нет обмена с окружающей средой ни массой, ни энергией. Между массой и энергией существует взаимосвязь согласно уравнению Энштейна: Е = mc2. Закон постоянства состава гласит: Соотношение масс элементов, формирующих данное соединение, постоянно и не зависит от способа получения этого соединения. Так, оксид кальция можно получить следующими способами:
Независимо от того, каким способом получено вещество СаО, оно имеет постоянный состав: один атом кальция и один атом кислорода образуют молекулу оксида кальция СаО. Закон кратных отношений подтверждает атомное строение вещества: В случае, когда два элемента образуют между собой несколько химических соединений, тогда имеет место отношение массы одного из элементов, приходящееся в этих соединениях на одну и ту же массу другого, как небольших целых чисел. Таким образом, элементы способны входить в состав соединений только в определенных пропорциях. Законы постоянства состава и кратных отношений не носят всеобщего характера и не всегда справедливы. Закон кратных отношений неприменим и в случае соединений переменного состава, открытых академиком Н.С. Курнаковым в начале ХХ века (пример: оксиды титана переменного состава TiO1,46-1,56 и TiO1,9-2,0), а также в случае, когда молекула вещества состоит из большого числа атомов (например, углеводороды состава С20Н42 и С21Н44). Закон объемных отношений справедлив для реакций, в которых присутствую газообразные вещества: Объемы газов, участвующих в акте химического взаимодействия, относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа. Для реакции, протекающей в газовой фазе и записанной в общем виде как aA + bB → cC + dD можно составить следующие соотношения:
В реакции 2Н2 + О2 → 2Н2О взаимодействии 2 объемов водорода и 1 объема кислорода, образуются 2 объема водяного пара. Закон Авогадро звучит как: Одинаковые объемы любых газов, взятых при одной температуре и одинаковом давлении, содержат одно и тоже число молекул. Именно из этого законы вытекает такое понятие количества вещества. Следствием закона является то, что 1 моль любого газа занимает при нормальных условиях (Р0 =101,3 кПа и Т0=298 К) объем, равный 22,4 л. Этот объем называют молярным объемом и обозначают как Vm. Следовательно, количества вещества можно также рассчитать и по формуле:
Для газообразных элементов используется понятие эквивалентного объема (Vэ), под которым понимают объем, занимаемый одним эквивалентом вещества. Для простых веществ, являющихся двухатомными газами (Н2, Сl2, Br2 и т.д.), при н.у. он равен 22.4/2 = 11,2 л. Как и молярную массу эквивалента, эквивалентный объе можно рассчитать по формуле: V э = Vm ∙ f э Введение в химию понятия «эквивалент» позволило сформулировать закон, называемый законом эквивалентов: Отношение масс (объемов) взаимодействующих друг с другом или образующихся в результате реакции веществ прямо пропорционально их эквивалентным массам (объемам). При решении некоторых задач удобно пользоваться другой формулировкой закона: массы реагирующих веществ пропорциональны их эквивалентным массам. Математически это можно записать следующим образом:
На основании данного закона решается большая часть экзаменационных задач, приведенных по данной теме. Тема 2. Строение атома и систематика химических элементов Пример. Какие орбитали атома заполняются раньше: а) 3d или 4s; б)3d или 4р? Посчитаем сумму n + l во всех этих случаях:
а) так как сумма квантовых чисел меньше для 4s, чем для 3d, то первым будет заполняться электронами именно 4s- подуровень, хотя он и формально находится дальше от ядра, чем 3d; б) так как сумма квантовых чисел одинакова, то первым будет заполняться 3d-подуровень, поскольку он характеризуется меньшим значением n; Из всего вышеизложенного следует, что заполнение d- подуровня электронами запаздывает на один период, а f- подуровня - на два периода. 2. Принцип Паули: в многоэлектронном атоме не может быть даже двух электронов с одинаковым набором четырех квантовых чисел. То есть, два любых электрона в атоме (ионе) должны отличаться друг от друга значением хотя бы одного квантового числа, поэтому на одной орбитали может быть не более двух электронов с противоположными спинами (спаренных электрона). Каждый подуровень содержит 2 l + 1 орбитали, на которых размещаются не более 2(2 l + 1) электронов. Следовательно, емкость s-орбиталей – 2, p-орбиталей – 6, d-орбиталей – 10 и f-орбиталей – 14 электронов. 3. Правило Хунда: наименьшей энергией обладает электронная конфигурация с максимальным спином (то есть при заселении орбиталей с одинаковой энергией (например, трех p-орбиталей px, py и pz) электроны в первую очередь располагаются поодиночке на каждой орбитали и лишь потом начинается заполнение вторыми электронами.). Это означает, что если на p-орбитали три электрона, то они располагаются так: Катализ. Катализ – процесс, заключающийся в изменении скорости химических реакций в присутствии веществ, называемых катализаторами. Катализаторы – вещества, изменяющие скорость химической реакции, которые могут входить в состав промежуточных продуктов, но не входят в состав конечных продуктов реакции и после окончания реакции остаются неизменными. Каталитические реакции – реакции, протекающие в присутствии катализаторов. Положительным называют катализ, при котором скорость реакции возрастает, отрицательным (ингибированием) – при котором она убывает. Примером положительного катализа может служить процесс окисления аммиака на платине при получении азотной кислоты. Примером отрицательного – снижение скорости коррозии при введении в жидкость, в которой эксплуатируется металл, нитрита натрия, хромата и дихромата калия. Катализаторы, замедляющие химическую реакцию, называются ингибиторами. В зависимости от того, находится катализатор в той же фазе, что и реагирующие вещества, или образует самостоятельную фазу, говорят о гомогенном или гетерогенном катализе. При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации. При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела – катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель. Механизм гетерогенного катализа сложнее, чем у гомогенного. Растворы неэлектролитов. Реакции ионного обмена. Реакции, протекающие в растворах электролитов и не сопровождающиеся изменением степеней окисления элементов, называются реакциями ионного обмена. Все электролиты диссоциируют на ионы, поэтому суть реакции между электролитами выражают кратким ионным уравнением. Сущность реакции ионного обмена заключается в связывании ионов. Для того, чтобы реакция между электролитами протекала необратимо, необходимо, чтобы часть ионов оказалась связанной или в легко летучее соединение, или в трудно растворимый осадок, или в слабый электролит, или в комплексный ион. При чем, если и в правой и в левой частях уравнения присутствуют слабые электролиты, то равновесие смещено в сторону образования менее диссоциирующего соединения. Гидролиз солей.
Запишем уравнение реакции нейтрализации: Основание + кислота → соль + Н2О. Эта реакции протекает, поскольку в результате образуется слабый электролит – вода. Но если взять сухую соль и поместить ее в воду, то возможно протекание реакции, обратной реакции нейтрализации, в том случае, если при этом также образуется какой-либо слабый электролит: Соль + Н2О → основание + кислота. Таким образом, гидролизом (дословно – «разложением водой») называется процесс взаимодействия вещества с водой, при котором составные части вещества взаимодействуют с составными частями воды, образуя слабодиссоциирующие ионы или молекулы. Гидролиз в большинстве случаев является процессом обратимым; чем слабее электролит, образующий соль, тем глубже протекает процесс гидролиза. Ему подвергаются соединения различных классов, чаще всего – соли. Три случая гидролиза солей. Помимо растворения соли в воде происходит ее гидролиз. Гидролиз всегда протекает по слабой составляющей. То есть ионы слабого составляющего соли (катион («+») или анион («–»)) связывают соответствующие ионы воды (ОН– или Н+ соответственно заряду)с образованием малодиссоциирующего соединения. Если соль образована многоосновной слабой кислотой, многоосновным слабым основание, тем и другим одновременно, то гидролиз протекает ступенчато. Количество стадий всегда определяется по заряду слабого составляющего соли. Таким образом, чтобы написать реакцию гидролиза соли, необходимо предварительно провести анализ соли. Первый случай гидролиза – гидролиз по аниону. Соль, образованная сильным основанием и слабой кислотой, гидролизуется по аниону, в результате образуется слабо диссоциирующая кислота, а в растворе накапливаются гидроксид – ионы, создавая щелочную среду. Рассмотрим это на примере. Ацетат натрия СН3СООNa – соль сильного однокислотного основания NаOH и слабой одноосновной кислоты СН3СООН. При растворении в воде молекулы СН3СООNa полностью диссоциируют на ионы Na+ и СН3СОО–. Катионы Nа+ не могут связывать ионы ОН– воды, так как NаOH – сильный электролит. Анионы же СН3СОО– связывают протоны водорода воды, образуя молекулы слабого электролита СН3СООН. Таким образом, соль гидролизуется по аниону. Соответствующие ионно-молекулярные и молекулярные уравнения реакций будут иметь вид:
При этом мы получили краткое ионно–молекулярное уравнение реакции гидролиза, а добавив в левую и правую части ионы натрия, получим полное ионно–молекулярное и далее молекулярное уравнения гидролиза:
В результате гидролиза в растворе появляется некоторый избыток ионов ОН–, поэтому раствор СН3СООNa имеет щелочную реакцию (рН > 7). Если на возможность протекания гидролиза указывает ион слабого электролита (в данном случае – это ацетат-ион СН3СОО–), то реакцию среды при гидролизе определяет ион сильного электролита (в данном случае – это гидроксид-ионы ОH–, образующиеся при диссоциации NaOH). Соли слабых многоосновных кислот гидролизуются ступенчато (с образованием кислых солей в качестве промежуточных продуктов). Рассмотрим это на примере. Силикат калия К2СO3 – соль сильного однокислотного основания КOH и слабой многоосновной кислоты H2SiО3. При растворении в воде молекулы К2SiO3 полностью диссоциируют на ионы К+ и SiО32–. Катионы К+ не могут связывать ионы ОН– воды, так как КOH – сильный электролит. Анионы же SiО32– связывают протоны водорода воды, образуя ионы кислой соли НSiО3–. Образование молекул Н2SiО3 практически не происходит, поскольку НSiО3– диссоциирует гораздо труднее, чем Н2SiО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Однако, если повысить температуру, разбавить раствор или связать образующиеся гидроксид-ионы, то становится возможным протекание второй стадии гидролиза. Поскольку заряд слабого составляющего соли – силикат иона (SiО32–) – «2–», то гидролиз протекает в две стадии. Соответствующие ионно-молекулярные и молекулярные уравнения реакций будут иметь вид:
В результате гидролиза в растворе появляется некоторый избыток ионов ОН–, поэтому раствор К2SiО3 имеет щелочную реакцию (рН > 7). Второй случай гидролиза – гидролиз по катиону. Соль, образованная слабым основанием и сильной кислотой, гидролизуется по катиону, в результате образуется слабо диссоциирующее основание, а в растворе накапливаются ионы водорода, создавая кислую среду. Хлорид аммония NH4Cl – соль слабого однокислотного основания NH4OH и сильной одноосновной кислоты HCl. При растворении в воде молекулы NH4Cl полностью диссоциируют на катионы NH4+ и анионы Cl–. Ионы Cl– не могут связывать ионы Н+ воды, так как HCl – сильный электролит. Ионы же NH4+ связывают гидроксид-ионы воды, образуя молекулы слабого электролита NH4ОН. Таким образом, соль гидролизуется по катиону. Соответствующие ионно-молекулярные и молекулярные уравнения реакций будут иметь вид:
В результате гидролиза в растворе появляется некоторый избыток ионов Н+, поэтому раствор NH4Cl имеет кислую реакцию (рН < 7). В данном случае на возможность протекания гидролиза указывает ион слабого электролита – катион NH4+, а реакция среды при гидролизе определяется ионами сильного электролита – ионами водорода, образующиеся при диссоциации HCl. Гидролиз солей, образованных многовалентным катионом протекает ступенчато, через стадии образования основных солей. Рассмотрим это на примере. Хлорид цинка ZnCl2 – соль слабого многокислотного основания Zn(OH)2 и сильной одноосновной кислоты HCl. При растворении в воде молекулы ZnCl2 полностью диссоциируют на катионы Zn2+ и анионы Cl–. Ионы Cl– не могут связывать ионы Н+ воды, так как HCl – сильный электролит. Ионы же Zn2+ связывают гидроксид-ионы воды, образуя катионы основной соли ZnOH+. Образование молекул Zn(OH)2 практически не происходит, поскольку они являются более сильными электролитами, чем ZnOH+. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Однако, если связывать образующиеся ионы водорода, то ион ZnOH+ в свою очередь подвергается гидролизу (вторая ступень гидролиза). Поскольку заряд слабого составляющего соли – катиона цинка (Zn2+) – «2+», то гидролиз протекает в две стадии. Соответствующие ионно-молекулярные и молекулярные уравнения реакций будут иметь вид:
В результате этого концентрация ионов Н+ в растворе становится больше концентрации ионов ОН– и раствор ZnCl2 приобретает кислую реакцию (рН < 7). Третий случай гидролиза – гидролиз по катиону и по аниону. Соль образованная слабым основание и слабой кислотой, гидролизуется одновременно по катиону и аниону. Очевидно, что гидролиз протекает глубже, чем в первых двух случаях. Характер среды слабо щелочной, слабокислый, нейтральный (чаще указывают рН ≈ 7). Рассмотрим это на следующем примере. Ацетат аммония – соль, образованная слабым однокислотным основанием NH4OH и слабой одноосновной кислотой CH3COOH. В растворе CH3COONH4 полностью диссоциирует на катионы NH4+ и анионы CH3COO–. Ионы аммония связывают гидроксид-ионы воды, а ацетат-ионы – ионы водорода, образующиеся при диссоциации воды:
Гидролиз таких солей протекает очень сильно, поскольку в результате его образуются и слабое основание, и слабая кислота. Реакция среды в растворах солей, образованных слабым основанием и слабой кислотой, будет меняться несущественно, рН будет зависеть от того, какой из электролитов, образовавших соль, является относительно более сильным, т. е. от их констант диссоциации (KD). Если KD (основания) > KD (кислоты), то pH > 7. Если KD (основания) < KD (кислоты), то pH < 7. В случае гидролиза CH3COONH4 KD(NH4OH) = 6,3∙10–5; KD (CH3COOH) = 1,8∙10–5, поэтому реакция водного раствора этой соли будет слабощелочной, почти нейтральной (pH ≈ 7). Пример. На основе электронных уравнений подобрать коэффициенты в реакциях. Указать окислитель и восстановитель: К2Сr2О7 + KI + H2SO4 → Cr2(SO4)3 + I2 + K2SO4 + H2O. Напишем схему окислительно-восстановительной реакции, расставив степени окисления над всеми элементами: + +6 –2 + – + +6 –2 +3 +6 –2 0 + +6 –2 + –2 К2Сr2О7 + KI + H2SO4 → Cr2(SO4)3 + I2 + K2SO4 + H2O. Из уравнения следует, что степень окисления хрома до реакции была +6, а после реакции стала +3; степень окисления йода изменилась от –1 до 0. Отражаем это изменение степеней окисления в электронных уравнениях: НОК восстановитель: 2I– – 2е = I2 3 (процесс окисления); 6 окислитель: 2Сr+6 + 6е = 2Сr+3 1 (процесс восстановления), исходя из того, что окислитель принимает электроны, а восстановитель их отдает.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.230.107 (0.127 с.) |
 Порядковый номер
Порядковый номер Относительная атомная масса
Относительная атомная масса 
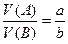 или
или 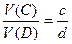 или
или  и т.д.
и т.д.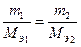 или
или 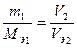
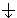
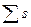 = 3/2, а не так:
= 3/2, а не так: 
 СН3СОО– + HOH СН3СООН + ОH– .
СН3СОО– + HOH СН3СООН + ОH– . СН3СОО– + Na+ + HOH СН3СООН + Na+ + ОH– .
СН3СОО– + Na+ + HOH СН3СООН + Na+ + ОH– . СН3СООNa + HOH СН3СООН + NaОH.
СН3СООNa + HOH СН3СООН + NaОH. 1) SiО32– + HOH НSiО3– + ОH– ;
1) SiО32– + HOH НSiО3– + ОH– ; 2К+ + SiО32– + HOH К+ + НSiО3– + К+ + ОH– ;
2К+ + SiО32– + HOH К+ + НSiО3– + К+ + ОH– ; К2SiО3 + HOH КНSiО3 + КOH;
К2SiО3 + HOH КНSiО3 + КOH; 2) НSiО3– + HOH Н2SiО3 + ОH– ;
2) НSiО3– + HOH Н2SiО3 + ОH– ; К+ + НSiО3– + HOH Н2SiО3 + К+ + ОH– ;
К+ + НSiО3– + HOH Н2SiО3 + К+ + ОH– ; КНSiО3 + HOH Н2SiО3 + КOH.
КНSiО3 + HOH Н2SiО3 + КOH. NH4+ + HOH NH4OH + H+ ;
NH4+ + HOH NH4OH + H+ ; NH4+ + Cl– + HOH NH4OH + H+ + Cl– ;
NH4+ + Cl– + HOH NH4OH + H+ + Cl– ; NH4Cl + HOH NH4OH + HCl.
NH4Cl + HOH NH4OH + HCl. 1) Zn2+ + HOH ZnOH+ + H+ ;
1) Zn2+ + HOH ZnOH+ + H+ ; Zn2+ + 2Cl– + HOH ZnOH+ + Cl– + H+ + Cl– ;
Zn2+ + 2Cl– + HOH ZnOH+ + Cl– + H+ + Cl– ; ZnCl2 + HOH ZnOHCl + HCl;
ZnCl2 + HOH ZnOHCl + HCl; 2) ZnOH+ + HOH Zn(OH)2 + H+ ;
2) ZnOH+ + HOH Zn(OH)2 + H+ ; ZnOH+ + Cl– + HOH Zn(OH)2 + H+ + Cl– ;
ZnOH+ + Cl– + HOH Zn(OH)2 + H+ + Cl– ; ZnOHCl + HOH Zn(OH)2 + HCl.
ZnOHCl + HOH Zn(OH)2 + HCl. CH3COO– + NH4+ + H2O CH3COOH + NH4OH;
CH3COO– + NH4+ + H2O CH3COOH + NH4OH;


