Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема Азотная кислота и ее свойстваСтр 1 из 2Следующая ⇒
Тема Азотная кислота и ее свойства Дата выдачи 25.04 Дата выполнения 2 мая При выполнении работы выполняем требования: Записываем тему занятия, указываем число. 2. Указываем фамилию и имя студента. 3. Выполняем задания, не переписывая их формулировки. Домашнее задание. Используем дополнительную литературу 1. Формула азотной кислоты, ее внешний вид и применение. 2. Заполните таблицу Химические свойства азотной кислоты
Лекция HNO3 - Азотная кислота
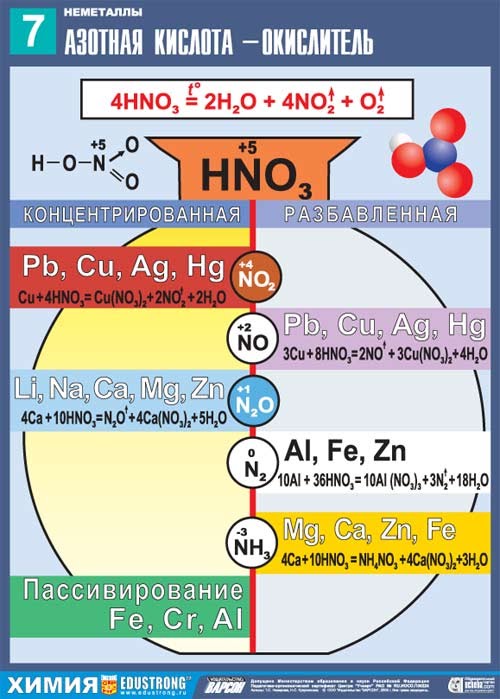
Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а валентность равна IV. Физические свойства Азотная кислота HNO3 в чистом виде - бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде. Под действием света азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет: N2 + O2 грозовые эл.разряды→ 2NO 2NO + O2 → 2NO2 4НNО3 свет→ 4NО2↑ (бурый газ) + 2Н2О + О2 Азотная кислота высокой концентрации выделяет на воздухе газы, которые в закрытой бутылке обнаруживаются в виде коричневых паров (оксиды азота). Эти газы очень ядовиты, так что нужно остерегаться их вдыхания. Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ. Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы (качественная реакция на концентрированную азотную кислоту – жёлтое окрашивание из-за выделения элементной серы при действии кислоты на белок – ксантопротеиновая реакция). То есть – это ожог кожи. Чтобы предотвратить ожог, следует работать с концентрированной азотной кислотой в резиновых перчатках. Получение Лабораторный способ KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании)
Промышленный способ Осуществляется в три этапа: a) Окисление аммиака на платиновом катализаторе до NO 4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С) б) Окисление кислородом воздуха NO до NO2 2NO + O2 → 2NO2 в) Поглощение NO2 водой в присутствии избытка кислорода 4NO2 + О2 + 2H2O ↔ 4HNO3 или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода) Применение · в производстве минеральных удобрений; · в военной промышленности; · в фотографии — подкисление некоторых тонирующих растворов; · в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише). · в производстве взрывчатых и отравляющих веществ Химические свойства азотной кислоты · Для азотной кислоты характерны свойства: общие с другими кислотами и специфические: Очень сильная кислота. Диссоциирует в водном растворе практически нацело: HNO3 → H+ + NO3- Реагирует с основаниями HNO3 + NaOH → NaNO3 + H2O Реагирует с металлами. В зависимости от концентрации кислоты и положения металла в электрохимическом ряду напряжений Н. Бекетова могут образовываться разные азотсодержащие продукты.
Тема Азотная кислота и ее свойства
|
|||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 69; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.70.255 (0.004 с.) |