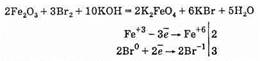Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Применение комплексных соединений ⇐ ПредыдущаяСтр 2 из 2
Применение комплексных соединений широко используется в промышленности. При помощи химических методов, влекущих за собой образование КС, извлекают металлы из руды. Примерами могут служить чистое железо, никель и кобальт, которые получают при помощи температурного разложения карбонилов металлов. Эти сложные вещества, разлагаясь, выделяют необходимые металлы.
Аналитическая химия может использовать КС в качестве индикаторов. Органический и неорганический синтез может ускоряться из-за них, так как им присущи свойства катализатора в силу их высокой активности. Гальванопластика также не может обойтись без комплексных соединений, что обусловливается невозможностью получения столь надежных покрытий из простой соли, в отличие от соединений цианидов.
Соединения комплексного типа играют одну из важнейших ролей в любом организме, например, кислород в паре с кровяным гемоглобином доставляют O2 по организму к тканям и клеткам; находящийся внутри растений хлорофилл также считается комплексом
1.4 Комплексные соединения железа Для железа наиболее характерны два ряда соединений: соединения железа (II) и железа (III). Известно также небольшое число соединений железа (VI). Оксид железа (II) FeO — черный, легко окисляющийся порошок. Получают его восстановлением оксида железа (III) оксидом углерода (II) при 500°С: Fe2O3+СО=2FeO+СО2 FeO проявляет свойства основного оксида: легко растворяется в кислотах, образуя соли железа (II): Оксид железа (III) Fe2O3 — самое устойчивое природное кислородсодержащее соединение железа. Является амфотерным оксидом. При сплавлении Fe2O3 с оксидами, гидроксидами или карбонатами металлов образуются ферриты: Fe2O3+2NaOH=2NaFeO2+Н2О Fe2O3+Na2CO3=2NaFeO2+CO2 Растворяясь в кислотах, оксид железа (III) образует соли железа(III): Fe2O3+6НСl=2FeCl3+3Н2О
Оксид железа (II-III) Fe3O4 встречается в природе в виде минерала магнетита. Он хороший проводник тока, поэтому используется для изготовления электродов. Получают взаимодействием железа с водяным паром ниже 570°С: 3Fe+4Н2O=Fe3O4+4H2 Оксид железа (II-III) Fe3O4 иным образом можно записать как FeO•Fe2O3. Оксидам соответствуют гидроксиды железа. Гидроксид железа (II) Fe(OH)2 представляет собой твердое вещество, но в чистом виде его можно получить лишь тогда, когда растворы реагирующих веществ не содержат растворенного кислорода и если реакцию вести в отсутствие кислорода воздуха:
FeSO4+2NaOH=Fe(OH)2¯+Na2SO4 На воздухе гидроксид железа (II) неустойчив, при соприкосновении с ним сначала зеленеет, затем буреет, переходя в гидроксид железа (III): 4Fe(OH)2+О2+2Н2O=4Fe(OH)3 Гидроксид железа (II) Fe(OH)2 является нерастворимым гидроксидом и проявляет основные свойства, хорошо растворяясь в минеральных кислотах и образуя соли железа (II): Fe(OH)2+H2SO4=FeSO4+2Н2О Гидроксид железа (III) Fe(OH)3 в виде красно-бурого осадка может быть получен окислением Fe(OH)2 либо действием щелочей на соли железа (III): FeCl3+3NaOH=Fe(OH)3¯+3NaCl Гидроксид железа (III) трудно растворим, является более слабым основанием, чем гидроксид железа (II). Это объясняется тем, что у Fe2+ меньше заряд иона и больше его радиус, чем у Fe3+, a значит, Fe2+ слабее удерживает гидроксид-ионы, т.е. Fe(OH)2 более легко диссоциирует. Гидроксид железа (III) обладает слабовыраженной амфотерностью: растворяется в разбавленных кислотах: Fe(OH)3+3НСl=FeCl3+3Н2О а при сплавлении со щелочами или основными оксидами образует ферриты: Fe(OH)3+3NaOH=NaFeO2+2Н2О Соли двухвалентного железа могут быть получены растворением металлического железа, гидроксида, карбоната или сульфида железа (II) в разбавленных кислотах без доступа воздуха: Fe + 2НСl=FeCl2+Н2О Соли железа (II) гидролизуются незначительно: Fe2++Н2О«Fe(OH)++Н+ Среди солей железа (II) наибольшее значение имеет железный купорос FeSO4•7Н2О, в состав которого входит семь молекул кристаллизационной воды. Железный купорос хорошо растворяется в воде. Его применяют для борьбы с вредителями сельского хозяйства, а также для изготовления красителей. Соли трехвалентного железа могут быть получены окислением порошка железа галогенами, окислением солей железа (II), растворением оксида или гидроксида железа (III) на воздухе: 2Fe+3Cl2=2FeCl3 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Соли железа (III) сильно гидролизуются водой, и их водные растворы имеют кислую реакцию: FeCl3+НОН«Fe(OH)Cl2¯+HCl Fe3++НОН«Fe(OH)2++Н+ Из солей железа (III) наибольшее значение имеют хлорид железа (III) FeCl3, представляющий собой весьма гигроскопические оранжевые кристаллы, которые при хранении поглощают воду и расплываются в коричневую кашицу; ионагидрат сульфата железа (III) Fe2(SO4)3•9Н2О, используемый как коагулянт, а также для травления металлов; ионагидрат нитрата железа (III) Fe(NO3)3•9Н2О, используемый как протрава при крашении хлопчатобумажных тканей и утяжелитель шелка.
Соли железа (II) легко переходят в соли железа (III), например, при нагревании с азотной кислотой или с перманганатом калия в присутствии серной кислоты: 6FeSO4+2HNO3+3H2SO4=3Fe2(SO4)3+2NO+4H2O Окисление солей железа (II) в соли железа (III) может происходить под действием кислорода воздуха при хранении этих соединений, но только этот процесс очень длительный. Кроме того, следует отметить также две важные комплексные соли, в которых железо входит в состав анионов: гексацианоферрат (II) калия K4[Fe(CN)6] и гексацианоферрат (III) калия K3[Fe(CN)6], которые являются реактивами на катионы Fe3+ и Fe2+ соответственно. Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная кровь) является важным реактивом для обнаружения ионов железа Fe3+ в растворе: K4[Fe(CN)6]«4К++[Fe(CN)6]4- Получающиеся ионы [Fe(CN)6]4- могут взаимодействовать с ионами Fe3+, образуя характерный темно-синий осадок гексацианоферрата (II) железа (III), называемый часто берлинской лазурью: 3[Fe(CN)6]4-+4Fe3+=Fe4[Fe(CN)6]3¯ Гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль) является реактивом на катионы Fe2+: K3[Fe(CN)6]«3K++[Fe(CN)6]3- и при взаимодействии иона [Fe(CN)6]3- с катионами Fe2+ выпадает темно-синий осадок гексацианоферрата (III) железа (II), называемый часто турнбулевой синью: 2[Fe(CN)6]3-+Fe2+=Fe3[Fe(CN)6]2¯ Катионы Fe3+ могут быть обнаружены также с помощью бесцветного раствора роданида аммония NH4SCN: NH4SCN«NH4++SCN- Ионы SCN- образуют с катионом Fe3+ соединение кроваво-красного цвета — роданит железа Fe(SCN)3 (плохо диссоциирующий): Fe3++3SCN-=Fe(SCN)3 Известно также небольшое число соединений железа (VI) — ферраты, например феррат калия K2FeO4, феррат бария BaFeO4, которые могут быть получены окислением оксида железа (III) при нагревании с нитратом и гидроксидом калия: Fe2O3+4КОН+3KNO3=2K2FeO4+3KNO2+2H2O или при легком нагревании с бромом и щелочью:
Ферраты в окислительно-восстановительных реакциях могут быть только окислителями.
1.4.1 Соль Море
Сульфа́т аммо́ния-желе́за(II) (соль Мо́ра) — неорганическое соединение, двойная сернокислая соль железа и аммония с формулой Fe(NH4)2(SO4)2. Свойства Химическая формула: Fe S O 4·(N H 4)2 S O 4·6 H2O (или Fe(NH4)2(SO4)2·6H2O). Представляет собой неярко сине-зелёные моноклинные кристаллы. Растворяется в воде. Растворимость соли Мора в воде равна 21,6 г безводного вещества в 100 г воды при 20 °C. В кислоте растворимость несколько больше. Устойчива на воздухе. Парамагнетик. Соль Мора используется в медицине (добавляется в пищу, или в виде фармакопейного препарата, при нехватке в организме больного железа), для определения уробилина, в фармацевтике. Применение Соль Мора применяется в научно-исследовательских работах и химических лабораториях как удобная форма препарата железа(II): для определения концентрации (титра) перманганата калия в растворах, при определении концентраций хрома и ванадия в растворах этилового спирта и эфира. В растворах ион Fe2+ даже слабыми окислителями легко окисляется до Fe3+.
Также, в виде концентрированных растворов, применяется для пропитки древесины для защиты её от гниения. Имеет и другие применения. Соль названа в честь немецкого химика Карла Фридриха Мора (1809—1879).
1.4.2 Железоаммонийные квасцы
Сульфа́т желе́за(III)-аммо́ния ( железоаммонийные квасцы) — неорганическое соединение, кристаллогидрат двойной соли аммония, железа и серной кислоты с формулой NH4Fe(SO4)2·12H2O, бесцветные или светло-фиолетовые кристаллы, хорошо растворяется в воде. Получение
{\displaystyle {\mathsf {Fe_{2}(SO_{4})_{3}+(NH_{4})_{2}SO_{4}+24H_{2}O\ {\xrightarrow {0^{o}C}}\ 2NH_{4}Fe(SO_{4})_{2}\cdot 12H_{2}O\downarrow }}} Физические свойства Сульфат железа(III)-аммония образует бесцветные или светло-фиолетовые кристаллы кубической сингонии, пространственная группа P a3, параметры ячейки a = 1,2318 нм, Z = 4. На воздухе из-за выветривания постепенно приобретает жёлто-коричневый оттенок. При ≈37 °C плавится в собственной кристаллизационной воде. Хорошо растворяется в воде, не растворяется в этаноле. Водный раствор имеет кислую реакцию. Химические свойства
Формулу записать…….
Применение
1.4.3 Железный купорос
Железный купорос или, иными словами, сульфат железа выпускается в форме гранул бирюзового цвета. Кристаллы растворяются в воде. В готовом порошке концентрация активного вещества составляет 53%. Общая информация Сульфат железа является единственным концентрированным источником железа, способным дать сельскохозяйственным посадкам указанный элемент в легкоусвояемой форме. Обратите внимание: для целей агрохимии предназначается специальный препарат, исходное вещество которого пригодно для целей растениеводства. Несертифицированный сульфат железа имеет желтоватый или беловатый оттенок из-за большого содержания серы. Использовать его можно только для определенных хозяйственных работ, дезинфекции уличных туалетов и выгребных ям, но не нужд сельского хозяйства. Протравливание некондиционным железным купоросом дорожек и стен зданий, с целью избавления ото мха, запрещено (он испортит камень и бетонную кладку).
Возможные сферы использования Чаще всего железный купорос применяется: Для производства чернил; В гальванопластике; Для окрашивания шерсти; При воронении стали; Для производства красок; В сфере легкой промышленности (например, для окрашивания кожных изделий и протравливания тканей); В мебельной промышленности (дерево протравливается как для защиты, так и для получения высоких эстетических показателей: железный купорос придает древесине определенный цвет, зависящий от ее сорта); В строительной области (для окрашивания построек разного вида, например, коттеджей и ограждений); В медицине (лекарства на основе вещества используются для нормализации уровня гемоглобина, миоглобина, при нехватке железа в организме, для лечения железодефицитных анемий); Максимально популярен железный купорос в сельскохозяйственной области. Возможные варианты применения в сельском хозяйстве: Лечение растений, подверженных хлорозу; Борьба с различного рода вредителями посадок, например, со слизнями; Уничтожение спор грибковых микроорганизмов; Борьба со мхом и лишайниками; Химическая мелиорация грунта разного типа. Сульфат железа в сельском хозяйстве можно применять как самостоятельно (как правило, в виде водных растворов для опрыскивания), так и включив в состав побелки. Важно! Вещество является полноценной химией. Поэтому при ее использовании необходимо закрыть кожу одеждой, надеть перчатки и защитные очки.
1.5 Кинетика химических реакций
|
||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 204; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.198.173 (0.046 с.) |