
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приклади розв’язку типових задач ⇐ ПредыдущаяСтр 7 из 7
Задача 1. Визначити питому поверхню адсорбенту за ізотермою адсорбції азоту, якщо площа, яку займає одна молекула азоту на поверхні адсорбенту, становить S0 = 16,2∙10-20 м2. Дані щодо адсорбції азоту наведено в таблиці:
Розв’язок. Визначимо можливість застосування теорії БЕТ до наведених експериментальних даних. Для цього розрахуємо абсцису та ординату ізотерми адсорбції БЕТ у лінійній формі
Результати розрахунків наведемо у вигляді таблиці:
Побудуємо графік залежності y = f(x):
Рис. 5.1. Ізотерма адсорбції в координатах лінійної форми рівняння БЕТ (рівняння 2.9) Лінійність наведеної на рис. 5.1 залежності підтверджує можливість застосування теорії БЕТ до експериментальних даних. Для визначення адсорбційної ємності моношару а ¥ за графіком y = f(x) знаходимо константи рівняння
Визначивши величину а ¥, розраховуємо питому поверхню адсорбенту:
Задача 2. Побудувати криву капілярної конденсації, інтегральну та диференціальну криві розподілу об’єму пор адсорбенту за радіусами згідно з наведеними даними конденсації парів бензолу на активованому вугіллі при Т = 293 К (за цієї температури молярний об’єм бензолу V М = 89∙10-6 м3/моль, а поверхневий натяг s = 28,9∙10-3 Дж/м2).
Розв’язок. Будуємо ізотерму капілярної конденсації (рис. 5.2). Оскільки ізотерма десорбції визначається геометричними параметрами капілярів, то саме на гілці, що описує десорбцію, вибираємо довільно ряд точок, які відповідають певним значенням
Рис. 5.2. Ізотерма капілярної конденсації бензолу на активованому
вугіллі Для цих же значень
Результати розрахунків заносимо до таблиці:
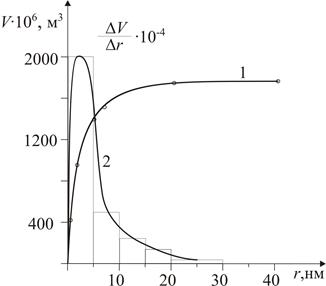
Будуємо інтегральну криву в Vадс = f(r) (рис. 5.3, крива 1) та поділяємо весь діапазон радіусів на довільні проміжки D r. Довжини цих проміжків вибираємо таким чином, щоб величини зміни функції D Vадс на кожному з цих проміжків були більш-менш співрозмірними. Крім того, для зручності обробки величини D r краще брати або однаковими, або кратними один одному за довжиною. Після цього за інтегральною кривою розподілу об’єму пор за радіусами розраховуємо зміни D Vадс на кожному з обраних проміжків. Поділивши розраховані значення D Vадс на довжини проміжків D r, отримуємо значення Результати розрахунків заносимо у таблицю:
За даними таблиці будуємо диференціальну криву розподілу об’єму пор за радіусами. Для цього спочатку будуємо гістограму, основами прямокутників якої є проміжки радіусів D r, а висотами прямокутників – значення відношення D Vадс / D r. Сполучаємо середини вершин побудованих прямокутників плавною кривою. Диференціальну криву розподілу об’єму пор за радіусами наведено на рис. 5.3 (крива 2).
Рис. 5.3. Інтегральна (1) та диференціальна (2) криві розподілу об’єму пор адсорбенту за радіусами Задача 3. Золь діоксиду кремнію у воді містить частинки, радіус яких 2∙10-8 м. Визначити гіпсометричну висоту частинок h ½ (на цій висоті від початкового рівня концентрація частинок зменшується удвічі), якщо відомо, що густина частинок золю дорівнює 2,1∙103 кг/м3, густина середовища – 1∙103 кг/м3, а температура становить 298 К.
Розв’язок. Скористаємось формулою Больцмана (4.7), що описує розподіл частинок по висоті, враховуючи те, що шукана висота відповідає зменшенню їхньої концентрації вдвічі:
де Підставимо в рівняння вираз для маси частинки та визначимо за ним
Задача 4. Обчислити питому поверхню вугільного пилу, який містить сферичні частки із середнім розміром 7,5∙10-5 м, якщо питома вага вугілля дорівнює 1,8∙103 кг/м3. Розв’язок. Під величиною питомої поверхні Sпит системи зі сферичними частинками розуміють відношення загальної поверхні подрібненої речовини до одиниці маси або об’єму. Позначимо через S площу поверхні сферичної частинки, що обчислюється за формулою Врахувавши, що маса частинки а) б) Задача 5. Обчислити величину x –потенціалу для частинок латексу полістиролу за наступними даними: при електрофорезі зміщення s кольорової границі за одну годину становить 0,025 м; напруга Е, що прикладена до електродів, дорівнює 115 В; відстань між електродами l складає 0,55 м; температура стандартна. Розв’язок. Електрофоретична рухливість може бути розрахована за формулою:
де t - час, с; Н = Е/l - градієнт потенціалу, В/м. Враховуючи те, що для водного дисперсійного середовища при стандартній температурі 298 К відносна діелектрична проникність e = 78,25, в’язкість h = 0,894×10-3 Па×с, а електрична стала e 0 = 8,854×10-12 Ф/м, обчислюємо величину x – потенціалу:
Задача 6. Визначити радіус сферичних частинок золю йодиду срібла та розрахувати величину середнього зсуву частинок за 6 годин, виходячи з наступних даних: при температурі 293 К коефіцієнт дифузії дорівнює 1,2×10-12 м2/с, в’язкість середовища становить 1×10-3 (Н×с)/м2. Розв’язок. Радіус частинок знаходимо, використовуючи рівняння Ейнштейна (4.3) для коефіцієнта дифузії:
Виходячи з формули (4.4) для величини середнього зсуву, отримаємо:
Задача 7. Визначити осмотичний тиск 0,2 %-го монодисперсного золю золота, що містить кубічні частинки з розміром ребра l = 1×10-8 м при температурі 298 К; густина золота становить 19,3×103 кг/м3. Розв’язок. Маса однієї кубічної частинки золю дорівнює:
Оскільки мова йде про 0,2 % -й золь, то це означає, що в 1 м3 системи міститься 2 кг частинок золю, тобто масова концентрація золю с = 2 кг/м3. Відповідно, частинна концентрація золю становить:
Отже, згідно з рівнянням (4.5) осмотичний тиск за температури 298 К дорівнює:
Задача 8. Визначити радіус сферичних частинок монодисперсного золю, якщо він розсіює 30 % світла з довжиною хвилі 600 нм. Показники заломлення дисперсійного середовища та дисперсної фази відповідно дорівнюють 1,333 та 2,035, масова концентрація золю складає 1 кг/м3, густина дисперсної фази становить 2,5×103 кг/м3. Розв’язок. За умовою задачі відношення І/І0 = 0,3. Згідно з рівнянням Релея для світлорозсіяння (4.9) об’єм однієї частинки в м3 дорівнює:
Відповідно радіус сферичної частинки становить:
Задача 9. Перевірити можливість застосування теорії швидкої коагуляції Смолуховського до кінетики процесу коагуляції гідрозолю металічного срібла при 300 К (
Розв’язок. Час половинної коагуляції золю q експериментально можна визначити із залежності v0/v = f(t). Для кожного моменту часу розраховуємо відповідне значення v0/v:
та будуємо графік в координатах v0/v від t (рис. 5.4).
Рис. 5.4. Залежність n0/n від t для експериментального визначення часу половинної коагуляції q З рис.5.4 визначаємо час половинної коагуляції q = ctg α = 85 c. Теоретичне значення часу половинної коагуляції розраховується за рівнянням:
Експериментально знайдене значення q в межах похибок досліду узгоджується з теоретично розрахованим. Отже, можна зробити висновок, що злипання частинок золю срібла в даних умовах відбувається за механізмом швидкої коагуляції. Задача 10. За відомими початковою частинною концентрацією золю v0 = 5×1014 частинок/м3 та часом половинної коагуляції золю q = 335 с: а) розрахувати частинну концентрацію золю через 100, 200, 250, 300 та 400 с від початку коагуляції та побудувати графік коагуляції; б) обчислити константу швидкості коагуляції; в) визначити число частинок кратності три через 400 с після початку коагуляції. Розв’язок. а) За теорією швидкої коагуляції Смолуховського зміна частинної концентрації золю v у часі t пов’язана з його початковою частинною концентрацією v0 та часом половинної коагуляції q наступним рівнянням:
Частинна концентрація золю через 100 с після початку коагуляції дорівнюватиме:
Аналогічно розраховуємо величини v для решти наведених значень t та будуємо криву коагуляції в координатах v = f(t). б) Константа швидкості коагуляції розраховується за формулою:
в) Число частинок кратності m, тобто частинок, які містять m початкових частинок, у момент часу t від початку коагуляції визначається за формулою (4.16). Таким чином, значення n 3 через 400 с після початку коагуляції буде складати:
Контрольні завдання Для зручності виконання роботи радимо скопіювати сторінки із завданням та перенести в наведені після кожного завдання таблиці величини, необхідні для розрахунків відповідно до варіанту, який виконується, використовуючи посилання в тексті завдань.
Завдання 1. Розрахувати питому поверхню адсорбенту за ізотермою адсорбції речовини А, якщо відома площа, яку займає молекула речовини А на поверхні адсорбенту. Дані для розрахунку наведено в табл. 1.1 Додатку 1. Дані для розрахунку питомої поверхні адсорбенту за ізотермою адсорбції речовини А
Завдання 2. Побудувати криву капілярної конденсації, інтегральну та диференціальну криві розподілу об’єму пор адсорбенту за радіусами. Дані для розрахунку наведено в табл. 2.1 та в табл. 2.2 Додатку 2. Дані по конденсації парів А на адсорбенті В при температурі Т = 293 К
Мольний об’єм та поверхневий натяг адсорбатів при Т = 293 К
Завдання 3. Для монодисперсного гідрозолю (табл. 3.1 Додатку 3) відома гіпсометрична висота h½ сферичних частинок при температурі Т К. Визначити:
Всі необхідні для розрахунку дані наведено в табл. 3.1 Додатку 3 та табл. 2.3 Додатку 2. Характеристики дисперсної фази монодисперсних гідрозолів
Характеристики дисперсійного середовища (Н2О) в залежності від температури
Завдання 4. На підставі експериментальних даних про зміну частинної концентрації (n, кількість частинок/м3) у часі при коагуляції золю (табл. 4.1 Додатку 4):
Необхідні дані для розрахунків приведено в табл. 4.1 Додатку 4.
ДОДАТКИ Додаток 1 Таблиця 1.1. Дані для розрахунку питомої поверхні адсорбенту за ізотермою адсорбції речовини А
Продовження табл. 1.1
Додаток 2 Таблиця 2.1. Дані по конденсації парів А на адсорбенті В при Т = 293 К
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
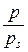
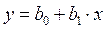 , де
, де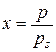 та
та 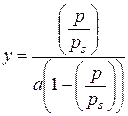 .
.
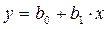 : b0 – як довжину відрізка, що відтинається прямою на осі ординат при х = 0, а b1 – як кутовий коефіцієнт (тангенс кута нахилу) прямої. З графіка визначаємо: b0 = 0,004 кг/моль, b1 = 0,377 кг/моль. Розв’язуємо систему рівнянь:
: b0 – як довжину відрізка, що відтинається прямою на осі ординат при х = 0, а b1 – як кутовий коефіцієнт (тангенс кута нахилу) прямої. З графіка визначаємо: b0 = 0,004 кг/моль, b1 = 0,377 кг/моль. Розв’язуємо систему рівнянь: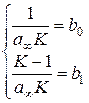 та знаходимо
та знаходимо 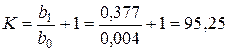 і
і 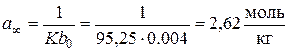 .
. .
. Експериментальні дані по конденсації пари бензолу на активованому вугіллі при Т = 293 К:
Експериментальні дані по конденсації пари бензолу на активованому вугіллі при Т = 293 К: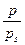
 , де V М – молярний об’єм адсорбату.
, де V М – молярний об’єм адсорбату.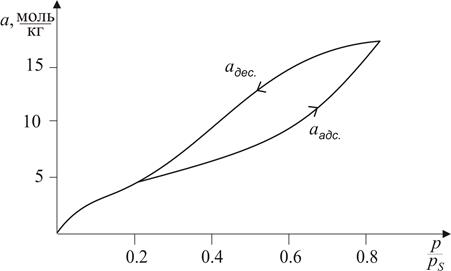
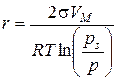 .
.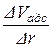 .
.
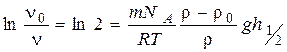 ,
,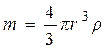 − маса сферичної частинки.
− маса сферичної частинки.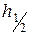 :
: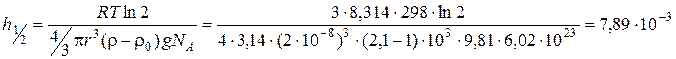 м
м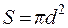 , а через n − число частинок в одиниці об’єму.
, а через n − число частинок в одиниці об’єму. , а розмір дорівнює діаметру частинок, розрахуємо питому поверхню палива:
, а розмір дорівнює діаметру частинок, розрахуємо питому поверхню палива: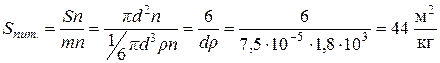 ;
; .
. ,
,
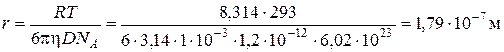 .
.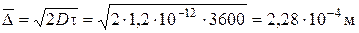 .
.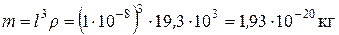 .
. частинок/ м3.
частинок/ м3.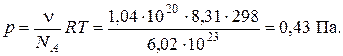
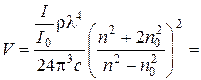

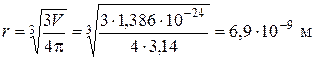 .
.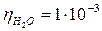 Н×с×м-2), якщо частинна концентрація (n, частинок/м3) золю змінюється у часі наступним чином:
Н×с×м-2), якщо частинна концентрація (n, частинок/м3) золю змінюється у часі наступним чином: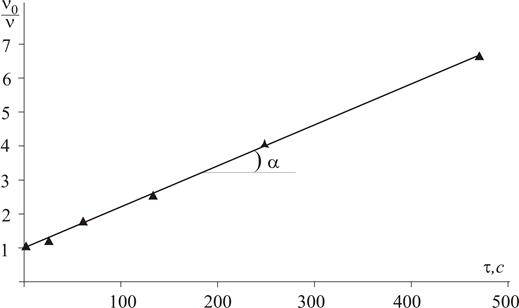

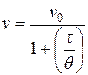 .
. частинок/м3.
частинок/м3.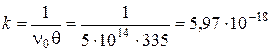 м3/(с×частинок).
м3/(с×частинок).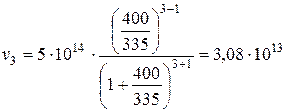 частинок/м3.
частинок/м3.


