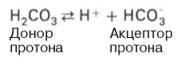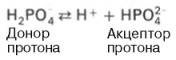Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гипоксия при патологических процессах, нарушающих снабжение или утилизацию кислорода тканями.
1.Дыхательный (легочный) тип гипоксии возникает в связи с альвеолярной гипервентиляцией, что может быть обусловлено нарушением проходимости дыхательных путей, уменьшением дыхательной поверхности легких (отек легкого). В подобных случаях снижаются РО2 в альвеолярном воздухе и напряжение кислорода в крови, в результате чего уменьшается насыщение гемоглобина кислородом. Обычно нарушается также выведение из организма углекислого газа, и к гипоксии присоединяется гиперкапния. 2.Сердечно-сосудистый (циркуляторный) тип гипоксии наблюдается при нарушениях кровообращения, приводящих к недостаточному кровообращению органов и тканей. Для газового состава крови в типичных случаях циркуляторной гипоксии характерны нормальные напряжение и содержание кислорода в артериальной крови, снижение этих показателей в венозной крови и высокая артериовенозная разница по кислороду. 3.Кровяной (гемический) тип гипоксии возникает в результате уменьшения кислородной емкости крови при анемиях, обусловленных значительным уменьшением эритроцитной массы или резким понижением содержания гемоглобина в эритроцитах. В этих случаях РО2 в венозной крови резко снижено. Гемическая гипоксия наблюдается также при отравлении оксидом углерода (образование карбоксигемоглобина) и метгемоглобинообразователями (метгемоглобинемия), а также при некоторых генетически обусловленных аномалиях гемоглобина. При образовании карбоксигемоглобина и метгемоглобина напряжение кислорода в венозной крови и тканях оказывается значительно пониженным, одновременно уменьшается артериовенозная разница содержания кислорода. 4.Тканевый (гистотоксический) тип гипоксии обычно обусловлен нарушением способности тканей поглощать кислород из крови. Утилизация кислорода тканями может затрудняться в результате угнетения биологического окисления различными ингибиторами, нарушения синтеза ферментов или повреждения мембранных структур клетки. Типичным примером тканевой гипоксии может служить отравление цианидами. Попадая в организм, ионы CN–активно взаимодействуют с трехвалентным железом, тем самым блокируя конечный фермент дыхательной цепи – цитохромоксидазу, в результате чего подавляется потребление кислорода клетками. Иными словами, при гистотоксической гипоксии ткани не в состоянии извлекать кислород из тканевых капилляров даже при высоком РО2.
Буферные системы крови. Нарушение кислотно-основного равновесия, причины,коррекция. Кислотно-основное равновесие – относительное постоянство реакции внутренней среды организма, количественно характеризующееся или концентрацией водородных ионов (протонов), выраженной в молях на 1 л, или водородным показателем – отрицательным десятичным логарифмом этой концентрации – рН. Буферная система представляет собой сопряженную кислотно-основную пару, состоящую из акцептора и донора водородных ионов (протонов). Буферные системы крови Установлено, что состоянию нормы соответствует определенный диапазон колебаний рН крови – от 7,37 до 7,44 со средней величиной 7,40. Кислотно-основное равновесие крови поддерживается совместным участием буферных систем плазмы и клеток крови. Важнейшими буферными системами крови являются бикарбонатная, фосфатная, белковая и наиболее мощная гемоглобиновая. Бикарбонатная буферная система – мощная и, пожалуй, самая управляемая система внеклеточной жидкости и крови. На долю бикарбонатного буфера приходится около 10% всей буферной емкости крови. Бикарбонатная система представляет собой сопряженную кислотно-основную пару, состоящую из молекулы угольной кислоты Н2СО3, выполняющую роль донора протона, и бикарбонат-иона НСО3–, выполняющего роль акцептора протона:
Бикарбонатная буферная система функционирует как эффективный регулятор в области рН 7,4. Механизм действия данной системы заключается в том, что при выделении в кровь относительно больших количеств кислых продуктов водородные ионы Н+ взаимодействуют с ионами бикарбоната НСО3–, что приводит к образованию слабодиссоциирующей угольной кислоты Н2СО3. Последующее снижение концентрации Н2СО3 достигается в результате ускоренного выделения СО2 через легкие в результате их гипервентиляции. Если в крови увеличивается количество оснований, то они, взаимодействуя со слабой угольной кислотой, образуют ионы бикарбоната и воду. При этом не происходит сколько-нибудь заметных сдвигов в величине рН. Кроме того, для сохранения нормального соотношения между компонентами буферной системы в этом случае подключаются физиологические механизмы регуляции кислотно-основного равновесия: происходит задержка в плазме крови некоторого количества СО2 в результате гиповентиляции легких.
Фосфатная буферная система представляет собой сопряженную кислотно-основную пару, состоящую из иона Н2РО4– (донор протонов) и иона НРО42– (акцептор протонов):
Роль кислоты в этой системе выполняет однозамещенный фосфат NaH2PO4, а роль соли двузамещенный фосфат – Na2HPO4. Фосфатная буферная система составляет всего лишь 1% от буферной емкости крови. В других тканях эта система является одной из основных. Буферное действие фосфатной системы основано на возможности связывания водородных ионов ионами НРО42– с образованием Н2РО4– (Н+ + + НРО42– —> Н2РО4–), а также ионов ОН– с ионами Н2РО4– (ОН– + + Н2 Р О4– —> HPO42–+ H2O). В крови максимальная емкость фосфатного буфера проявляется вблизи значения рН 7,2. Белковая буферная система имеет меньшее значение для поддержания КОР в плазме крови, чем другие буферные системы.
Белки образуют буферную систему благодаря наличию кислотно-основных групп в молекуле белков: белок–Н+ (кислота, донор протонов) и белок (сопряженное основание, акцептор протонов). Белковая буферная система плазмы крови эффективна в области значений рН 7,2–7,4. Гемоглобиновая буферная система – самая мощная буферная система крови. Она в 9 раз мощнее бикарбонатного буфера; на ее долю приходится 75% от всей буферной емкости крови. Участие гемоглобина в регуляции рН крови связано с его ролью в транспорте кислорода и углекислого газа. При насыщении кислородом гемоглобин становится более сильной кислотой (ННbО2). Гемоглобин, отдавая кислород, превращается в очень слабую органическую кислоту (ННb). Гемоглобиновая буферная система состоит из неионизированного гемоглобина ННb (слабая органическая кислота, донор протонов) и калиевой соли гемоглобина КНb (сопряженное основание, акцептор протонов). Точно так же может быть рассмотрена оксигемоглобиновая буферная система. Система гемоглобина и система оксигемоглобина являются взаимопревращающимися системами и существуют как единое целое. Буферные свойства гемоглобина прежде всего обусловлены возможностью взаимодействия кисло реагирующих соединений с калиевой солью гемоглобина с образованием эквивалентного количества соответствующей калийной соли кислоты и свободного гемоглобина: КНb + Н2СO3—> КНСO3 + ННb. Это обеспечивает поддержание рН крови в пределах физиологически допустимых величин, несмотря на поступление в венозную кровь огромного количества углекислого газа и других кисло реагирующих продуктов обмена.
|
||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 66; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.34.178 (0.005 с.) |